基于快速康复外科理念的量化活动联合营养干预对肝癌手术患者的影响
高建蕾,李 芳,李 静,宋丹丹,李维娜,申 娜,陈 瑾
(徐州医科大学附属医院 江苏徐州211000)
肝癌为常见恶性肿瘤,据不完全统计,全球每年约120万新增肝癌患者,成为全球发病率最高的恶性肿瘤,具有较高的致死率[1]。肿瘤患者的生活质量与营养状况存在密切关系,术后营养不良可降低机体免疫力,增加疾病的易感性和并发症发生率[2]。术后早期下床活动作为护理康复方案的重要组成部分,可加速机体组织修复,降低深静脉血栓形成和感染等并发症发生率。基于此,本研究将量化活动与营养支持相结合,通过直观和具体的康复方案促进肝癌手术治疗患者康复,观察临床效果,为临床提供数据与实践方案。现报告如下。
1 资料与方法
1.1 临床资料 选取2018年9月1日~2020年8月31日收治的89例肝癌手术患者。纳入标准:患者经病理学检查符合肝癌诊断标准;预计生存期≥6个月;年龄≥18岁;肝功能Child-Pugh分级A、B级;患者和家属了解本研究,并自愿签署知情同意书。排除标准:伴心、肝、肾功能障碍;合并呼吸功能障碍、精神障碍、严重腹泻、极度吸收不良者;既往行胃肠道、胆胆道手术治疗者;合并远处转移;合并其他器官肿瘤。将患者随机分为研究组44例和对照组45例。研究组男23例、女21例,年龄43~67(51.39±9.68)岁;疾病类型:胆管细胞癌19例,原发性肝癌25例。对照组男22例、女23例,年龄45~69(51.46±9.52)岁;疾病类型:胆管细胞癌21例,原发性肝癌24例。两组患者性别、年龄、疾病类型等一般资料比较差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会审批。
1.2 方法
1.2.1 对照组 实施快速康复外科理念护理模式。
1.2.2 研究组 实施基于快速康复外科理念的量化活动联合营养干预[3-7]。①量化活动。a.床上活动。术后2 h:采用垫软枕将床头抬高15°~20°;待麻醉清醒且生命体征平稳后可抬高床头30°~45°,责任护士辅助患者完成下肢被动活动,如足踝关节内外旋转和屈伸运动、下肢由远向近按摩、下肢肌肉按摩,单次运动3~5 min,3次/d。术后2~6 h:责任护士协助患者完成腹式缩唇呼吸训练,指导患者取舒适平卧位,轻闭双唇缓慢经鼻吸气并鼓腹,吸气最大限度后屏气3~5 s,随后将双唇呈吹口哨样并缓慢呼气,保持吸气与呼气时间比例为1∶1,单次训练5~10 min,2次/d。术后4~6 h:采用体位垫对患者进行翻身,抬高床头45°~60°,并指导患者进行床上关节活动和主动肌肉收缩。其中关节活动为指导患者进行主动足踝关节的内外旋、屈伸训练,单次训练时间5~10 min,2次/d;随后进行上肢抬高、放平及肘关节屈伸与握拳训练,下肢弯曲、放平、抬高、单脚蹬床面训练,均采取左右交换进行,每次5~10 min,3次/d。肌肉收缩训练是责任护士指导患者下肢放平,患者根据自我感受进行足背屈伸训练,每次10~15 min,3次/d,随后上肢放平,患者根据自我感受进行双手或单手握拳的放松训练,每次10~15 min,3次/d 。术后6~12 h:对于无疲劳或轻度疲劳且无活动性出血患者,可协助抬高床头90°,保持坐姿3 min,身体无明显不适者,患者、家属及责任护士协助腰部与肩部用力后完成床上坐起,无心悸、眩晕者可尝试床旁站立,随后双腿下垂及床旁行走。b.床下活动。术后24 h:责任护士协助患者床旁站立5~10 min,无眩晕、心悸、恶心、呕吐等症状后,护理人员或家属可协助患者床旁行走,不可远离床旁单独在室内活动。术后1 d:护理人员或家属陪伴患者在室内或宽敞走廊单独行走,160~250步/d。术后2 d:251~700步/d。术后3 d:701~1000步/d。三阶段训练后患者可逐渐户外行走,2~3次/d,未完成以上训练项目者应由护理人员和家属继续监督完成[8-9]。②营养支持。乳清蛋白粉1次1勺,温水250 ml冲服,2次/d或分离乳清蛋白1次1袋,温水冲服,2次/d。
1.3 观察指标 ①比较两组患者营养生化指标,包括血清白蛋白、前白蛋白、血红蛋白。②比较两组患者肝功能生化指标,包括总胆红素(Tbil)、谷丙转氨酶(Alt)、谷草转氨酶(Astalt)[10-11]。③比较两组患者免疫功能生化指标,包括CD3+、CD4+、CD4+/CD8+比值。④比较两组患者首次排气时间、住院时间、住院费用。
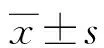
2 结果
2.1 两组患者营养生化指标比较 见表1。
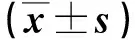
表1 两组患者营养生化指标比较
2.2 两组患者肝功能生化指标比较 见表2。
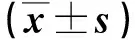
表2 两组患者肝功能生化指标比较
2.3 两组患者免疫功能生化指标比较 见表3。
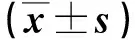
表3 两组患者免疫功能生化指标比较
2.4 两组患者首次排气时间、住院时间、住院费用比较 见表4。

表4 两组患者首次排气时间、住院时间、住院费用比较
3 讨论
肝脏正常生理状态下能够为机体提供20%~30%的能量,当肝脏发生硬化等疾病时,受机体代谢失衡影响,会出现高分解代谢、营养不良及肝脏能量代谢降低症状[12]。肝癌患者受疾病与治疗影响,处于高应激反应和免疫抑制状态,成为肝癌术后康复延迟和复发的重要因素[13]。肝癌患者在切除病灶后,如何保证肠道黏膜的完整性、纠正免疫功能抑制、避免肠源性感染成为提高肝癌患者术后快速康复和预防复发的关键之一。
3.1 营养支持有助于肝癌患者术后免疫功能和营养状态恢复 多数肝癌患者存在免疫功能异常情况,以CD4+减少和CD8+增多为主要免疫功能低下临床指标表现。本研究两组患者免疫功能生化指标比较差异有统计学意义(P<0.05);由此可见营养支持可快速恢复T细胞亚群的平衡,改善免疫功能,避免发生术后早期复发和转移[14]。外科手术治疗患者肠外营养有助于保护肠道黏膜屏障,避免细菌异位,且营养物质中脂肪酸避免肿瘤细胞的利用,减少肝胆并发症发生[15]。此外,肠外营养支持可增加肠道和肝内血流,在保护肝脏网状内皮系统的基础上,维持新生肝脏组织抵抗病原体的能力,促进肝脏细胞修复,促进胆汁的生成和分泌,降低机体应激反应能力,快速修复肝脏功能,增加细胞免疫功能,还可逆转肝癌患者的免疫抑制状态,成为肿瘤患者的重要辅助治疗措施[15]。结果显示,两组患者的营养化指标和肝功能生化指标比较差异有统计学意义(P<0.01)。
3.2 量化活动有助于肝癌患者术后早期康复 量化活动是采用标准化流程,遵循循证资料,由医护团队集思广益,根据患者个体化差异制定康复方案。调查结果显示,研究组患者术后首次排气时间、住院时间及住院费用与对照组比较差异均有统计学意义(P<0.01),说明缩短住院时间一方面可减少医源性感染,另一方面还可缓解患者经济压力和心理压力,提高患者对护理服务质量满意度[16]。对患者实施有计划、有目的的活动干预,患者通过不同体位变换,可刺激肠道蠕动,缩短肛门首次排气时间,减少肠道粘连等并发症发生。若肛门未排气可导致患者腹胀,严重者会导致切口裂开或疼痛,直接影响预后效果。量化活动为肝癌术后重要的护理措施,是促进机体功能恢复和减少并发症的关键性护理措施[17]。
控制肿瘤、延长生存期、提高生命质量为肝癌临床的主要目的,而量化活动与营养支持两者有效结合,在保证患者治疗安全性的同时,可促进患者机体免疫和肝脏功能快速恢复,减少肠外营养不耐受所致不良反应,缩短住院时间,减少住院费用,提升医疗资源利用率,值得临床广泛推广应用。

