杧果SC-SSR分子标记反应体系的建立与优化
覃昱茗 张宇 黄国弟 莫永龙 罗世杏 荣涛


摘 要:采用正交设计方法,对影响PCR反应体系的5个因素(Mg2+、Taq DNA聚合酶、dNTPs、引物和模板DNA)进行了优化,建立了适用于杧果的SC-SSR-PCR反应体系。结果表明,总反应体系25 μL中,包含模板DNA用量100 ng·mL-1、Mg2+浓度2.00 mmol·L-1、引物浓度0.40 μmol·L-1、Taq DNA 聚合酶浓度1.00 U、dNTPs浓度0.15 mmol·L-1。利用优化的杧果SC-SSR-PCR反应体系对10对SC-SSR引物进行验证,均能扩增出清晰、明亮、特异的电泳条带。因此,优化的杧果SC-SSR-PCR反应体系适用于杧果种质鉴定和亲缘关系分析。
关键词:杧果 SC-SSR 正交设计 体系优化
中图分类号:S667.7 文献标识码:A
杧果(Mangifera indica L.)为漆树科重要常绿经济果树,原产印度,其果实风味极佳[1]。国内海南、广东、广西、福建、云南、贵州、四川均有栽培[2-3]。起始密码子-微卫星扩增多态性(start codon simple sequence repeat,SC-SSR)标记是郭大龙等结合SCoT和ISSR分子标记技术开发出来的一种既能将标记位点与表达序列紧密联系,又具有相对较高多态性的新型分子标记[4]。目前,SC-SSR标记已应用于猕猴桃遗传多态性分析及其指纹图谱构建,但在其他物种中的应用研究在国内并不多[5]。
由于杧果高度异花授粉,种子高度杂合,且生产交易中往往存在同物异名和异物同名等问题,给杧果育种工作带来了诸多阻碍[6-8]。SC-SSR分子标记在种质鉴定方面具有独特的优势,但在杧果中尚未有报道。基于这些问题,本研究较全面地建立并优化杧果的SC-SSR反应体系,为其在杧果种质资源评价、遗传多样性分析等领域的应用提供技术参考。
1 材料与方法
1.1 材料与仪器
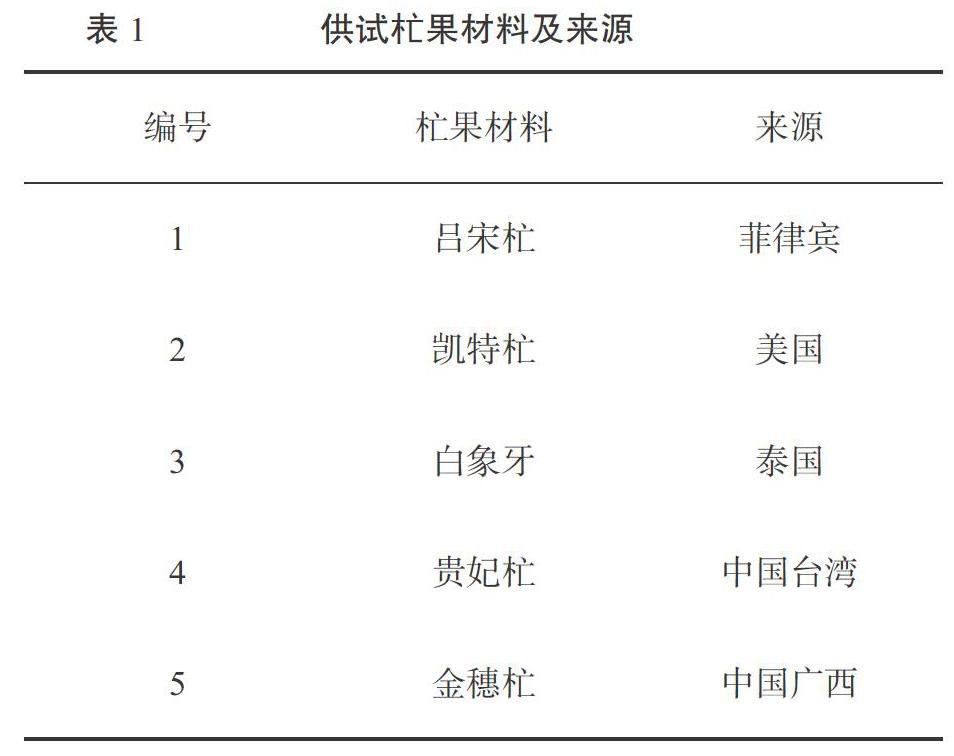
5份杧果材料(表1)采集自广西大学农学院果树种质资源圃。所用的10条SCoT引物和10条ISSR引物(表2)由生工生物工程(上海)股份有限公司合成。dNTPs、Taq DNA聚合酶、DNA marker购买于北京天根生化科技有限公司。
实验仪器:凝胶成像系统(Bio-rad Geldoc XRt)、三恒电泳仪(HAD-JY600C)、Eppendorf离心机5810R、超微量分光光度计、Applied Biosystems 2720 Thermal Cycler PCR仪。
1.2 基因组DNA提取及质量检测
选取健康无病虫侵害以及机械损伤的杧果绿色嫩叶,放入冰盒中迅速带回实验室,采用植物DNA提取试剂盒(DNA secure plant Kit,天根生化科技北京有限公司)获取芒果基因组DNA,通过测定230 nm、260 nm和280 nm波长下的OD值和琼脂糖凝胶电泳成像检测DNA的纯度和浓度,保存于-30℃冰箱以备后续研究。
1.3 正交试验确定SC-SSR-PCR反应体系
参考杧果CDDP-PCR反应体系研究的方法[7],设计5因素4水平的L16(45)正交优化试验方案(表3)。5因素分别为:Mg2+浓度、Taq DNA聚合酶、dNTPs、引物和模板DNA。该试验设计方案共产生16个处理,每个处理做3次重复,各处理总体系均为25 μL。根据琼脂糖凝胶电泳的扩增结果对每个处理结果进行打分,打分范围1-16,打分标准为条带清晰度、整齐度、明亮度、丰富性、特异性[9]。打分结果用SPSS 10.0软件进行统计分析。
1.4 SC-SSR-PCR优化体系的确认与验证
PCR扩增程序为:95 ℃预变性5 min;前2个循环:95 ℃变性1 min,40 ℃退火1 min,72 ℃延伸100 s;后28个循环:95 ℃变性1 min,50 ℃退火1 min,72 ℃延伸100 s;最后72 ℃延伸8 min。將扩增产物在1.5%质量浓度的琼脂糖凝胶中电泳,并在凝胶成像仪内拍照,分析图片。根据上述试验结果确定SC-SSR-PCR的最佳反应体系,随机选用10个组合对5份杧果材料进行PCR扩增,从而进一步确证最优的杧果SC-SSR-PCR扩增体系。
2 结果与分析
2.1 正交试验结果分析
以ISSR引物807和SCoT引物SC8作为组合引物为例,进行16个处理的SC-SSR-PCR扩增,结果差别较大。处理1肉眼可见的扩增条带只有一条,处理11、12、14扩增出的条带数量多、亮度高且条带整齐,扩增效果较为理想;其余处理也可以扩增出多条条带,但整齐度和亮度远不及处理11、12、14所得结果。
2.2 5个因素对SC-SSR-PCR反应的影响分析
依据表3的评分结果进行统计分析,最终得到各因素的平均值和极差值,结果见表4。其中极差R值是反映某一因素对该反应体系构建影响的强弱,R越大代表该因素对PCR结果影响越大。由表4可知,该反应体系中5因素对PCR结果影响强弱的最终排序是模板DNA>Mg2+>引物>Taq DNA 聚合酶>dNTPs。通过差异显著性分析表明,模板DNA与其他的4个因素存在显著差异;Mg2 +和引物之间差异不显著,Taq DNA 聚合酶和dNTPs之间差异不显著。
表5结合表3数据分析可知,DNA模板用量为100 ng和135 ng时,对试验结果无显著差异,但与65 ng、30 ng用量相比存在显著差异;Mg2+浓度为1.50 mmol·L-1和2.0 mmol·L-1时,对试验结果无显著差异,但与1.0 mmol·L-1、2.5 mmol·L-1浓度相比存在显著差异;引物浓度为0.60 μmol·L-1和1.00 μmol·L-1时,对试验结果无显著差异,但引物浓度为0.4 μmol·L-1、0.80 μmol·L-1时,对试验结果存在显著差异;Taq DNA聚合酶用量为0.25 U和1.00 U时,对试验结果无显著差异,但与0.50 U、0.75 U用量相对比存在显著差异;dNTPs浓度仅为0.10 mmol·L-1时,与其它3个浓度水平存在差异显著,而其它3个浓度水平之间差异不显著。
T1~T4,每一因素同一水平下的打分总和;不同的小写字母表示总分的差异显著(P<0.05) ,T1~T4分别与表3中的(1)~(4)对应。
2.3 SC-SSR-PCR反应体系稳定性验证
根据正交试验设计的优化结果,选用10对SC-SSR标记引物(表2,每行引物一一对应)分别对5份杧果材料进行SC-SSR扩增,以验证该体系在不同引物组合下的稳定性。由图2可知,10对SC-SSR引物均可以扩增出清晰明亮的琼脂糖凝胶电泳条带,只是不同的SC-SSR引物扩增出的共有性和特异性条带数量有所不同,其中共有性条带表现了杧果种内的稳定遗传性,特异性条带体现了品种间的遗传差异,表明该优化体系以及引物适用于杧果SC-SSR-PCR分析。
3 结论与讨论
与单因素多水平逐级优化法相比,正交优化分析法将反应体系内不同因素之间的相互影响考虑入内,大大降低了只针对某一因素确定最佳浓度或用量的片面性[10-16]。正交优化试验设计除了考虑到各因素之间的综合效应,同时兼具省时、省力的特点优势[17-18]。
房志超对杧果ISSR反应体系的建立进行了优化,运用L16(45)正交设计对杧果ISSR反应的模板DNA、Mg2+、dNTPs、引物和Taq DNA聚合酶在4个水平上进行优化试验,总反应体系25 μL,结果发现影响杧果ISSR-PCR反应的因素从大到小依次为:模板Mg2+>引物>Taq DNA 聚合酶>dNTPs>DNA[19];而表4结果显示影响杧果SC-SSR-PCR反应的因素从大到小依次为:模板DNA>Mg2 +>引物>Taq DNA 聚合酶>dNTPs;这有可能是因为SC-SSR是基于雙引物开发出的分子标记技术,双引物需要更精准地与模板DNA进行锚定,需要的模板DNA用量显得尤为重要,而ISSR标记是随机分子标记,较少的模板DNA用量进行PCR扩增即可表现出丰富的遗传多样性条带,因而造成了各影响因素的重要性不尽相同。目前在杧果中尚未发现SCoT反应体系建立优化的相关报道,但是在其它多年生木本果树中已出现相关研究报道。在荔枝中,5个因素对PCR反应体系的影响由大倒小依次为:dNTPs>Mg2 +>模板DNA>引物>Taq DNA 聚合酶[20];在榴莲蜜中,各因素在不同水平的变化对PCR反应体系的影响为:dNTPs>引物>Mg2 +>Taq DNA 聚合酶>模板DNA[21]。上述研究表明,在荔枝和榴莲蜜中进行SCoT反应体系建立与优化,dNTPs都是对SCoT反应体系建立影响最大的因素,这很有可能是因为在进行SCoT-PCR扩增时,需要经过更为复杂地反应扩增程序,模板DNA需要不断的进行双螺旋结构的分解、复制过程,需要大量的碱基原材料才能完成完善上述PCR扩增,需要dNTPs提供PCR反应进行的大量原材料,因此dNTPs成为影响SCoT反应体系建立与优化最重要的因素。
依据笔者研究结果分析得出较为理想的SC-SSR-PCR反应体系的建立可以选择模板DNA的用量为100 ng或135 ng,表5显示100 ng和135 ng模板DNA用量对SC-SSR-PCR反应体系的建立结果影响无显著差异,本着节约原则,可选用100 ng模板DNA用量;由正交试验L16(45)设计以及PCR凝胶电泳分析得出较为理想的SC-SSR-PCR反应体系的建立可以选择Mg2 +浓度2.00 mmol·L-1或2.50 mmol·L-1,但表5显示2.00 mmol·L-1和2.50 mmol·L-1Mg2 +浓度对SC-SSR- PCR反应体系的建立结果影响有显著差异,因此Mg2+ 浓度选择待定;依据Mg2 +浓度选择的分析原理,SC-SSR-PCR反应体系的建立可以选择引物浓度为0.40 μmol·L-1或0.60 μmol·L-1,但表5显示0.40 μmol·L-1和0.60 μmol·L-1引物浓度对SC-SSR-PCR反应体系的建立结果影响有显著差异,因此引物浓度选择待定;Taq DNA聚合酶用量也采用同样的分析原则,较为理想的SC-SSR-PCR反应体系的建立可以选择Taq DNA聚合酶用量0.50 U或0.75 U或1.00 U,但表5显示0.50 U、0.75 U和1.00 U Taq DNA聚合酶用量对SC-SSR-PCR反应体系的建立结果影响有显著差异,因此Taq DNA聚合酶用量选择待定;SC-SSR-PCR反应体系的建立可以选择dNTPs浓度0.10 mmol·L-1或0.15 mmol·L-1或0.20 mmol·L-1,但表5显示0.15 mmol·L-1和0.20 mmol·L-1dNTPs浓度对SC-SSR-PCR反应体系的建立结果影响无显著差异,而0.10 mmol·L-1dNTPs浓度与0.15 mmol·L-1和0.20 mmol·L-1 dNTPs浓度对SC-SSR-PCR反应体系的建立结果影响有显著差异,本着节约原则dNTPs浓度在0.10 mmol·L-1和0.15 mmol·L-1之间做选择。上述分析可以明确模板DNA用量为100 ng,凝胶电泳显示处理11、12和14可以扩增出清晰、层次分明的条带,而只有处理12的模板DNA用量确定为100 ng,由此做出模板DNA用量100 ng·mL-1、Mg2+浓度2.00 mmol·L-1、引物浓度0.40 μmol·L-1、Taq DNA 聚合酶浓度1.00 U、dNTPs浓度0.15mmol·L-1的各组分浓度组合选择。
依据上述分析,可以判断反应体系内5因素对PCR结果影响强弱的最终排序是:模板DNA>Mg2+>引物>Taq DNA 聚合酶>dNTPs。正交反应体系各因素的最佳浓度或用量组合是:模板DNA用量100 ng·mL-1、Mg2 +浓度2.00 mmol·L-1、引物浓度0.40 μmol·L-1、Taq DNA 聚合酶浓度1.00 U、dNTPs浓度0.15 mmol·L-1。10对SC-SSR引物均能扩增出条带整洁、主次分明、特异丰富的凝胶电泳结果,表明SC-SSR引物以及反应体系适用于杧果的亲缘关系分析。
参考文献
[1] 陈业渊,党志国,林电,等.中国杧果科学研究70年[J].热带作物学报,2020,41(10):2034- 2044.
[2] 李玉萍,叶露,梁伟红,等.我国芒果产业数据资源现状与发展对策[J].热带农业科学,2020,40(8):105-109.
[3] 黄乃芬,黄浩洲.广西芒果产业优势与发展的思考[J].广西经济,2016,(11):43-45.
[4] 郭大龙,侯小改,刘崇怀,等.一种新的DNA分子标记技术——起始密码子-微卫星扩增多态性[J].植物生理学报,2012,48(4):408- 412.
[5] 张安世,张中海,齐秀娟,等.猕猴桃SC-SSR遗传多态性分析及指纹图谱构建[J].分子植物育种,2017,15(11):4706-4714.
[6] 张宇,黄国弟,莫永龙,等.适合转录组测序的芒果不同组织RNA试剂盒提取方法研究[J].经济林研究,2019,37(1):32-36.
[7] 張宇,黄国弟,黄强,等.芒果CDDP分子标记正交优化设计及引物筛选[J].福建农林大学学报(自然科学版),2017,46(5):546-551.
[8] 张宇,王长江,唐志鹏,等.ISSR分子标记对杧果实生苗父本的早期鉴定[J].南方农业学报,2014,45(1):7-11.
[9] 何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[10] 石琳,胡延萍,王建科,等.云生毛茛ISSR-PCR体系优化与引物筛选[J].生物技术报,2016,(9):65-71.
[11] 胡延萍,包蕊,王莉,等.西藏嵩草ISSR-PCR反应体系优化研究[J]. 广西植物,2016,36(8):915-922.
[12] JIANG L Y,ZANG D K.Analysis of genetic relationship in Rosa rugosa using conserved DNA-derived polymorphism markers[J].Biotechnology & Biotechnological Equipment,2018,32(1):88-94.
[13] 王心迪,黄如葵,冯诚诚,等.正交设计直观分析法优化苦瓜SSR-PCR反应体系[J].北方园艺,2016,(10):99-103.
[14] 闵学阳,刘文献,张正社,等.苜蓿DUS测试标准品种SSR分子标记指纹图谱的构建[J].草业学报,2017,26(11):47-56.
[15] 贾新平,孙晓波,梁丽建,等.绣球SSR-PCR反应体系的建立与优化[J].华北农学报(自然科学版),2016,31(4):68-73.
[16] 尚小红,严华兵,曹升,等.葛根SCoT-PCR反应体系优化及引物筛选[J].南方农业学报,2018,49(1):1-7.
[17] 黄志峰,李得堂,等.正交试验法优化丹七活血丸成型性工艺研究[J].中国药业,2020,29(13):42-43.
[18] 巨秀婷,梁银娟,唐楠,等.基于正交设计优化兰州百合鳞片埋培环境条件[J].南方农业学报,2020,51(6):1392-1399.
[19] 房志超,黄建峰,高爱平.芒果ISSR反应体系的建立与优化[J]. 热带作物学报,2011,32(2):203-207.
[20] 夏玲,秦永华,刘成明,等.荔枝SCoT-PCR反应体系的建立及其在遗传分析中的应用[J].中国农学通报,2014,30(13):147-156.
[21] 崔健,胡福初,陈哲,等.榴莲蜜基因组DNA提取方法比较及SCoT反应体系的优化[J].分子植物育种,2017,15(4):1338-1346.

