小鼠膀胱组织中驻留αβT和γδT细胞表型和细胞因子表达的探讨①
万顺巧 吴琼丽 康双朋 杨滨燕 吴长有(中山大学中山医学院免疫学研究所,广州510080)
膀胱癌是指发生在膀胱黏膜上的恶性肿瘤,是泌尿系统最常见的恶性肿瘤,也是十大常见肿瘤之一,其发病率居全球第九位,病死率居泌尿系统恶性肿瘤前列。膀胱癌是一个巨大的社会负担,男性发病率为女性的3~4倍,其中女性患者确诊后预后更差,多数患者在出现肉眼血尿后经尿道膀胱镜检查才被确诊[1-2]。尽管有放疗、化疗、经尿道膀胱肿瘤切除术、BCG灌注治疗和免疫检查点抑制剂等多种治疗方式相结合,但膀胱癌的5年生存率和治疗效果并未得到很大的改善[3-4]。近年来在不同组织器官中发现组织驻留记忆T细胞(TRM),并在实体瘤中发挥着重要作用,肿瘤中的TRM与癌症患者的疾病进展相关[5-7]。此外有研究报道γδT细胞在炎症早期免疫应答早于Th17,在肿瘤免疫中发挥着重要作用[8]。有文献表示IL-17与炎症细胞变化有关,而膀胱癌的发生发展一直伴随着炎症[9]。因此本研究着重研究小鼠膀胱T细胞的表型、细胞因子及作用,为膀胱癌更进一步的免疫治疗研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞 6~8周龄C57BL/6雌性小鼠,购自中山大学实验动物中心(SYXK2015-0107);MB49膀胱癌细胞由孙逸仙纪念医院生物岛十号实验室提供。
1.1.2 实验试剂 流式抗体:PE-CF549抗鼠CD3(145-2C11)、APC-CyTM7(OX-35)、FITC抗鼠CD4(GK1.500)、Percp-CyTM5.5抗鼠CD8(53-6.7)、Percp-CyTM5.5抗鼠CD44(IM7)、PE抗鼠γδT(V65)、FITC抗 鼠CD45(OX-1)、PE-CyTM7抗 鼠CD69(H1.2F3)、PE抗鼠CD103(M290)、PE-CyTM7抗鼠IFN-γ(XMG1.2)、PE抗鼠IL-17A(TC11-18H10),APC-CyTM7抗鼠TNF-α(MP6-XT22)、PE抗鼠CXCR3(CXCR3-173)和PE-CyTM7抗鼠CXCR5(2G8)均购自BD公司;免疫组化与荧光抗体:CD3一抗、γδT一抗和二抗均购自abcam公司;二抗CD3购自碧云天公司;小鼠外周血淋巴细胞分离液购自天津灏洋生物公司;Percoll购自上海硕欣生物科技公司。Ⅰ型胶原酶、离子霉素(Ionomycin)、佛波酯(PMA)、布雷非德菌素A(BFA)均购自Sigma公司;0.25%胰蛋白酶、不完全RPMI1640培养液、胎牛血清(FBS)、谷氨酰胺及青霉素、链霉素均购自Gibco公司;柠檬酸钠抗原修复液(×50)购自solarbio;牛血清白蛋白(BSA)和二甲基亚砜(DMSO)购自北京鼎国昌盛生物技术公司。
1.1.3 实验仪器 流式细胞仪(BD AiralⅡ)购自BD公司;荧光显微镜(OLYMPUS-BX53)购自Olympus公司;二氧化碳培养箱(Galaxy170-300)购自Galaxy公司;台式冷冻离心机(Eppendorf-5810R)购自Eppendorf公司;26 G无菌静脉留置针购自平民药业官方旗舰店。
1.2 方法
1.2.1 小鼠外周血和膀胱组织单个核细胞制备小鼠外周血单个核细胞的分离:眼球取血,肝素抗凝,Ficoll密度梯度离心后Hank's液洗涤,细胞计数后用完全RPMI1640重悬为2×106个/ml用于后续实验。膀胱组织单个核细胞制备:腹腔注射4%水合氯醛,眼眶取血后进行心脏灌注,用剪刀和镊子分离膀胱组织,Hank's液洗涤,剪刀充分剪碎组织,0.02 g/ml胶原酶Ⅰ型消化2 h,100μm滤网过滤,随后配制70%和40%Percoll溶液进行密度梯度离心,Hank's液洗涤,用完全RPMI1640培养基重悬为2×106个/ml用于后续实验。
1.2.2 细胞培养 将MB49细胞培养于T-75培养瓶中,37℃、5%CO2培养箱中每2~3 d换液,当细胞长至培养瓶90%以上时,使用0.25%胰蛋白酶消化3 min,台盼蓝计数后将细胞用无菌1×PBS重悬为1×107个/ml备用。
1.2.3 原位膀胱癌模型的建立 4%水合氯醛腹腔注射麻醉小鼠,26 G静脉留置针外涂液体石蜡油后无菌经尿道插入膀胱,PBS冲洗膀胱1次,0.1 ml胰蛋白酶灌注入膀胱并保留20 min,随后用PBS冲洗2次,注入0.1 ml MB49细胞悬液并使小鼠仰卧。
1.2.4 小鼠体内标记CD45荧光抗体 固定小鼠,将配好的200μl CD45荧光抗体(抗体∶PBS=1∶50)通过尾静脉注射入小鼠体内,5 min后进行眼球取血、心脏灌注等操作。
1.2.5 流式细胞术 表面分子染色:将小鼠外周血和膀胱细胞用含0.1%BSA的1×PBS洗涤2次后加入荧光标记的表面分子染色抗体,4℃避光孵育30 min,洗涤2遍,等待上机检测。细胞因子染色:表面分子染色结束后,洗涤1次,加入4%PFA室温避光固定8 min,再洗涤2次,加入含0.1%的BSA和Saponin的1×PBS 4℃过夜,洗涤1次,加入相应的胞内染色抗体,4℃避光孵育30 min,洗涤2次,重悬,流式细胞术检测并分析。
1.2.6 HE、免疫组化和免疫荧光染色 小鼠膀胱使用中性福尔马林固定,石蜡包埋,切片,脱蜡和水化,随后用苏木素,伊红染色。免疫组化和免疫荧光染色用pH6.0柠檬酸钠抗原修复液微波修复30 min,滴加10%山羊血清封闭,滴加一抗4℃过夜,滴加二抗,37℃反应30 min,组化滴加DAB显色液后显微镜下观察出现棕黄色颗粒时终止,中性干胶封片。免疫荧光滴加抗荧光猝灭液封片。
1.3 统计学分析 采用SPSS22.0以及GraphPad Prism8软件进行制图与统计分析。所有数据均以±s表示,采用单因素t检验分析,P<0.05表示差异具有统计学意义。
2 结果
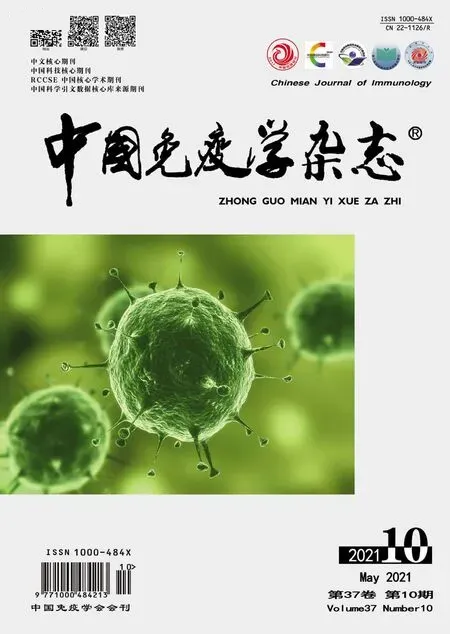
2.1 小鼠膀胱组织中非循环T细胞的分布 小鼠尾静脉注射抗CD45的荧光抗体,5 min后进行心脏灌注,然后分离膀胱,脾和外周血中的细胞,流式细胞术分析非循环T细胞(CD45-CD3+)和循环T细胞(CD45+CD3+)的比例(图1A)。外周血中99.6%的T细胞是CD45+CD3+细胞,小鼠膀胱和脾中CD45-CD3+的非循环T细胞占99%以上(图1B)。表明小鼠膀胱组织中的T细胞是非循环的T细胞。
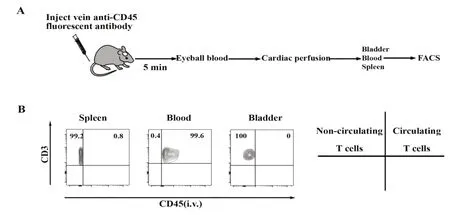
图1 非循环和循环T细胞在正常小鼠膀胱、脾和血液中的比较Fig.1 Comparisons of non-circulating and circulating T cells in bladder,spleen and blood of normal mice
2.2 小鼠膀胱组织与外周血CD3+T、CD4+T、CD8+T和γδT细胞的表达差异 分离小鼠膀胱和外周血单个核细胞,流式染色后分析CD3+T、CD4+T、CD8+T和γδT细胞的比例。去除黏连体和死细胞干扰后结果显示,外周血中的CD3+T细胞比例为48.30%[(48.18±1.90)%],显著高于膀胱组织中CD3+T细胞比例38.30%[(34.48±4.22)%],同时外周血中的CD4+T细胞比例为65.10%[(65.46±1.76)%],显著高于膀胱组织中的CD4+T细胞比例30.90%[(29.04±1.16)%],外周血中的CD8+T细胞比例为32.30%[(32.20±0.83)%],明显高于膀胱组织中CD8+T细胞比例20.10%[(20.04±0.25)%],而膀胱组织中的γδT细胞比例为35.50%[(33.56±3.38)%],显著高于外周血中γδT细胞比例1.85%[(1.51±0.37)%](图2A、B),差异具有统计学意义(P<0.05)。
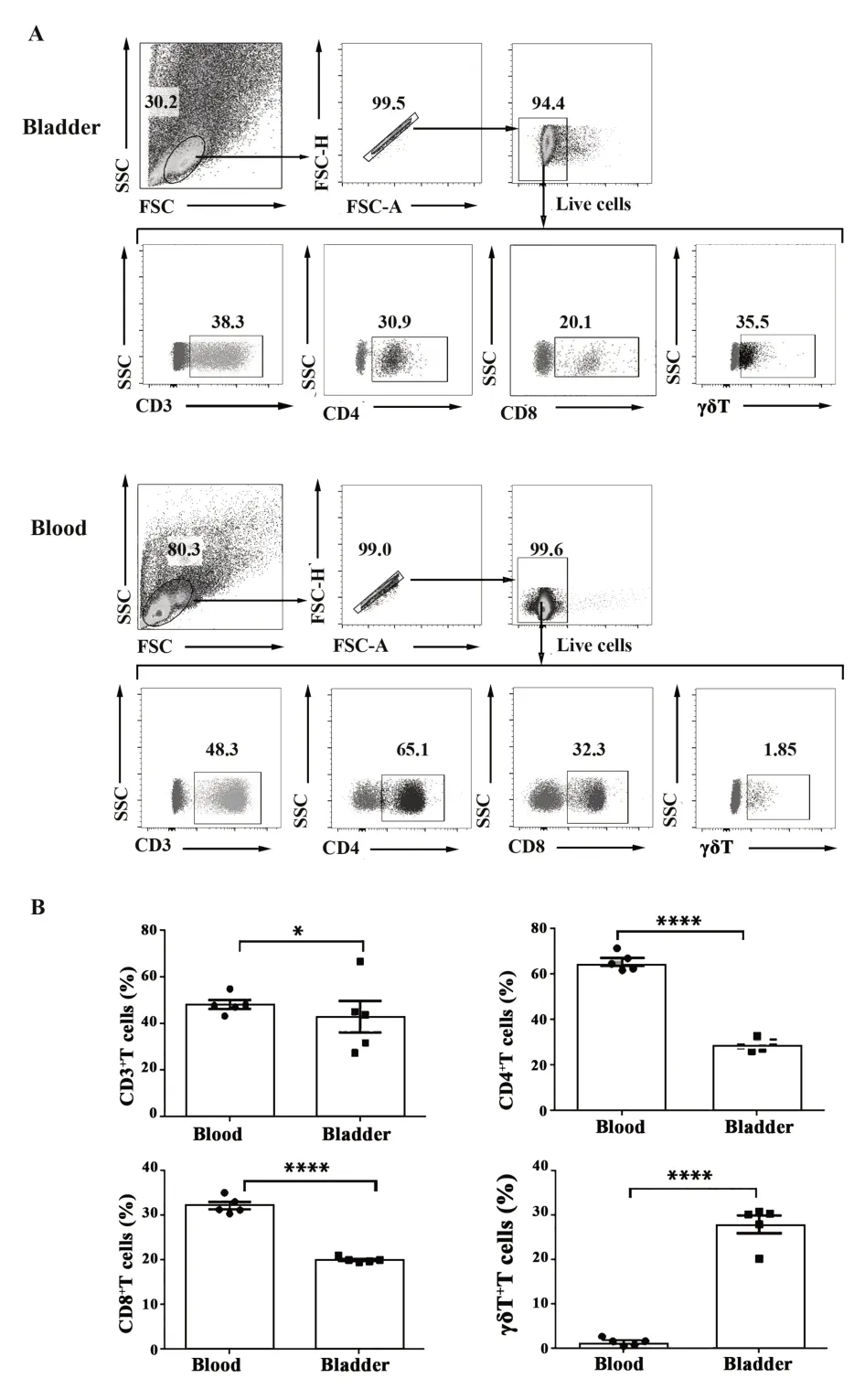
图2 小鼠膀胱组织和外周血中CD3+T、CD4+T、CD8+T和γδT细胞百分比Fig.2 Percentages of CD3+T,CD4+T,CD8+T andγδT cells in murine bladders and blood
2.3 小鼠膀胱组织与外周血中组织记忆T细胞的分布情况 为了明确膀胱组织中非循环T细胞和外周血循环T细胞的表型差异,流式细胞术分析记忆细胞标志分子CD44的表达。流式结果显示,小鼠膀胱组织中CD44+T的比例为93.50%[(92.48±1.20)%],显著高于外周血CD44+细胞的比例22.50%[(22.68±1.67)%](图3A、B)。进一步分析小鼠膀胱组织与外周血中T细胞表达组织驻留分子CD69和CD103的情况,发现小鼠膀胱组织CD3+CD44+、CD4+CD44+、CD8+CD44+和γδT+CD44+细胞均高表达CD69+CD103+和CD69+CD103-的TRM亚群,外周血CD3+CD44+、CD4+CD44+、CD8+CD44+和γδT+CD44+细胞均高表达CD69-CD103+的TRM亚群。而膀胱组织中CD3+CD44-、CD4+CD44-、CD8+CD44-和γδT+CD44-细胞与外周血相比,也均高表达CD69+CD103+和CD69+CD103-的TRM亚群。综上说明小鼠膀胱组织中无论是记忆还是非记忆的T细胞均表达组织驻留分子CD69和CD103(图3C、D),差异具有统计学意义(P<0.05)。
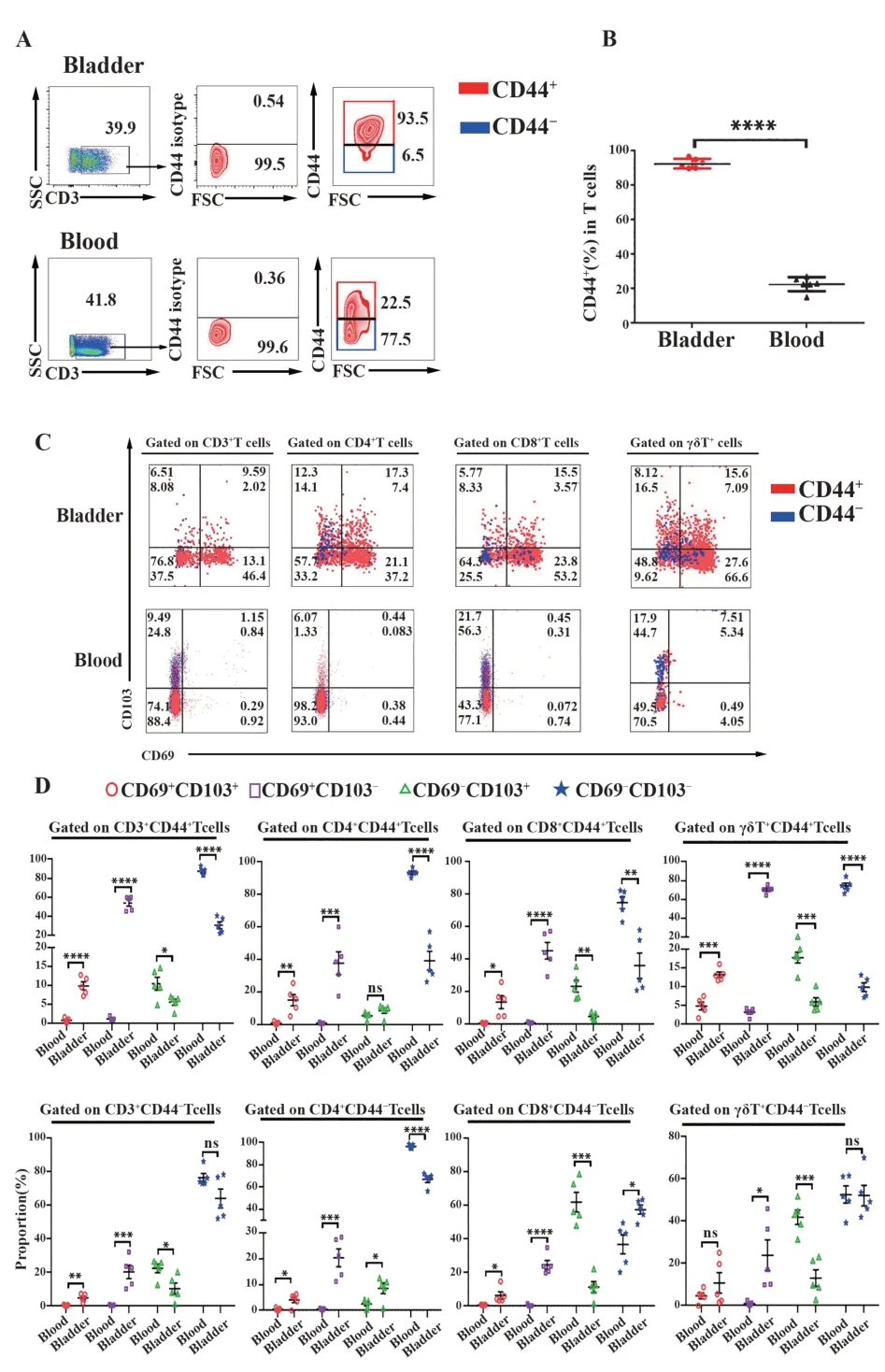
图3 膀胱组织和外周血中T细胞CD69和CD103的表达Fig.3 Expressions of CD69 and CD103 on T cells from bladders and blood
2.4 小鼠膀胱组织和外周血中T细胞亚群表达CXCR3和CXCR5的分析 与外周血相比,膀胱组织中CD3+T、CD4+T、CD8+T和γδT细胞显著高表达趋化因子受体CXCR3和CXCR5(图4A、B),差异具有统计学意义(P<0.05)。
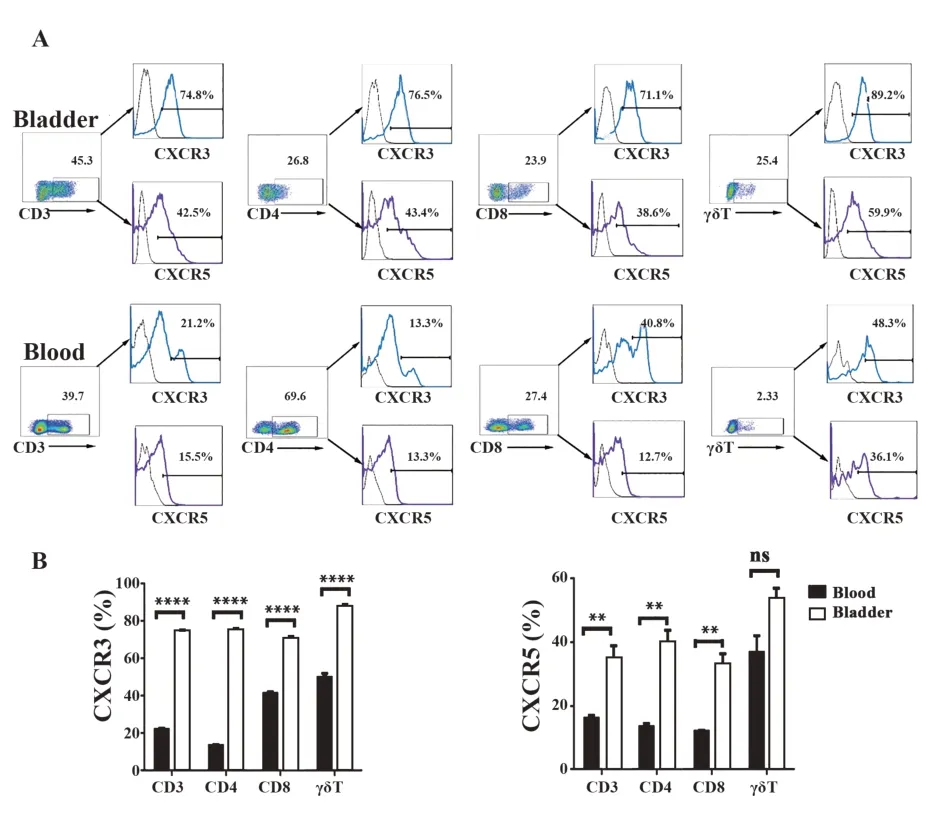
图4 CXCR3和CXCR5在外周血和膀胱组织T细胞亚群中的表达分析Fig.4 Expressions of CXCR3 and CXCR5 on T cell subsets in blood and bladder tissues
2.5 小鼠膀胱组织和外周血T细胞产生细胞因子IL-17、IFN-γ和TNF-α的差异比较 流式结果显示,经PMA和ionomycin刺激后,与外周血相比,小鼠膀胱组织中的CD3+T、CD4+T、CD8+T和γδT细胞均显著高表达IL-17和TNF-α,此外CD4+T还高表达IFN-γ(图5A、B),差异具有统计学意义(P<0.05)。
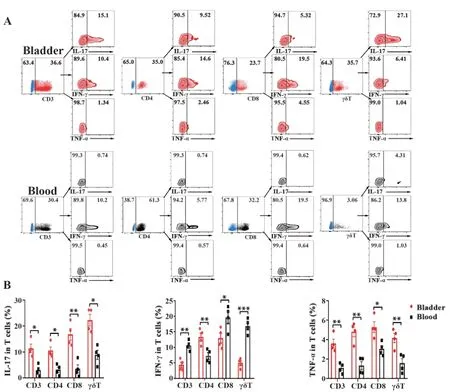
图5 小鼠血液和膀胱组织中T细胞表达细胞因子IL-17、IFN-γ和TNF-α的差异Fig.5 Differencesin expressionsof cytokines IL-17,IFN-γ and TNF-αin T cell subsets from bladder tissues and blood
2.6 MB49原位膀胱癌小鼠和对照小鼠膀胱体积、形态和小鼠体重的比较 正常对照小鼠膀胱与MB49小鼠原位膀胱癌小鼠膀胱平均体积分别为(12.30±2.45)mm3和(138.80±25.08)mm3,差异具有统计学意义(P<0.05,图6A)。正常小鼠体重逐渐上升,MB49原位膀胱癌小鼠的体重第6天开始逐渐下降(图6B)。两组膀胱组织分别石蜡包埋,切片,HE染色观察,结果显示,MB49原位膀胱癌小鼠膀胱结构破坏,膀胱腔隙血供丰富,肿瘤占位,有核细胞明显增多(图6C)。
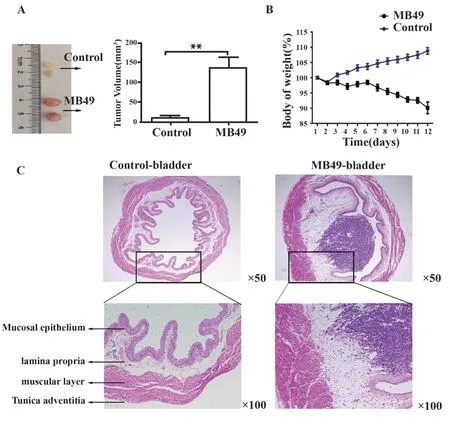
图6 MB49原位膀胱癌小鼠和正常小鼠的体重和膀胱体积、形态的比较Fig.6 Comparison of bladder volume,morphology,and body weight between MB49 bladder carcinoma in situ mice and control mice
2.7 正常小鼠和MB49原位膀胱癌小鼠膀胱组织中CD3+T和γδT细胞的组织学分布 免疫组化提示,正常小鼠膀胱组织CD3+T主要分布在膀胱肌层和膀胱黏膜上皮层。MB49原位膀胱癌小鼠的膀胱肿瘤区域CD3+T表达比较集中,免疫荧光染色观察到MB49原位膀胱癌小鼠的膀胱肿瘤区域CD3+T和γδT细胞的表达(图7)。
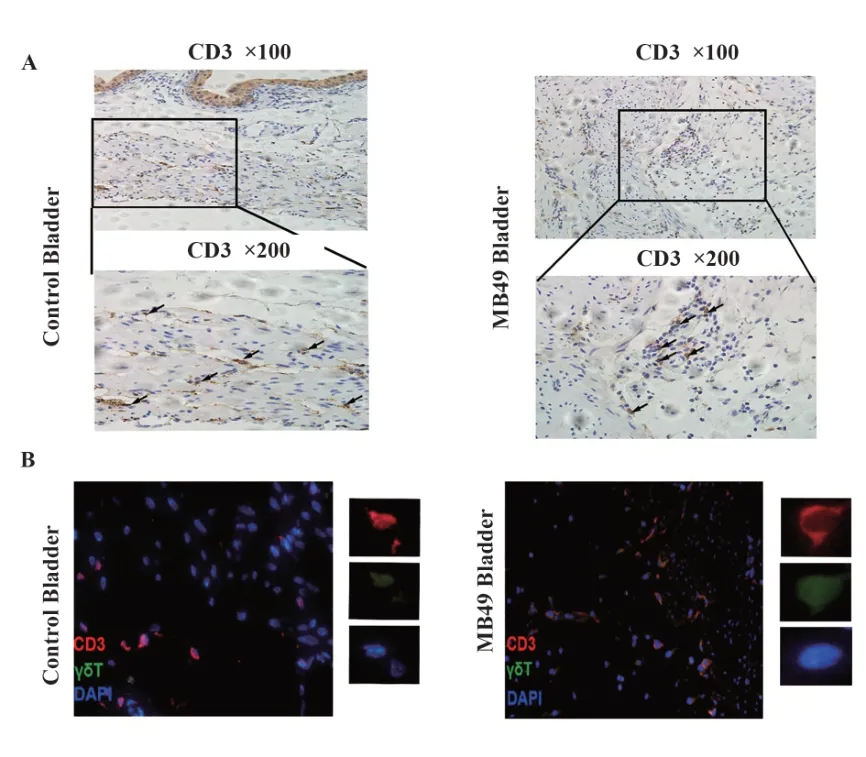
图7 正常小鼠膀胱和MB49原位膀胱癌小鼠膀胱组织中CD3+T和γδT细胞的组织学分布Fig.7 Histological distribution of CD3+T andγδT cells in MB49 bladder and control bladder tissues
2.8 MB49原位膀胱癌和正常小鼠膀胱T细胞表型和细胞因子比较 如图8所示,MB49原位膀胱癌小鼠膀胱组织中CD8+T和γδT比例升高,CD4+T比例显著下降,MB49原位膀胱癌小鼠膀胱组织中CD3+T、CD4+T、CD8+T和γδT细胞均显著高表达IFN-γ,其中γδT细胞还显著高表达IL-17和TNFα、CD3+T、CD4+T则显著高表达TNF-α,差异具有统计学意义(P<0.05)。
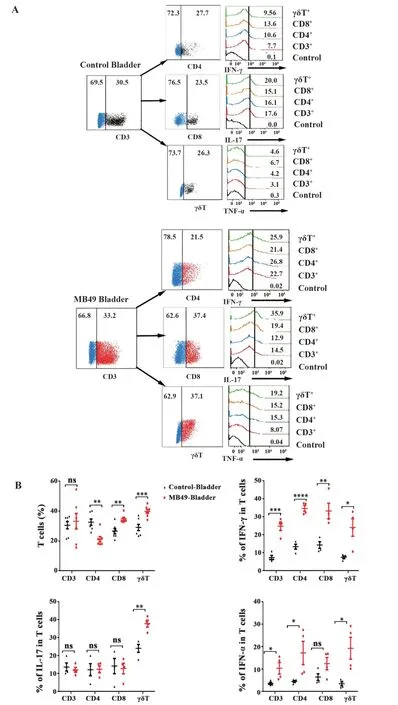
图8 MB49小鼠膀胱和正常小鼠膀胱T细胞亚群和细胞因子IFN-γ、TNF-α和IL-17的比较Fig.8 Comparison of T cell subsets and expression of IFN-γ,TNF-αand IL-17 on T cells in MB49 bladders and control bladders
3 讨论
T细胞在抗感染和癌症方面有着十分重要的作用,通过联体共生实验发现一群驻留在组织不参与血液循环的细胞其表达:CD44、CD69和CD103,命名为TRM。随后相继在皮肤,肠道,肝,肾等组织中研究功能及作用,并发现在肿瘤微环境中TRM细胞与临床预后相关,预测TRM细胞在癌症疫苗和肿瘤免疫治疗中发挥的重要作用,可能是未来免疫治疗成功的关键[10-14]。有研究指出膀胱内注射γδT细胞可以抑制小鼠膀胱癌的生长[15]。本课题组研究证明小鼠膀胱组织中含有αβT细胞和γδT细胞,表达记忆分子CD44,组织驻留标志分子CD69和CD103,高表达趋化因子受体CXCR3和CXCR5。此外发现正常小鼠膀胱中的γδT细胞显著高于外周血,并高表达细胞因子IL-17和TNF-α,猜测膀胱组织中的TRM细胞在抗膀胱癌免疫应答中发挥着重要作用。
众所周知膀胱癌是一种异质性疾病,根据是否侵犯逼尿肌将其分为肌层浸润性膀胱癌(muscleinvasive bladder cancer,MIBC)和非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer,NMIBC)。NMIBC约占新诊断膀胱癌的70%,并且考虑到需要反复内镜评估和切除,其是治疗护理花费最昂贵的恶性肿瘤之一[16]。NIMBC的标准治疗方式是经尿道膀胱肿瘤切除术,术后进行膀胱灌注治疗可以显著降低复发率。而MIBC最有效的治疗是根治性膀胱癌切除术,同时需要对盆腔淋巴结清扫,尿道改道,是较为复杂的手术,尽管如此,仍然有约50%的患者最终会因为播散性微转移而在远处发生肿瘤[17-18]。
进一步小鼠MB49原位膀胱癌模型研究发现,与正常小鼠相比肿瘤模型小鼠CD4+T细胞降低,CD8+T和γδT细胞明显升高,CD8+T分泌高水平细胞因子IFN-γ,γδT细胞高分泌IFN-γ、TNF-α和IL-17,免疫荧光提示肿瘤区域集中表达γδT细胞。本研究发现在小鼠膀胱癌发生过程中,可趋化CD8+T和γδT细胞,且其在膀胱癌内分泌高水平细胞因子IFN-γ、TNF-α和IL-17。
综上所述,膀胱组织中的TRM可能与膀胱癌的发生发展密切相关,在膀胱癌进展中趋化因子受体和细胞因子发挥着非常重要的作用。本实验探究膀胱驻留T细胞的表型和细胞因子对进一步研究膀胱癌有着十分重要的意义,也为组织驻留γδT细胞在膀胱癌免疫治疗中的作用提供理论基础。