层状双金属氢氧化物的研究进展
吴佳朋,景航昆,蒋榕培
(北京航天试验技术研究所,北京 100074)
1 概述
层状双金属氢氧化物(LDH)是一种层状结构化合物,通常包含两种金属阳离子和氢氧根离子。LDH的化学组成式 为[M2+(1-X)M3+(X)(OH)2]X+(An-)X/n.mH2O,其 中M2+和M3+分别为二价和三价金属阳离子,M2+可能为Mg2+,Ni2+,Co2+,M3+可能为Al3+,Mn3+,Fe3+等;An-为阴离子,可能为CO32-,NO3-和Cl-等,通常与结晶水一起存在于层与层之间 (图1)[1]。
层状双金属氢氧化物(LDH)是一种具有“记忆效应”的材料。通过在高温下焙烧,LDH失去碳酸根离子、层间结晶水,并发生层状结构的坍塌,转变为方镁石结构。重新将方镁石结构放入含有特定阴离子的水中,焙烧过的LDH会吸入特定阴离子与结晶水,重新变回层状结构。由于LDH具有层间距可控,比表面积大和离子交换等特性,因此LDH在污水处理、光催化、电催化、金属腐蚀和磁性材料等方向均有较为广泛的应用[2]。见图2。
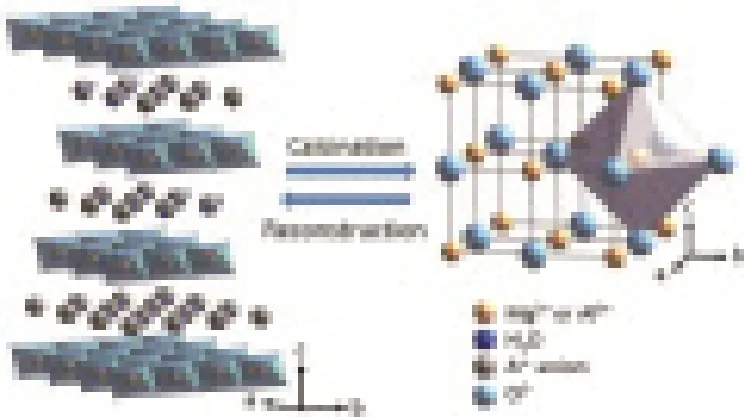
图2 层状双金属氢氧化物焙烧和重组后层状结构和方镁石结构示意图
2 层状双金属氢氧化物(LDH)的制备
2.1 层状双金属氢氧化物的制备方法
LDH的制备方法有很多,如共沉淀法、水热法、水解法、溶胶凝胶法和离子交换法等等。其中,共沉淀法是比较常用的一种合成方法。2009年,Garcia使用共沉淀法合成了Zn-Cr LDH[3]。主要使用NaOH用作碱溶液,以及使用一定配比的Zn,Cr混合溶液,缓慢滴入含有尿素缓冲液的反应器中。在缓冲液的作用下,溶液pH在共沉淀反应过程中保持不变。加入的Zn,Cr混合溶液和NaOH碱溶液发生反应后生成Zn-Cr LDH。在反应过程中,尿素的水解过程非常缓慢,使生成的Zn-Cr LDH具有较好的晶形,并能够很好地控制所生成LDH的颗粒尺寸。
溶液混合法可用来制备一些半导体材料和LDH的复合物。Carja等[4]使用TiOSO4溶液为TiO2的前驱体,使用溶液混合法制备了TiO2/Zn LDH复合材料。随后,Carja等[5]使用醋酸铜为CuO的前驱体,使用溶液混合法制备了CuO/LDH复合材料。
离子交换法是另一种常用的制备方法。LDH的层间离子交换主要依靠LDH片层与层间离子的静电作用。LDH的层间离子交换主要遵循以下原则:
(1)溶液的pH应该在4以上,当溶液的pH过低时,LDH的层状结构会被破坏。
(2)离子交换过程与LDH的化学组成有关。
(3)较高的温度更容易促进离子交换过程。
(4)离子交换过程应该选择合适的溶液。Fan等[6]利用局部化学的合成方法先合成了Co-Ni-Br LDH,随后向Co-Ni-Br LDH的悬浮液中加入了AgNO3溶液,Ag+与LDH片层间的Br-发生反应,从而在LDH表面生成AgBr颗粒。NO3-随后进入Co-Ni-Br LDH的插层,最终合成了Ag/AgBr/Co–Ni–NO3LDH 复合材料。
2.2 层状双金属氢氧化物(LDH)的制备影响因素
层状双金属氢氧化物的制备受到很多因素的影响,如pH、碱溶液浓度、碱溶液性质、溶液中离子浓度等。
2.2.1 溶液pH对LDH形成的影响
pH对于LDH的形成有比较大的影响。以ZnAl-LDH为例,A.A.Sertsova等[7]使用Zn(SO4)2和Al(SO4)3为阳离子前驱体溶液,使用Na2CO3与NaOH为碱液,采用共沉淀的方法制备了ZnAl-LDH,Zn和Al的摩尔比为3∶1。沉淀反应的条件为80℃下反应24h,反应的pH为7到13。从生成的LDH的XRD图像看出,当溶液的pH为8时,hydrotalcite phase的LDH开始形成。当溶液的pH为10~11时,纯相的hydrotalcite phase型的LDH开始生成。继续增加pH时会形成混合相的氢氧化物。总结来说,当溶液的pH在8~11时,金属硫化物的沉淀过程中会有hydrotalcite phase的形成。金属盐类的性质很大程度影响了hydrotalcite phase的形成。A.Seron和F.Delorme尝试了不同pH条件下MgAl-LDH的合成。当溶液的pH为10时,观察到Mg2+和Al3+的消失。Al3+的消失意味着 Al(OH)3的形成,Al3+全部消失后,Mg2+的浓度开始下降[8]。通过控制金属盐类物质的添加速度和沉淀物的形成可控制溶液的pH,碱溶液的浓度也可用于调节溶液的pH。
2.2.2 碱溶液(NaOH和Na2CO3)浓度对LDH形成的影响
在制备LDH的过程中需要用到强碱性溶液,通常会用到NaOH和Na2CO3的混合溶液来制备阴离子为CO32-的LDH。以MgAl-LDH为 例,W.T.Reichle等[9]觉得,对 于MgAl-LDH而言,碱溶液的浓度应该是Mg2+的两倍和Al3+的三倍。S.Miyata[10]提出制备MgAl-LDH时,当金属盐Mg2+和Al3+的总摩尔数为1M时,使用2M的NaOH和0.2M的Na2CO3,即碱类物质的溶液浓度是金属盐的浓度的2倍,CO32-/Al3+的浓度比为0.7。
2.2.3 碱溶液的特性对LDH形成的影响
NaOH与Na2CO3的组合是比较常用的制备LDH的碱溶液。CO32-的存在可以防止其他类型的阴离子进入LDH的层状插层中,如金属盐的常用负离子Cl-,NO3-等。另外胺类和尿素也是较为常用的碱溶液,由于不含Na+,使用这两种物质可以减少LDH沉淀的洗涤次数。
K.Abderrazek等[11]研究了使用氨水为碱溶液制备ZnAl-LDH,以及氨水对于形成LDH的晶相的影响。通过向反应容器中同时加入金属的硝酸盐(Zn∶Al摩尔比为3)混合物和氨水,同时保证pH为10的条件下,制备ZnAl-LDH。由于氨分子的存在,与CO32-发生了络合,使得LDH层间的碳酸根离子的含量减少,因此溶液中LDH的量增加。从化学分析的结果可看出,LDH中阳离子的含量也比预期更少。这是由于Zn2+并未完全进入到LDH的片层结构中。造成这种情况的原因可能是Zn2+与氨分子发生了络合反应。因此,当选择氨溶液作为碱溶液时,一定要考虑反应物的阳离子是否能够与氨分子发生络合反应,从而避免由于络合反应的发生导致LDH无法形成层状水滑石结构。可以通过溶液的颜色来判断是否形成了络合物。如Cr3+与氨分子的络合物是紫色,Cu2+与氨分子的络合物是深蓝色。
2.2.4 阳离子摩尔比对LDH形成的影响
LDH中含有二价金属阳离子M2+和三价金属阳离子M3+,目前已知M2+与M3+的溶液摩尔比会对LDH的形成有影响。F.Cavani等[12]指出,当M2+:M3+的摩尔比在2~4时,可以生成纯相的LDH,当摩尔比过高时会有杂相生成。M.Haraketi和Lwin分别使用Cu2+和Al3+的硝酸盐溶液,使用共沉淀的方法将溶液滴加到Na2CO3溶液中。M.Haraketi等[13]指出,当Cu∶Al的摩尔比为1时,合成的LDH的XRD晶相最明显。当摩尔比增加时,XRD的特征峰减弱。同时,Y.Lwin等[14]指出,减弱Cu∶Al的摩尔比有助于减少孔雀石相的生成,当Cu∶Al的摩尔比达到0.5时,孔雀石相完全消失。Behrens等指出NaOH是制备纯相水滑石相CuAl-LDH的必要条件。
3 层状双金属氢氧化物(LDH)对水溶液中重金属离子的吸附
由于LDH特殊的层状结构,以及层间阴离子较强的离子交换特性,因此LDH材料通常用于污水中重金属离子的吸附,如Se(VI),As(III),As(V)等。对于LDH及LDH的衍生物来说,比较常见的吸附机理为物理吸附、氢氧根沉淀反应、静电作用和化学键吸附。吸附性能与溶液界面反应种类(固-固反应,固-气反应)以及反应过程中的变量,如溶液pH,初始溶液浓度和剩余时间有关[1]。以As(III)的吸附为例,You等[15]首次使用LDH进行水溶液中As(III)的吸附。并且尝试并对比了分别使用焙烧和未焙烧的LDH对As(III)的吸附效果。结果发现,MgAl-Cl LDH和焙烧后的LDH都可以吸附As(III),其中焙烧后的LDH对As(III)的吸附作用更强,甚至对于低浓度的As(III)也有很强的吸附效果。分析原因可能是焙烧后的LDH变成了非稳定状态的金属氧化物,并且层间不存在CO32-等竞争离子,同时焙烧后的LDH比表面积更大,吸附能力更强。由于焙烧后LDH在水中的不稳定状态和记忆效应,因此当放入含有As(III)的水溶液中时,LDH可以吸附As(III)离子从而恢复层状水滑石结构。Yang等[16]探究了pH对焙烧和未焙烧LDH对As的吸附影响。当溶液的起始pH大于4时,As(V)的吸附不太受到影响,然而当使用未焙烧的LDH吸附As(V)时,溶液的pH有较大的影响。这是由于未焙烧LDH的PZC为6.8~6.9,当溶液的pH大于pHpzc时,LDH的表面带负电荷,水溶液吸附As(V),当溶液的pH小于pHpzc时,LDH对As(V)的吸附更强。然而溶液的pH不能过低,过低的pH下LDH不能稳定存在,结构容易被破坏。
4 结束语
主要针对层状双金属氢氧化物(LDH)进行介绍,主要介绍了LDH的基本结构、制备方法,制备LDH时的主要影响因素,以及LDH通过自身吸附作用去除水中重金属离子的应用。pH、碱溶液浓度和金属阳离子的摩尔比均可以较大程度影响LDH的制备,且对于不同种类的LDH有着不同的最佳实验参数。当使用未焙烧的LDH进行水中重金属离子As(V)的吸附时,水溶液的pH对As(V)的吸附效果影响较大,当溶液的pH小于LDH的pHpzc时,吸附效果较好。文中内容的介绍对LDH材料的制备和LDH的将来应用具有重要的参考意义。

