肝移植术后新发红皮病1例并文献复习
党智萍,饶伟,于婷,翟慧敏,臧运金,孔心涓(.青岛大学附属医院消化内科,山东 青岛 66000;.青岛大学附属医院器官移植中心,青岛大学附属医院肝脏病中心,青岛大学移植医学研究所,山东 青岛 66000)
红皮病(Erythroderma)是一种病因复杂、病死率高的全身性皮肤病,表现为全身皮肤广泛的红斑和脱屑,体表受累面积可超过90%[1]。红皮病的年发病率约为0.000 1%~0.000 2%[2]。肝移植术后红皮病的临床报道并不多见,且该症的临床诊疗具有其特殊性及一定难度,本文回顾了1例少见的肝移植后新发重度红皮病的临床诊疗经验,报道如下。
1 临床资料
患者男性,79岁,因“乙肝后肝硬化、原发性肝细胞肝癌”于2016年7月13日在青岛大学附属医院行同种异体原位肝移植术。术后给予“甲泼尼龙+他克莫司+麦考酚钠”三联免疫抑制方案预防移植物排斥反应,以及抗感染、保肝、利尿、抑酸、肠内营养等对症支持治疗。患者术后恢复可,情况稳定后出院。本研究通过青岛大学附属医院医学伦理委员会批准(QYFYWZLL26393)。
2019年3月(术后2年8个月)患者复查肝脏MR增强提示肝内肿瘤复发,并于2019年4月行全麻下超声引导肝肿瘤射频消融术,过程顺利,2周后,患者无明显诱因出现发热,体温最高37.5℃,伴躯干皮肤出现红斑、皮疹,伴脱屑,1个月后红斑、皮疹从躯干逐渐向头面部、四肢蔓延,最终累积全身皮肤,伴瘙痒,持续低热,体温最高37.8℃,并出现四肢水肿,腰背部酸痛,尿量减少,后患者于2019年5月28日再次入院,实验室化验结果显示(表1):白细胞为5.68×109/L,血红蛋白为88 g/L,血小板为250×109/L;C反应蛋白为24.6 mg/L;降钙素原为0.082 ng/ml;血沉为13 mm/h;免疫球蛋白E为676.6 U/ml;抗链O为300 U/ml;血清白蛋白为32.2 g/L;乳酸脱氢酶为289 U/L;CD4绝对计数为1 880 cells/μl,血钾为2.8 mmol/L,他克莫司浓度为2 ng/ml,西罗莫司浓度为3.98 ng/ml;嵌合体检测,即人类白细胞抗原(human leukocyte antigen,HLA)检测阴性,HLADR抗体、HLA-DP抗体为弱阳性,其余群体反应抗体确定试验未见异常。肝脏穿刺活检结果显示:镜下可见3个较完整的汇管区和2个中央静脉结构,部分汇管区见少量以淋巴细胞为主的炎细胞浸润,局灶小胆管增生,管周轻度纤维化,部分肝窦扩张,肝细胞中度水肿(图1、图2)。左胸壁皮疹处皮肤组织活检结果显示:少许皮肤组织真皮浅层见少量淋巴细胞浸润,并围绕小血管周围,局灶见一血疱形成(图3、图4)。免疫组化:CD3示T淋巴(+),CD20示B细胞(+),CD34示小血管(+),Ki-67散在阳性约5%。

表1 患者实验室检查结果
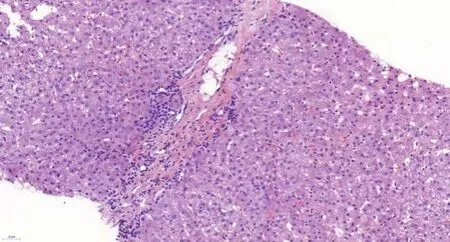
图1 肝组织汇管区结构
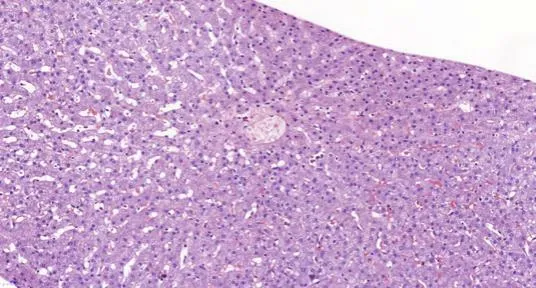
图2 肝组织中央静脉结构:部分肝窦扩张,肝细胞中度水肿
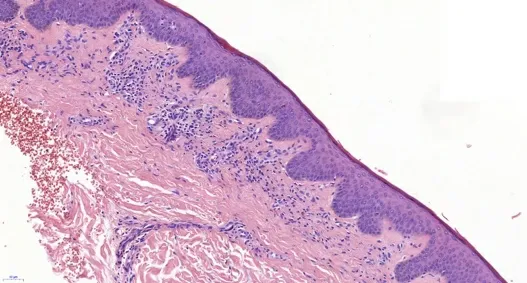
图3 皮肤组织真皮浅层见少量淋巴细胞浸润
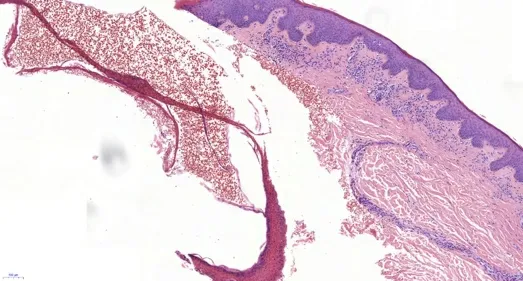
图4 局灶见一血疱形成
诊断方面,入院后,考虑该诊断为肝移植术后皮疹原因待查,需鉴别:① 肝移植术后新发红皮病表现为全身皮肤弥漫性潮红、肿胀、浸润以及脱屑,皮肤外表现有中低程度的发热、脱水、低血压、低蛋白血症,血管通透性改变导致的皮肤及下肢水肿、电解质紊乱,还可继发感染、心血管病变等。可引起白细胞增高、贫血、血沉加快、白蛋白降低、球蛋白增多和高尿酸血症等。患者肝移植后出现持续低热,全身皮肤红斑、皮疹及脱屑,伴四肢水肿,尿量减少,白细胞为5.68×109/L,血红蛋白为88 g/L,C反应蛋白为24.5 mg/L;白蛋白为32.2 g/L;血钾为2.8 mmol/L。结合患者临床表现及辅助检查,考虑肝移植后新发红皮病可能性大;② 移植物抗宿主病(graft versus host disease,GVHD)多发生于肝移植术后早期,是一种危及生命的移植术后并发症,常见的受累器官包括皮肤、消化道以及骨髓,临床表现为发热、皮疹、腹泻以及全血细胞水平下降等。该患者肝移植术后34个月出现发热、皮疹症状,病理组织学未见特异性表现,嵌合体HLA检测均为阴性,无骨髓抑制及腹泻等临床表现,故暂不考虑GVHD;③ 湿疹是由多种内外因素引起的瘙痒剧烈的一种皮肤炎症反应,皮损具有多形性、对称性、瘙痒和易反复发作等特点,该患者除皮疹及瘙痒外,还有发热、脱屑等症状,这在湿疹中并不常见,故暂不考虑该诊断;④ 药疹多在药物治疗开始7~10 d经过致敏而出现,可表现为发疹性药疹、荨麻疹样药疹、剥脱性皮炎等。该患者近期无特殊药物应用史,考虑药疹可能性不大。
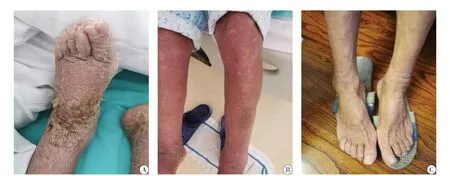
图5 患者治疗前后对比图
治疗方面:患者HLA相关嵌合体检测为阴性,暂排除GVHD,考虑肝移植后新发红皮病可能性大,治疗上暂停用免疫抑制治疗,给予甲强龙80 mg/d联合人免疫球蛋白10 g静脉滴注,头孢哌酮舒巴坦钠、大扶康、更昔洛韦预防性抗感染,利尿、补钙、维生素C抗过敏、抑酸预防激素不良反应以及丁酸氢化可的松乳膏、丹皮酚软膏、硼酸氧化锌糊、青鹏软膏外用等对症支持治疗。经过上述积极治疗后,患者症状较前明显减轻,皮疹消退,水肿减轻,未再发热,移植物肝功能维持稳定,并予以糖皮质激素序贯减量至4 mg/d并长期维持,后于2019年6月7日好转出院。
预后:患者出院后小剂量激素维持治疗1年,他克莫司免疫抑制治疗,药物浓度2 ng/ml,患者无新发皮疹,移植肝功能稳定,肝癌未再复发。
2 讨 论
红皮病的病因复杂,病死率高[3],可继发于原有皮肤病、药物过敏、恶性肿瘤,无法明确原因的称为特发性红皮病。还有少见红皮病继发于感染、免疫缺陷[4]、扁平苔藓等,肝炎、放疗后、外科手术伴输血后、移植物抗宿主病以及艾滋病等也能引起此病。皮肤弥漫性潮红、肿胀、浸润以及脱屑为其主要临床表现,起初为散在红斑伴有瘙痒,后融合成片,最终广泛分布于部分甚至全身皮肤,表面有鳞屑。皮肤外表现有中低程度的发热、脱水、低血压、低蛋白血症,血管通透性改变导致的皮肤及四肢水肿、电解质紊乱,还可继发感染、心血管病变等,严重时危及生命,临床病死率较高。红皮病的组织病理表现常为非特异性,主要有表皮角化不全或角化过度、棘层肥厚和血管周围慢性炎症细胞浸润。不同病因如银屑病、毛发红糠疹、鱼鳞病样红皮病或落叶型天疱疮等,有不同的特征性组织病理改变,药源性红皮病的病理表现与苔藓样皮病相似,在由淋巴瘤引起的红皮病中,炎症细胞浸润逐渐变成多形性。但特征性的病理改变往往被红皮病非特异性的组织学特点所掩盖,多次皮肤活检可提高病理诊断的准确性[5]。
本例患者在肝移植后出现全身皮疹伴持续低热,结合其皮疹特征及肝移植病史,需积极与移植物抗宿主病进行鉴别诊断。移植物抗宿主病是指供体来源的免疫活性细胞对受体组织产生的免疫反应,对受体器官造成损害而引发的一系列临床症状。肝移植术后GVHD的发生率较低,仅为0.1%~2.0%[6-7],但病死率极高,可达75%~85%[8-9]。其主要临床表现包括[10]:发热(66%)、皮疹(92%)、腹泻(65%)、以白细胞和血小板减少为主的骨髓抑制(78%)以及肝功能正常,患者最终多因重症感染、败血症及多器官功能衰竭死亡。Darrell等[11]将其诊断标准归纳为以下3项:① 靶器官受累引起的特征性临床症状和体征,如皮肤、消化道、骨髓等;② 受累靶器官的组织学检查结果;③ 受累靶器官或外周血中供体T淋巴细胞存在HLA或DNA方面的证据。嵌合体是指供者的细胞在受者的组织或器官内形成稳定的嵌合状态,包括微嵌合体和系统嵌合体。研究结果显示,嵌合体在肝移植术后早期出现,1周内达高峰,术后3~4周开始逐渐减少[12];肝移植术后GVHD的诊断,多以受者器官(脾组织、淋巴结、骨髓、肝组织及皮肤黏膜等)或外周血中检测到供体的淋巴细胞、HLA或DNA作为依据。本例患者有皮疹、发热症状,但缺少GVHD常见的腹泻及骨髓抑制表现,皮肤及肝脏活检未见特异性病理改变,嵌合体HLA检测均为阴性。因此,该患者诊断上可暂排除GVHD,考虑红皮病可能性大。
红皮病的治疗应根据不同的病因采取对应的治疗方案,但大部分患者对激素治疗有效。本例患者为肝移植术后新发红皮病,病因尚不明确,既往因“肝癌复发”行射频消融治疗。对于该患者,治疗上暂停用他克莫司,给予甲强龙联合人免疫球蛋白治疗原发病,辅以抗感染,补充白蛋白,利尿、补钙、抑酸及其他对症支持治疗,后患者症状明显好转。患者出院后小剂量激素维持治疗1年,至今未再复发,移植肝功能稳定。
3 总 结
肝移植术后新发红皮病在移植患者中并不常见,且该症的临床诊疗具有其特殊性及一定难度,因此需要临床医务工作者有充足的知识储备,了解红皮病的临床表现及诊断标准,明确诊断后给予积极的治疗,以免延误病情。

