基于网络药理学探讨4-乙酰氧基苯并噁唑-2-酮对急性肝损伤的作用机制*
张 华,周焕芳,梁英琴,徐万鹏,孙雪梅,陆俊霏,覃 思,林 军△
(1.广西医科大学药学院,南宁 530021;2.广西医科大学第十附属医院,钦州 535000 ;3广西医科大学附属肿瘤医院药学部,南宁 530021)
肝脏是人类最重要的器官之一,各种肝损害引起的肝炎是一个世界性的健康问题。急性肝损伤(ALI)是指突然出现大量肝细胞坏死或肝功能显著异常的综合征,以凝血机制障碍、黄疸及肝性脑病等症状为主要表现,可累及机体多个系统[1]。该病起病急,病情危重,肝细胞广泛坏死,且目前缺乏有效治疗手段,治疗药物的干预效果较差,病死率较高[2]。
中国传统药物在治疗肝损伤中发挥着重要作用。老鼠簕(Acanthus ilicifolius L.)属爵床科(Acanthaceae)老鼠簕属(Acanthus),是一种重要的药用红树林植物,民间主要用于治疗淋巴结肿大、急慢性肝炎、肝脾肿大、胃痛、咳嗽、哮喘,外敷用来治疗瘰疬。本课题组前期研究发现,老鼠簕提取物中的单体活性成分为老鼠簕生物碱A,其化学名为4-苯并噁唑-2-酮(HBOA),具有良好的抗炎、抗氧化活性[3],但由于老鼠簕植物生长缓慢,限制了从中大量的提取,经广西医科大学药学院药物化学教研室的探索,现已能够实现全人工合成,并且进一步合成了一系列低毒的HBOA 衍生物[4],4-乙酰氧基苯并噁唑-2-酮(AcO-BOA)为衍生物之一,根据前期研究结果,AcO-BOA 具有良好的抗炎和保肝作用[5],但其具体作用机制尚不明确。
网络药理学作为药理学新兴分支学科,给中医药的发展带来了新的思路和方法[6]。本研究旨在运用网络药理学方法预测并筛选AcO-BOA 和ALI 的交集靶点,进行富集并分析其所参与的生物过程及信号通路,从而探讨AcO-BOA 防治ALI 的潜在作用机制。
1 材料与方法
1.1 数据库 所用数据库包括Swiss Target Prediction(http://www.swisstargetprediction.ch/)、Phammapper(http://www.lilab-ecust.cn/pharmmapper/)、Gene-Cards 5.0(https://www.genecards.org/)、OMIM(https://omim.org/)、Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)、String 11.0(https://stringdb.org/)、David 6.8(https://david.ncifcrf.gov/)、Omicshare 5.0.1(https://www.omicshare.com/tools/)、Uniprot(https://www.uniprot.org/)、RCSB PDB(https://www.rcsb.org/)。
1.2 主要材料与试剂 SPF 级健康C57 小鼠,体重(18±22)g,购于广西医科大学实验动物中心,动物使用许可证号:SCXK(桂)2020-0003。AcOBOA,广西医科大学药学院药物化学教研室合成,纯度>90%。脂多糖(LPS,北京索莱宝科技有限公司,批号:426Y034);D-氨基半乳糖(D-GalN,合肥博美生物科技有限责任公司,批号:RT052019)。一抗AKT、β-actin(中国Proteintech 公司);p-AKT(美国Affinity公司)。
1.3 药物靶点、疾病靶点、药物与疾病交集靶点的筛选 采用ChemDraw 软件绘制AcO-BOA 的结构式,分别导入Swiss Target Prediction 及Phammapper数据库,获取药物相关靶点。登陆GeneCards 5.0和OMIM数据库,分别以“Acute Liver Injury”,“Hepatic Injury”作为关键词进行检索,从而获取ALI 相关靶点。登陆Venny 2.1.0网站,分别输入药物和疾病的靶点,即可获得AcO-BOA和ALI的交集靶点。
1.4 蛋白质相互作用(PPI)网络的构建及核心靶点的筛选 登陆String11.0 在线网站,输入AcO-BOA和ALI的交集靶点,物种选择为“Homo sapiens”,设置隐藏游离靶点,得到PPI 网络。将PPI 网络图.tsv格式文件导入Cytoscape 3.7.1 软件进行拓扑分析并获得各节点的中心度值(Degree),根据Degree 值大小将PPI 网络图可视化。利用Cytohubba 插件计算并筛选出网络中Top 10的核心靶点。
1.5 基因功能和通路富集分析及“成分-靶点-通路”网络图的构建 将所获得的Top 10核心靶点输入David 6.8数据库,物种选择为“Homo sapiens”,选择“office gene”,以P<0.05 为阈值,筛选出Top 20的生物过程和信号通路。再运用Omicshare5.0.1在线工具绘制动态富集气泡图。最后运用Cytoscape 3.7.1 软件,构建AcO-BOA 与Top 10 核心靶点及Top 20信号通路的“成分-靶点-通路”网络图。
1.6 分子对接验证 配体分子的准备:将配体分子(即AcO-BOA)结构式,保存为mol2 格式。受体分子的准备:登陆Uniprot 数据库获取受体分子的ID号,在PDB 数据库下载各受体的3D 结构,采用Pymol 软件处理后另存为.pdb 格式。运用AutoDock-Tools-1.5.6 软件对其进行加氢,计算电荷,设置原子类型处理后,另存为.pdbpt格式。对接:根据受体分子的活性位点,设置对接范围和计算方法,运用软件开始对接,运用Pymol软件对结果进行分析。
1.7 实验动物分组及给药 AcO-BOA 用CMC-Na作为溶剂,D-GalN 和LPS 均用生理盐水作为溶剂。将C57 小鼠随机分为5 组:正常组、模型组及AcOBOA低剂量(50 mg/kg)、中剂量(100 mg/kg)和高剂量(200 mg/kg)组,每组8只。给药组按20 mL/kg灌胃相应剂量的AcO-BOA,正常组和模型组灌胃等量CMC-Na,连续10 d。末次给药后禁食不禁水12 h,除正常组(注射等量生理盐水)外,其它各组均腹腔注射D-GalN(800 mg/kg)/LPS(40 µL/kg)复制ALI小鼠模型。
1.8 血清碱性磷酸酶(ALP)含量检测 造模4 h后,将小鼠麻醉后眼球取血,血液静置1 h 后离心,取上层血清,用全自动生化仪检测各组小鼠血清中ALP的含量。
1.9 Western blotting法检测肝组织AKT、p-AKT蛋白表达 取肝组织,称重后在预冷的研钵中用液氮研磨,加入裂解液,冰上裂解20 min,离心,取上清,加入蛋白上样缓冲液,混匀,煮沸使蛋白变性,使用SDS-PAGE分离蛋白,转移至PVDF膜,封闭1 h后;将膜转移至一抗β-actin(1∶1 000)、AKT(1∶1 000)、p-AKT(1∶1 000),4 ℃冰箱孵育过夜,洗膜3次;荧光二抗室温下避光孵育1 h,洗膜;用双色红外激光成像系统(美国Odyssey LI-COR 公司)扫膜,Image J软件分析蛋白条带灰度值。
1.10 统计学方法 采用SPSS 17.0 软件进行数据分析,计量资料以均数±标准差()表示,各组间均数的比较采用单因素方差分析,方差齐时,两两比较采用LSD-t检验;方差不齐时,采用Tamhane’sT2检验;以P<0.05为差异具有统计学意义。
2 结果
2.1 药物靶点的筛选 根据Swiss Target Prediction及Phammapper 数据库的筛选并处理后,共获得药物靶点268 个。AcO-BOA 结构式见图1,其分子量<200,药代动力学性质(Pharmacokinetics)中胃肠道吸收系数为高,表明AcO-BOA在胃肠道易吸收;类药性(Druglikeness)中前5个性质中有4个满足条件,符合类药五原则,表明AcO-BOA 在生物体内代谢过程中有较高的生物利用度,更有潜力成为口服药物。

图1 AcO-BOA结构式
2.2 疾病靶点筛选结果 分别从GeneCards、OMIM 数据库筛选出ALI 相关靶点1 906 个和291个,对靶点进行合并,删除78 个重复值后,共获得ALI相关靶点2 119个。
2.3 药物与疾病交集靶点的筛选 分别将268 个药物靶点和2 119 个疾病靶点导入Venny 2.1.0 网站绘制韦恩图(图2),即获得AcO-BOA防治ALI的潜在靶点,共52个,见表1。
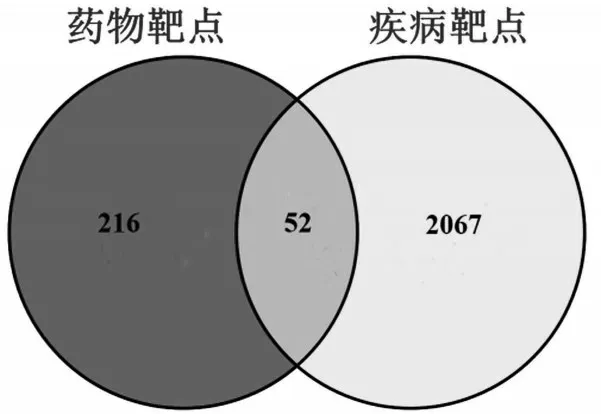
图2 靶点韦恩图
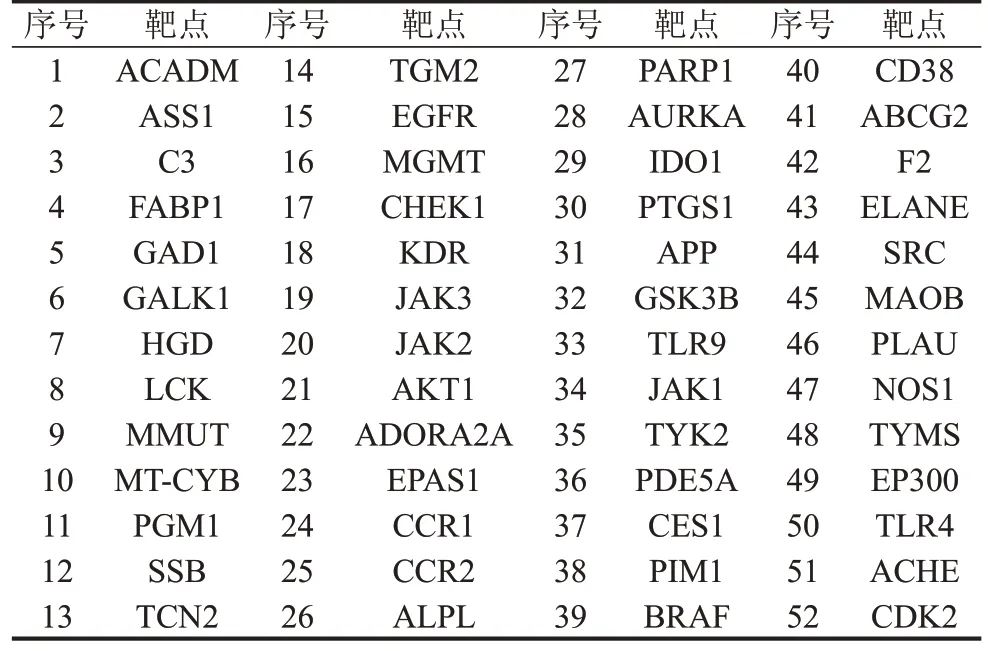
表1 AcO-BOA对ALI的保护作用的潜在靶点
2.4 PPI 网络的构建及核心靶点的筛选 Cytoscape 3.7.1 软件所绘制的PPI网络图如图3A所示。图中各节点(Node)表示蛋白,连线(Edge)表示蛋白之间的关联。各节点大小和颜色与其Degree 值呈正相关,Degree 值越大,节点面积越大,颜色越深。Cytohubba 插件筛选出的Top 10 核心靶点,如图3B所示。颜色越深,说明该节点越重要。Top 10 核心靶点为丝氨酸/苏氨酸激酶(AKT1)、表皮生长因子受 体(EGFR)、Toll 样 受 体4(TLR4)、酪 氨 酸 激 酶(SRC)、Toll 样受体9(TLR9)、酪氨酸激酶(JAK1)、淋巴细胞特异性酪氨酸激酶(LCK)、β 淀粉样前体蛋白(APP)、细胞周期检测点激酶1(CHEK1)和E1A结合蛋白EP300(EP300),见表2。以上结果提示AKT1在该网络中的作用更为重要。
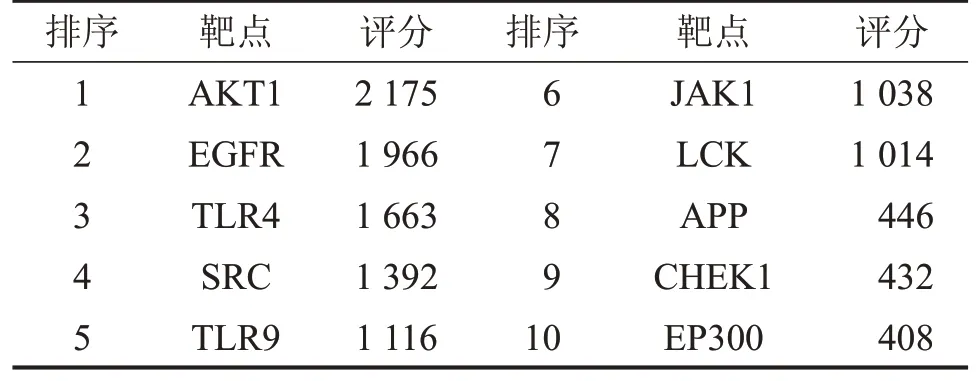
表2 前10核心靶点信息
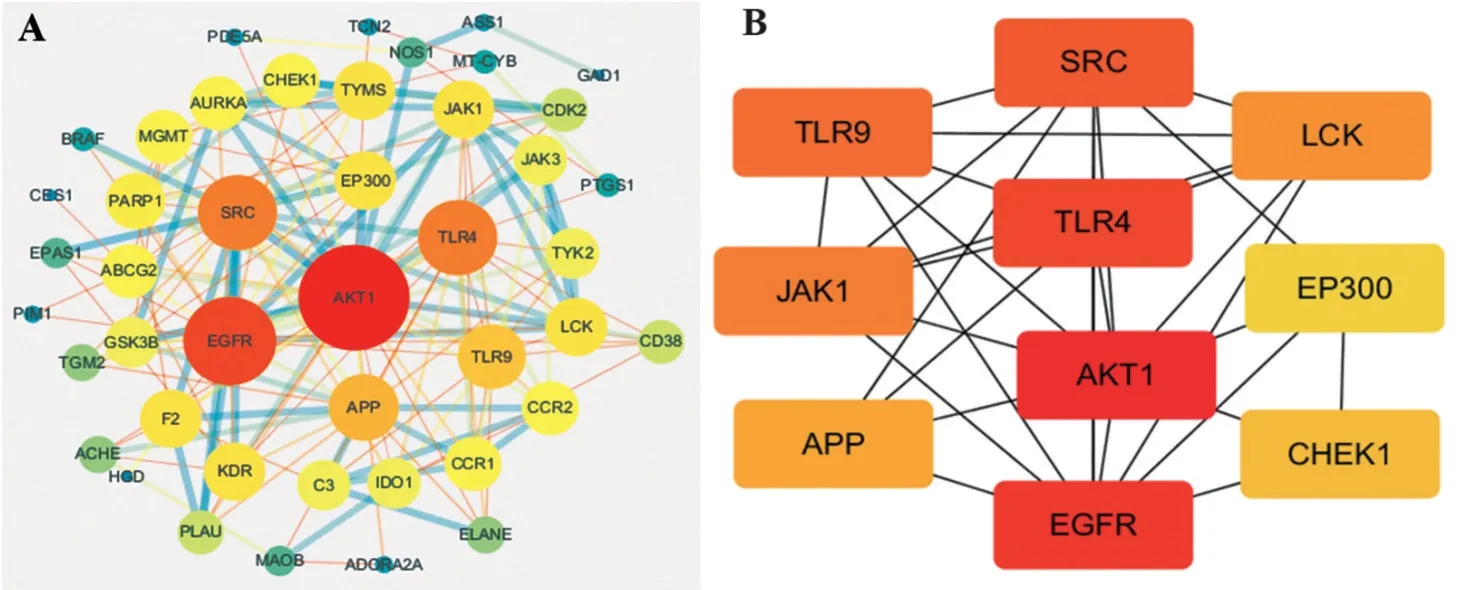
图3 PPI网络的可视化图及核心靶点图
2.5 基因功能和通路富集分析及“成分-靶点-通路”网络的构建 GO 分析包括生物学过程(BP)、细胞组分(CC)和分子功能(MF)。GO 分析共富集到111 条生物学过程,其中所涉及BP 为77 条,CC 为14 条,MF 为20 条。KEGG 通路富集分析共涉及38条信号通路。运用Omicshare 在线工具,均按照富集基因数目筛选出Top 20 富集结果,以P<0.05 为阈值,绘制动态富集气泡图。
GO 分析结果显示,Top 20 条生物学过程主要包括先天免疫反应(innate immune response)、细胞对机械刺激的反应(cellular response to mechanical stimulus)、调节细胞增殖(regulation of cell proliferation)等;KEGG通路富集结果显示,Top 20信号通路中主要包括PI3K-AKT信号传导途径(PI3K-Akt signaling pathway)、癌症途径(pathways in cancer)、Toll 样受体信号通路(Toll-like receptor signaling pathway)等。“成分—靶点—通路”网络有1 个AcOBOA 节点,10 个基因节点,20 个信号通路节点,共形成64 条连线,根据Degree 值由小到大顺时针分布,节点面积越大,说明该节点越重要。可见靶点中AKT1 及通路中PI3K-AKT通路在该网络中发挥重要作用,见图4。提示AKT1及PI3K-AKT通路在AcO-BOA防治ALI中具有重要意义。

图4 富集分析气泡图和网络图
2.6 分子对接验证结果 将AcO-BOA 与筛选出的Top 10 靶点进行分子对接验证。对接结果与结合能大小相关,结合能是指配体和受体分子之间相结合的能力。当结合能<0 kJ/mol 时,表示化合物与蛋白可以自发结合;结合能<-5 kJ/mol 时,表明化合物与蛋白之间有较好的结合活性[7],以此类推,结合能越小,两者间发生结合作用的可能性越大,并且结合得越稳定。所得对接结果如表3 所示,结果表明,除了TLR9、LCK 两个靶点不能与AcOBOA 自发结合外,其余靶点均能与AcO-BOA 自发结合,且有较好的结合活性,其中AcO-BOA 与AKT1 的结合能为-5.64 kJ/mol,说明AcO-BOA 与AKT1 能稳定的结合,验证了上述网络药理学所预测的结果,表明AcO-BOA 可能通过调控PI3K-Akt信号通路产生抗肝损伤的药理作用。利用Pymol软件对结果进行可视化,见图5。
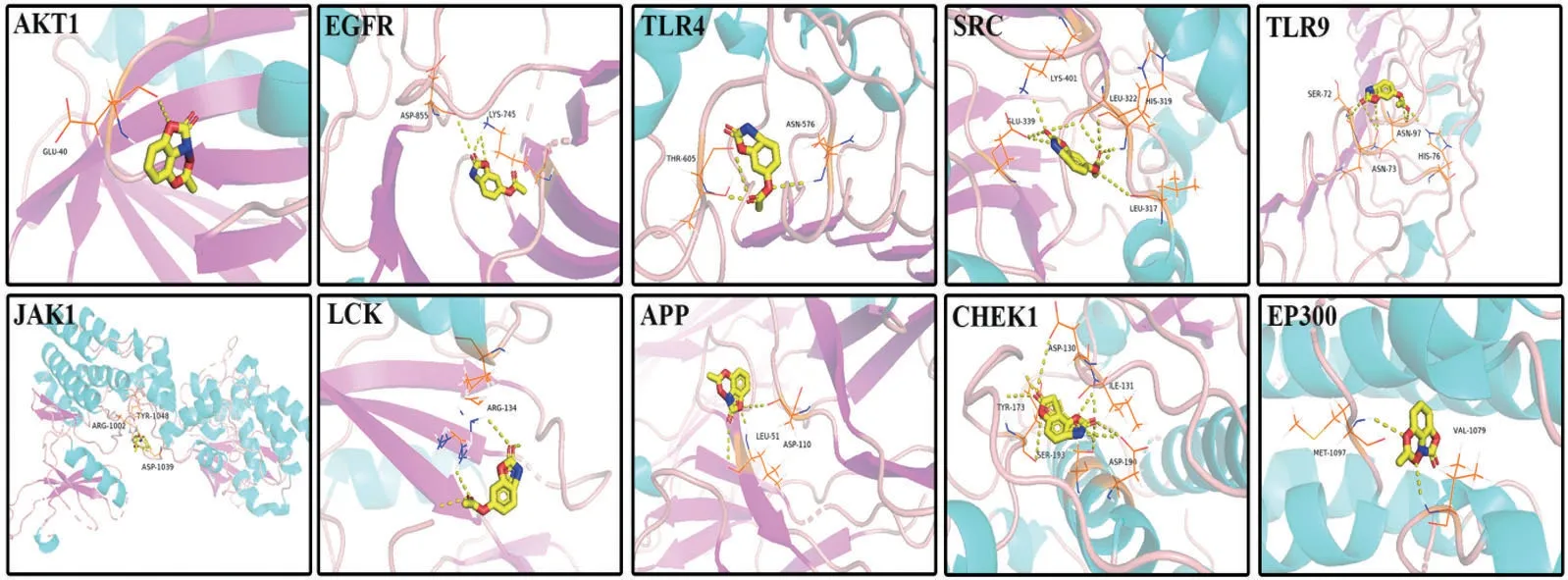
图5 AcO-BOA与核心靶点的分子对接结果图

表3 分子对接结果
2.7 5 组血清ALP 含量及AKT/p-AKT 蛋白表达量比较 与正常组相比,模型组血清中ALP含量及p-AKT蛋白表达量显著升高,AKT蛋白表达量显著降低(均P<0.01);与模型组相比,AcO-BOA低、中、高剂量组中ALP含量均显著降低,AcO-BOA中、高剂量组p-AKT 蛋白表达量显著降低,AcO-BOA 高剂量组AKT蛋白表达量显著升高(均P<0.01),见图6。

图6 5组小鼠血清ALP含量及肝组织AKT、p-AKT蛋白表达比较
3 讨论
ALI 的病因主要有药物毒物反应、肝脏脂肪病变、自身免疫性疾病等[8]。肝损伤是急性肝衰竭的基础,严重或持续性肝损伤会导致肝衰竭[9]。对于急性肝衰竭,目前除了肝移植外,临床上缺乏有效的治疗药物和方法[10]。前期研究结果表明,AcOBOA可以改善四氯化碳所导致的肝纤维化,但其对ALI的具体机制尚不明确,需要进一步探讨。
本研究运用网络药理学获取AcO-BOA发挥防治ALI的潜在靶点及信号通路,共得到10个核心靶点,依次是AKT1、EGFR、TLR4、SRC、TLR9、JAK1、LCK、APP、CHEK1 和EP300。蛋白互作关系表明AKT1在Top 10靶点中的作用尤为重要,提示AKT1可能是AcO-BOA 防治ALI 过程中的重要靶点。GO 和KEGG 通路富集结果表明AcO-BOA 防治ALI 过程中主要参与的生物学过程有先天免疫反应、炎症反应的正调控、调节细胞增殖、蛋白质磷酸化等;主要的信号通路有PI3K-AKT信号传导途径、癌症途径、Toll 样受体信号通路、弓形虫病、甲状腺激素信号通路、破骨细胞分化等。上述结果表明AcO-BOA 可以通过多靶点,多通路发挥抗肝损伤作用,且AKT1 及PI3K-AKT 信号通路在AcO-BOA防治ALI 中具有重要意义。许多研究表明,PI3KAKT信号通路在防治ALI过程中具有重要地位,如Zhong等[11]研究表明,姜黄素抑制PI3K/AKT通路的激活,促进脂多糖诱导的肝损伤细胞凋亡。
动物实验结果表明,AcO-BOA 能显著降低血清中ALP含量,血清中ALP的水平常用于肝脏疾病的诊断与治疗,表示AcO-BOA 对小鼠ALI 有一定的保护作用。PI3K-AKT 途径在细胞中普遍存在,并且在许多疾病发生发展中起着重要作用。牛艳邦[12]研究发现,在Toll 样受体介导的炎症发生时抑制PI3K 信号,可以抑制促炎因子的分泌以及增加抗炎因子IL-10的分泌。PI3K/Akt途径在调节细胞生长、增殖、分化、运动、存活和细胞内运输中起着关键作用[13]。PI3K是该信号通路的关键因子,AKT也称蛋白激酶B,是PI3K下游重要的效应物。PI3K被激活后,生成3位磷酸化的磷脂产物,该产物使得AKT在磷酸肌醇依赖性酶(PDK)的作用下发生磷酸化后进而正性调控细胞周期,促进细胞周期的转换[14]。动物实验结果显示,经LPS/D-GalN 造模后,AcO-BOA 的预处理能下降p-AKT 蛋白的表达,表明AcO-BOA 可以抑制AKT 的磷酸化,抑制PI3K/AKT信号通路,降低LPS所引起的炎症反应。
综上所述,本文以ACO-BOA为研究对象,结合网络药理学方法,对其发挥ALI 的保护作用机制进行探讨。研究结果初步表明,ACO-BOA 能够有效预防小鼠ALI的发生,其作用机制可能与调控PI3K/AKT信号通路有关,为进一步研究提供了新的思路和理论依据,但仍需深入地对相关靶点和通路进行实验验证。
- 广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*

