LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
赵 梦,汪玉宝△,邵 婧,杨 梅
(湖北省鄂州市中心医院 1.全科医学科;2.消化内科,鄂州 436000)
胃癌是全球范围内最常见的恶性肿瘤之一,早期胃癌主要通过手术治疗,但多数患者确诊时已属中、晚期,其恶性程度高,预后差[1]。靶向治疗给晚期胃癌患者带来了希望,已有部分靶向药物用于胃癌的治疗,但仍需研发更多新的靶向药物[2]。研究表明,非编码RNA 微小RNA(miRNA)及长链非编码RNA(lncRNA)均参与了胃癌的发生发展过程,且lncRNA还可作为竞争性内源RNA(ceRNA)与靶基因竞争结合miRNA,进而参与调控胃癌进程[3]。研究发现,长链非编码RNA小核仁RNA宿主基因7(lncRNA SNHG7)在胃癌组织中高表达[4]。干扰SNHG7 表达通过调节P15 和P16 抑制胃癌细胞增殖,促进细胞凋亡且可抑制体内肿瘤的生长[5]。抑制SNHG7 表达可抑制宫颈细胞的增殖和侵袭,且与患者预后相关[6]。研究报道miR-146a-5p 通过靶向Rho 相关的含卷曲螺旋蛋白激酶1(Rho-associated coiled-coil containing protein kinase 1,ROCK1)诱导非雄激素依赖性前列腺癌细胞凋亡[7]。miR-146a-5p过表达显著抑制了乳腺癌细胞的增殖、侵袭和迁移[8]。miR-146a-5p在胃癌中低表达,与肿瘤发生密切相关,可用于胃癌的诊断和预后[9]。且研究发现miR-146a-5p 在具有高腹膜转移潜能的胃癌细胞中表达下调[10]。然而,miR-146a-5p对胃癌细胞恶性生物学行为的应激尚未可知,SNHG7 对胃癌细胞迁移、侵袭的影响及其机制是否与miR-146a-5p 有关尚不清楚。本实验旨在研究SNHG7 是否通过调控miR-146a-5p 影响胃癌细胞的增殖、迁移、侵袭和凋亡,以期为胃癌的治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 一般资料 选取湖北省鄂州市中心医院2015年1月至2018年1月接收的患者23例,其中男13例,女10例,所有患者经病理诊断确为胃癌,术前均未接受过放、化疗治疗,临床病例资料完整,手术切除癌组织,样本收集经患者同意且签署知情同意书。
1.1.2 细胞与试剂 正常胃黏膜上皮细胞GES-1和胃癌细胞NCI-N87、Hs-746T、NCI-SNU-16 购自ATCC;RPMI-1640 培养基购自北京泽平科技有限责任公司;SYBR Premix ExTaqTM试剂盒购自北京天根生化科技有限公司;MTT 试剂盒、Annexin VFITC/PI试剂盒购自美国Sigma公司;双荧光素酶报告基因检测试剂盒购自上海泽叶生物科技有限公司。
1.2 方法
1.2.1 细胞培养与分组 人正常胃黏膜上皮细胞GES-1和胃癌细胞NCI-N87、Hs-746T、NCI-SNU-16用RPMI-1640 培养液(含10%胎牛血清)培养;取对数生长期细胞NCI-N87,将SNHG7 干扰质粒(si-SNHG7)及其阴性对照(si-NC)分别转染至NCIN87中,记为si-SNHG7组、si-NC组;将si-SNHG7分别与anti-miR-NC、anti-miR-146a-5p 共转染至NCIN87 中,记 为si-SNHG7+anti-miR-NC 组、si-SNHG7+anti-miR-146a-5p组。
1.2.2 随访 以患者术后出院为观察起始,定期对患者进行电话随访同时结合患者复诊病历,随访内容包括有无复发、生存结局、生存时间,随访时间截止于2019 年5 月,纪录患者生存时间并计算生存率。
1.2.3 实时荧光定量PCR(real-time quantitative PCR,qPCR)检测SNHG7 和miR-146a-5p 的表达水平 提取组织及细胞总RNA,合成cDNA,按照说明书操作进行PCR,循环条件:95 ℃预变性2 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;相对表达量用2-△△Ct法计算。SNHG7 上游引物序列:5’-CTAGGGGACTGGGCTGCT-3’,下游:5’-AGGGTCTTAGGTTCCAGGCA-3’;β-actin上游引物序列:5’-CTCCATCCTGGCTCGCTGT-3’,下游:5’-GCTGTCACCTTCACCGTTCC-3’;miR-146a-5p 上游引物序列:5’-CGGATCCTTGGTCTCCTCCAGATGTTTAT-3’,下游:5’-CCTCGAGTCATTAAAGTGATTTCTCCCAAG-3’;U6 上游引物序列:5’-CGCTTCGGCAGCACATATACTA-3’,下游:5’-CG-CTTCACGAATTTGCGTGTCA-3’;引物由上海生工生物工程公司合成。
1.2.4 MTT 检测细胞活力 收集细胞,按MMT 试剂盒说明书操作,每孔分别加入5 mg/mL的MTT溶液20 μL,于培养箱中继续孵育4 h 后弃去上清液,每孔加入DMSO150 μL,振荡反应10 min 使沉淀溶解,最后用酶标仪检测490 nm处吸光度(A)值。以A值表示细胞活力。
1.2.5 Transwell 检测细胞迁移和侵袭 将细胞在无血清的培养液中饥饿12~24 h,终止消化后离心去除培养液,调整细胞浓度为5×105/mL;细胞迁移实验:将200 μL细胞悬液和600 μL RPMI-1640培养液分别添加到Transwell 的上室和下室,培养24 h,取出小室并吸除培养液,4%多聚甲醛固定30 min,PBS溶液冲洗2次,室温下加入0.1%结晶紫染色30 min,冲洗2次,用无菌棉球轻轻擦去上室表面细胞,微镜下观察并拍照。细胞侵袭实验:用Matrigel 包被Transwell上室,其余与细胞迁移实验步骤相同。
1.2.6 流式细胞术检测细胞凋亡 收集细胞,用预冷的PBS 漂洗2 次,然后加入10 μL 的Annexin VFITC,再加入5 μL的PI,混匀后避光孵育10 min;上流式细胞仪检测细胞凋亡率。
1.2.7 蛋白质印迹(Western blotting)法检测E-cadherin、N-cadherin、Vimentin 蛋白表达 提取细胞总蛋白,用BCA 定量。取40 μg 蛋白样品进行SDSPAGE,先用90 V 电压跑30 min,再用120 V 电压跑2 h,然后经电转将蛋白转移至PVDF上;用5%脱脂牛奶室温封闭2 h,分别加入E-cadherin、N-cadherin、Vimentin 多克隆抗体(1∶800),4 ℃冰箱孵育过夜,PBS 洗涤3 次,5 min/次;再加入山羊抗兔IgG-HRP(1∶1 200)室温孵育2 h,PBS 洗涤3 次,10 min/次,加入化学发光液显影,定影,成像后用Quantity One检测蛋白条带灰度值,以目的条带和β-actin条带的比值作为蛋白表达水平。
1.2.8 荧光素酶报告实验检测SNHG7对miR-146a-5p 的靶向调控 starBase 数据库显示SNHG7 与miR-146a-5p存在结合位点。构建SNHG7的野生型和突变型荧光素酶表达载体,将其分别与miR-NC和miR-146a-5p 共转染至细胞NCI-N87 中,按照说明书检测荧光素酶活性。
1.3 统计学方法
采用SPSS 20.0 进行数据分析,计量资料用均数±标准差()表示,两组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSDt检验,以P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA SNHG7在胃癌细胞株中的表达情况
与人正常胃黏膜上皮细胞GES-1 相比,胃癌细胞NCI-N87、Hs-746T、NCI-SNU-16 中LncRNA SNHG7表达水平显著升高(P<0.05),见表1。根据所有患者组织标本中检测的SNHG7 的平均表达量,将其分为高表达和低表达组,LncRNA SNHG7高表达的患者生存率低于低表达的患者生存率,见图1。
表1 胃癌细胞株中LncRNA SNHG7的表达 ,n=9
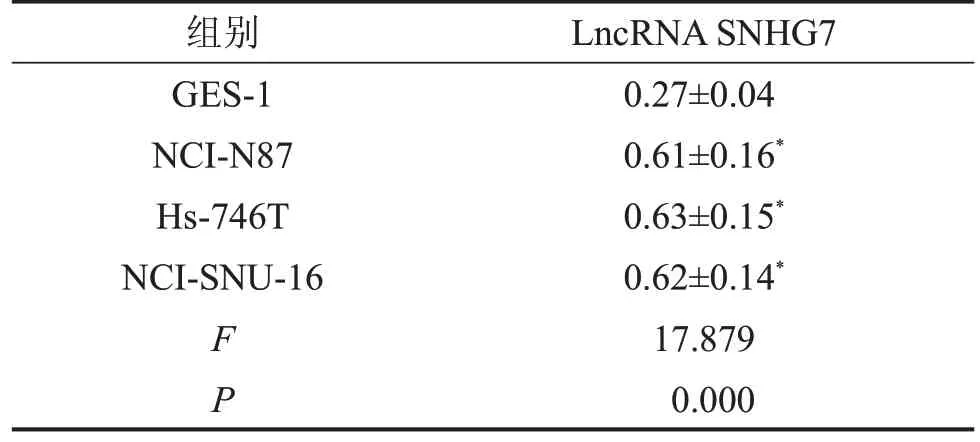
表1 胃癌细胞株中LncRNA SNHG7的表达 ,n=9
与人正常胃黏膜上皮细胞GES-1相比,*P<0.05。
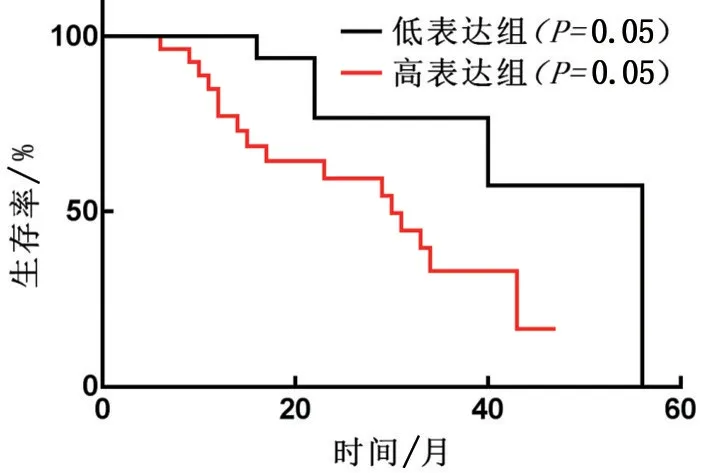
图1 LncRNA SHNG7高表达和低表达患者的生存率(n=23)
2.2 LncRNA SNHG7 的敲减对胃癌细胞NCI-N87的增殖、迁移、侵袭和凋亡的影响
与si-NC 组相比,si-SNHG7 组胃癌细胞NCIN87 中SNHG7 表达水平降低,细胞活力降低,细胞迁移、侵袭数降低,细胞凋亡率升高,E-cadherin 蛋白表达水平升高,N-cadherin 蛋白、Vimentin 蛋白表达水平降低(P<0.05),见图2、图3和表2、表3。
表2 lncRNA SNHG7的敲减对NCI-N87细胞增殖、迁移、侵袭和凋亡的影响 ,n=9
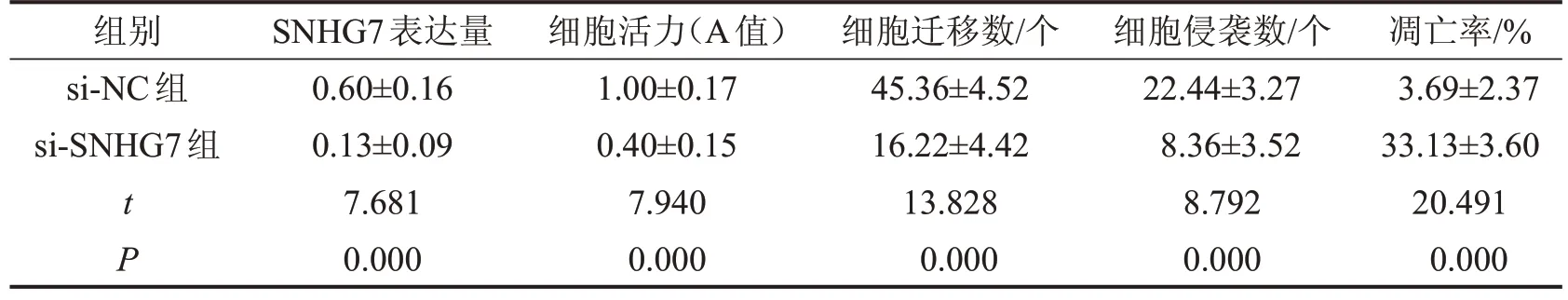
表2 lncRNA SNHG7的敲减对NCI-N87细胞增殖、迁移、侵袭和凋亡的影响 ,n=9
表3 LncRNA SNHG7的敲减对NCI-N87的迁移、侵袭相关蛋白表达的影响
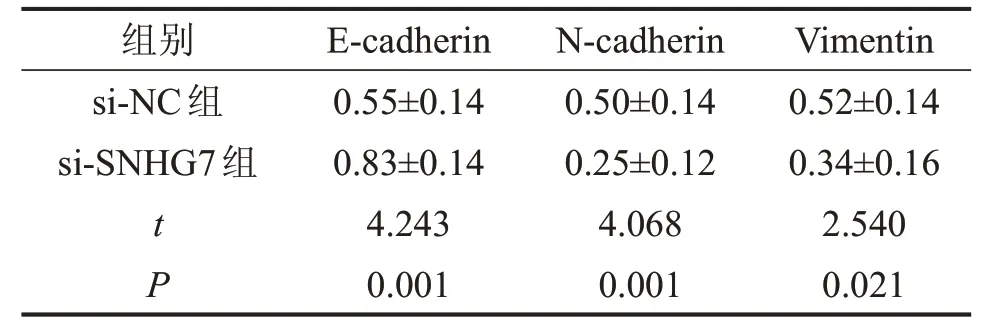
表3 LncRNA SNHG7的敲减对NCI-N87的迁移、侵袭相关蛋白表达的影响
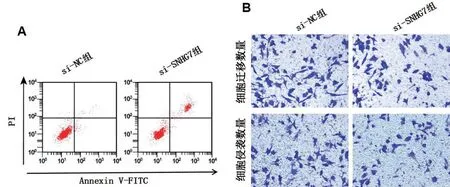
图2 LncRNA SNHG7敲减对NCI-N87细胞凋亡的影响
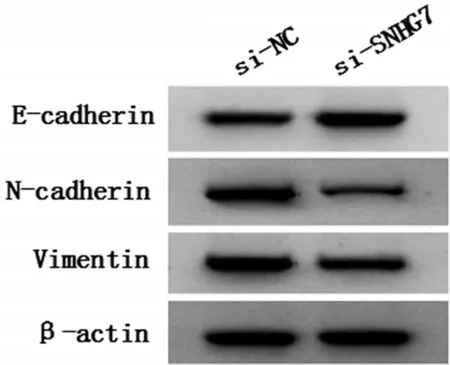
图3 LncRNA SNHG7的敲减对NCI-N87的迁移、侵袭相关蛋白表达的影响
2.3 LncRNA SNHG7 靶向miR-146a-5p,抑制miR-146a-5p的表达
starBase3.0 网站预测显示,LncRNA SNHG7 与miR-146a-5p 有结合位点,见图4。与miR-NC 组相比,miR-146a-5p组转染野生型表达载体的NCI-N87细胞荧光素酶活性显著降低(P<0.05),见表4。抑制SNHG7 表达后miR-146a-5p 表达水平升高(P<0.05),见表5。
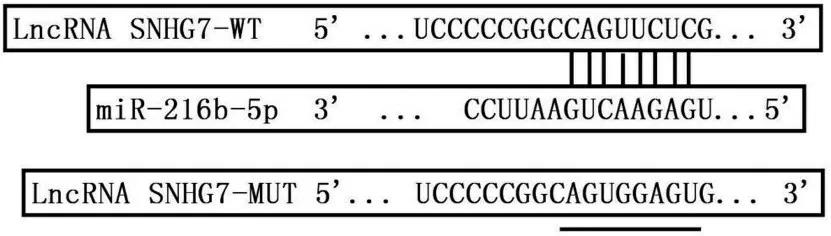
图4 LncRNA SNHG7与miR-146a-5p的结合位点
表4 NCI-N87 细胞中lncRNA SNHG7 与miR-146a-5p 的靶向关系 ,n=9

表4 NCI-N87 细胞中lncRNA SNHG7 与miR-146a-5p 的靶向关系 ,n=9
表5 NCI-N87 细胞中lncRNA SNHG7 的敲减对miR-146a-5p的表达的影响 ,n=9

表5 NCI-N87 细胞中lncRNA SNHG7 的敲减对miR-146a-5p的表达的影响 ,n=9
2.4 miR-146a-5p在胃癌细胞株中的表达
与人正常胃粘膜上皮细胞GES-1 相比,胃癌细胞NCI-N87、Hs-746T、NCI-SNU-16 中miR-146a-5p表达水平显著降低(P<0.05),见表6。
表6 胃癌细胞株中miR-146a-5p的表达 ,n=9

表6 胃癌细胞株中miR-146a-5p的表达 ,n=9
与人正常胃黏膜上皮细胞GES-1相比,*P<0.05。
2.5 抑制miR-146a-5p 的表达逆转了敲减SNHG7对NCI-N87细胞增殖、迁移、侵袭和凋亡的影响
与si-SNHG7+anti-miR-NC 组相比,si-SNHG7+anti-miR-146a-5p 组miR-146a-5p 表达水平降低,细胞活力升高,细胞迁移、侵袭数升高,细胞凋亡率降低,E-cadherin 表达水平降低,N-cadherin 蛋白、Vimentin蛋白表达水平升高(P<0.05),见图5、图6和表7。
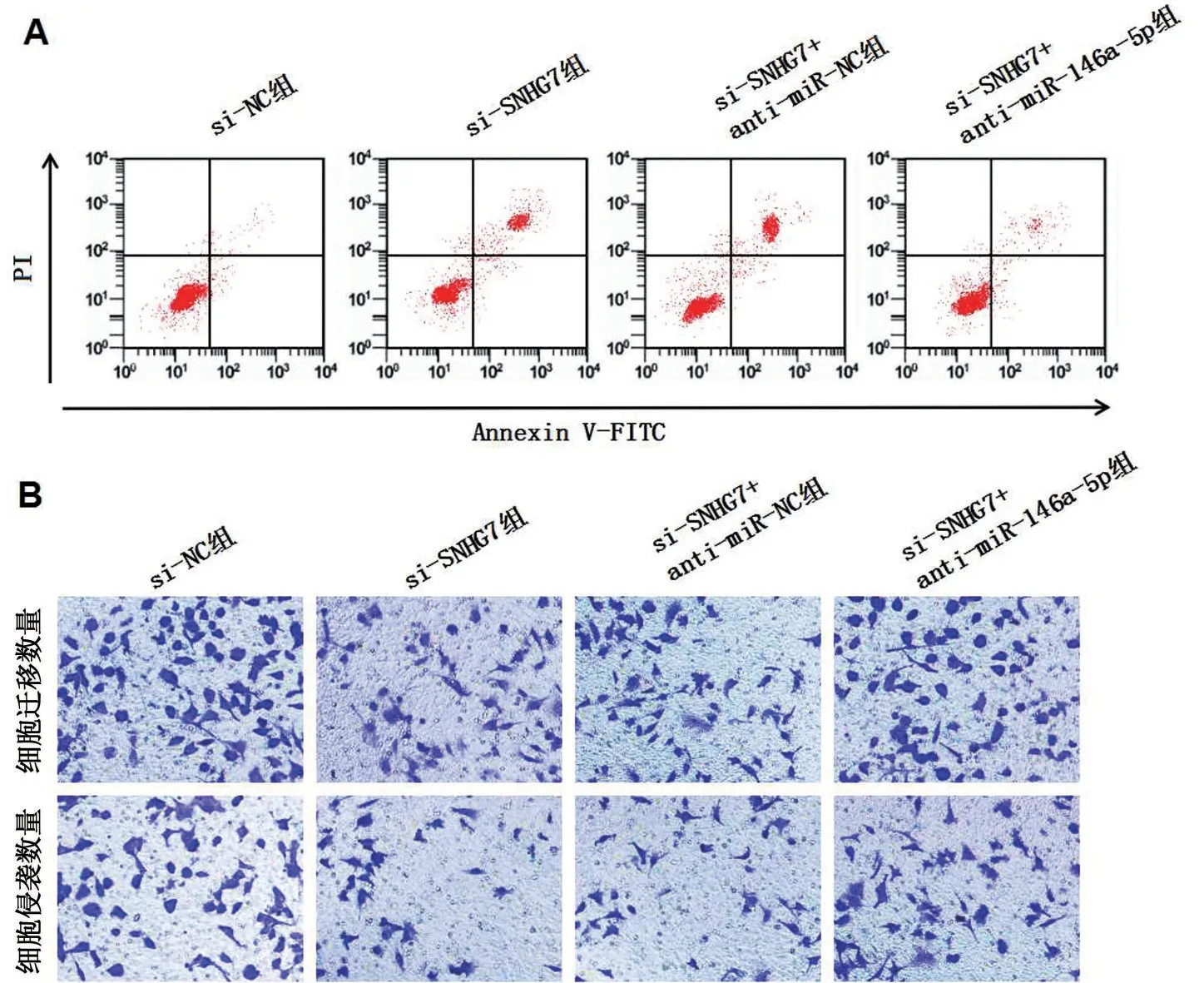
图5 抑制miR-146a-5p表达逆转敲减lncRNA SNHG7对NCI-N87细胞凋亡影响
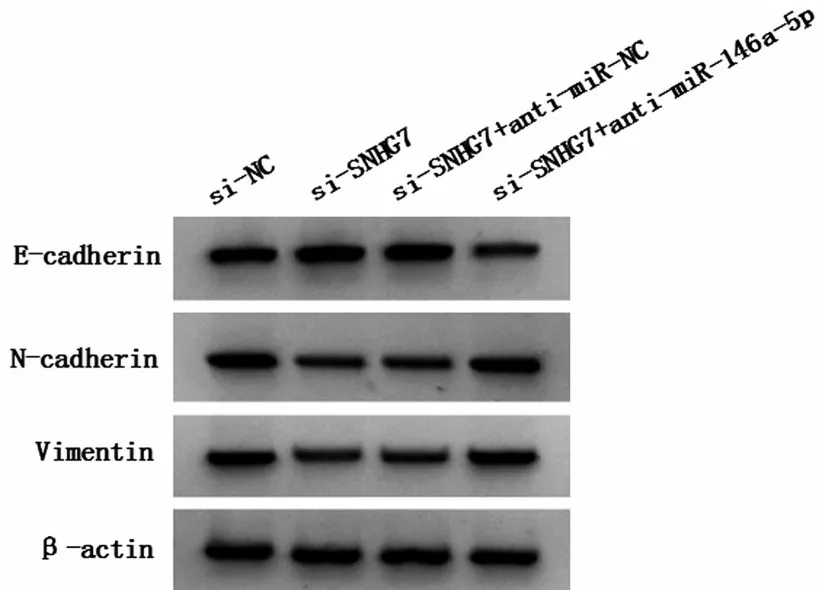
图6 抑制miR-146a-5p 表达逆转敲减lncRNA SNHG7 对NCI-N87细胞迁移、侵袭相关蛋白表达的影响
表7 抑制miR-146a-5p表达逆转敲减lncRNA SNHG7对NCI-N87细胞和迁移和侵袭的影响 ,n=9
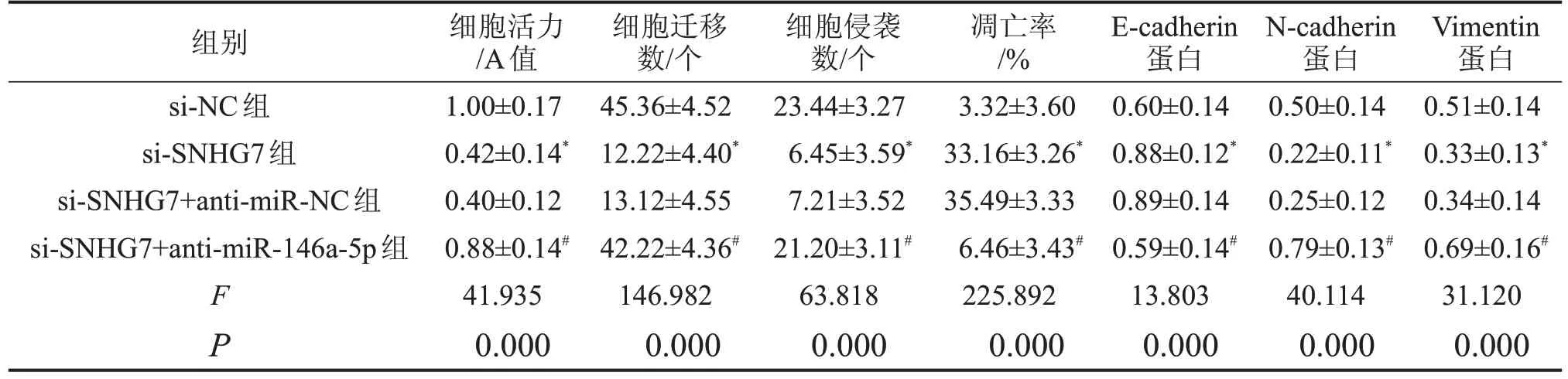
表7 抑制miR-146a-5p表达逆转敲减lncRNA SNHG7对NCI-N87细胞和迁移和侵袭的影响 ,n=9
与si-NC组相比,*P<0.05;与si-SNHG7+anti-miR-NC组相比,#P<0.05。
3 讨论
胃癌是消化系统常见的恶性肿瘤,发病率较高,现有的胃癌治疗手段有限,手术和放疗、化疗方法还未能达到理想效果,亟需新的治疗方法[11]。研究表明,lncRNA 参与胃癌的发生发展过程,在胃癌诊断、靶向治疗和预后等方面具有广阔前景[12]。研究报道,SNHG7 在乳腺癌组织中显著上调,抑制SNHG7 可以抑制乳腺癌细胞的增殖和侵袭[13]。敲低SNHG7 抑制了肝癌细胞在体外的增殖,迁移和侵袭[14]。SNHG7通过调节miR-34a抑制骨肉瘤中细胞活力,迁移和侵袭以及EMT,诱导细胞凋亡[15]。lncRNA SNHG7 通过增强Fas 凋亡抑制分子2(Fasapoptotic inhibitory molecule 2,FAIM2)表达来促进肺癌细胞的增殖、迁移和侵袭,并抑制其凋亡[16]。以上研究表明,lncRNA SNHG7 参与调控多种肿瘤的发生发展进程,其多作为促癌基因起作用;但其对胃癌细胞的影响尚不其清楚。本实验首先用qPCR检测胃癌细胞中SNHG7的表达水平,结果发现SNHG7 高表达,且生存曲线结果显示,SNHG7 高表达的患者生存率低(P<0.05),说明SNHG7 在胃癌中也起促癌基因作用,其可能影响患者预后。将抑制SNHG7表达载体转染至胃癌细胞中,检测细胞恶性生物学行为,结果显示,细胞活力以及细胞迁移、侵袭数降低,细胞凋亡率升高,E-cadherin表达水平升高,N-cadherin、Vimentin 表达水平降低(P<0.05)。E-cadherin、N-cadherin、Vimentin 是EMT 过程中的标记物,EMT 与胃癌细胞体内转移有关,细胞迁移侵袭能力增强时N-cadherin、Vimentin 表达水平升高[17]。说明抑制SNHG7表达可抑制胃癌细胞增殖、迁移、侵袭和EMT,并促进细胞凋亡;其在胃癌中的作用与在其他癌症中作用相似。
研究报道,miR-146a-5p 在颅内动脉瘤患者的血浆样本中高表达,与患者预后相关[18]。miR-146a-5p 可以抑制三阴性乳腺癌细胞的增殖、迁移和侵袭,抑制间充质标记N-cadherin、Vimentin 的表达并增加上皮标记E-cadherin的表达[19]。miR-146a-5p过表达还增强了人参皂苷Rh2诱导的肝癌细胞凋亡和抗增殖作用[20]。以上研究表明,miR-146a-5p在多种癌症中起抑癌基因作用,且影响患者预后。qPCR结果显示,胃癌细胞中miR-146a-5p 低表达(P<0.05),表明miR-146a-5p 在胃癌中可能也起抑癌作用。本实验的双荧光素酶结果表明,SNHG7靶向调控miR-146a-5p。此外,抑制miR-146a-5p 表达逆转了抑制SNHG7表达对胃癌细胞增殖、迁移、侵袭和凋亡的影响(P<0.05),提示SNHG7 可能通过调控miR-146a-5p 影响胃癌细胞增殖、迁移、侵袭和凋亡。
综上所述,抑制SNHG7 表达可能通过上调miR-146a-5p 表达抑制胃癌细胞增殖、迁移、侵袭,促进细胞凋亡。
- 广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
- 基于网络药理学探讨4-乙酰氧基苯并噁唑-2-酮对急性肝损伤的作用机制*

