HO-1基因转染对骨髓间充质干细胞增殖、表型及多向分化能力的影响
陈旭昕 唐 俭 李虎明 孟激光 韩志海
骨髓间充质干细胞(bone marrow-derived mesenchymal stem cell, BM-MSC)是一种具有自我更新和多向分化潜能的多功能干细胞[1]。研究表明,输入外源性或迁移的内源性干细胞能定植在损伤的肺组织内,分化为多种肺细胞,参与受损肺组织的修复与重构,可治疗急性肺损伤、肺纤维化和慢性阻塞性肺疾病[2, 3]。但是在疾病状态下,机体处于缺血缺氧、氧化应激、休克、炎症爆发的环境中,移植到损伤部位的MSC由于不适应恶劣的体内环境,约90%以上会死亡,大大降低了MSC在损伤修复中的疗效[4]。血红素加氧酶(heme oxygenase, HO)是一种细胞微粒体酶,参与细胞保护、凋亡和炎症[5]。已有研究表明,经血红素加氧酶-1(HO-1)修饰后的MSC耐受缺氧复氧损伤能力显著增强,并提高了MSC对受损心肌的修复能力[6]。但HO-1基因修饰增强MSCs缺氧耐受的同时是否会对MSC的“干性”特征造成影响尚缺乏直接证据证实,有待于进一步实验研究证实。因此,本研究拟以大鼠BM-MSC为研究对象,以重组慢病毒载体为介导,构建过表达大鼠HO-1基因的MSC,比较原代MSC与MSC-HO-1的增殖生长活性、免疫表型及多向分化能力的变化,以期为后续研究奠定基础。
材料与方法
1.材料:SPF级Wistar大鼠(3~4周龄,体质量为100~120g)由军事医学科学院实验动物中心提供。重组慢病毒载体Lenti-GFP-HO-1(Lenti-HO-1)及空慢病毒载体(Lenti-GFP)均购自上海吉凯基因化学技术有限公司。DMEM培养基和优质胎牛血清均购自美国Gibco公司。抗rat-HO-1多克隆抗体、抗β-actin及二抗购自美国Santa Cruz公司。考马斯亮蓝蛋白质浓度测定试剂盒及总蛋白提取试剂盒购自上海碧云天生物技术公司。成骨、成脂及成软骨诱导培养基均购自苏州赛业生物科技有限公司。藻红蛋白(PE)标记的抗CD29、CD73、CD105、CD34和CD11b以及异硫氰酸荧光素(FITC)标记的抗CD90、CD45和CD14均购自英国Abcam公司。ECL-PLUS发光试剂盒及蛋白marker均购自美国Thermo Fisher公司。其他生化试剂均为进口或国产分析纯。
2.MSC分离培养:无菌条件下分离大鼠股骨,剪去股骨两端,放入10%胎牛血清(FBS)的DMEM培养基中,反复用2ml无菌注射器冲洗骨髓腔,再用70nm尼龙网过滤后置于75cm2培养瓶中,在37℃、5% CO2及 95%湿度条件下培养。隔天换液1次,去除非贴壁细胞,贴壁细胞为MSC。取传代至2~3代细胞用于慢病毒转染及MSC-HO-1构建。实验所用细胞均处于对数生长期。
3.重组慢病毒载体转染MSC:将MSC接种于6孔板中,接种密度为1×106个/孔。共设置PBS组、空慢病毒载体(Lenti-GFP)组及重组慢病毒(Lenti-HO-1)组,待细胞融合度达70%~80%时,吸弃培养液,按分组分别在每孔中加入1ml PBS、Lenti-GFP或Lenti-HO-1(MOI=50)。12h后吸弃原培养液更换为DMEM完全培养基至终体积2ml继续孵育96h,荧光倒置显微镜及Western blot法检测慢病毒载体的转染效率。1.5μg/ml的嘌呤霉素加入到10% FBS DMEM完全培养基中用于筛选具有嘌呤霉素抗性的MSC,即稳定转染了Lenti-HO-1的MSC。
4.Western blot法检测HO-1蛋白表达:收集转染96h后的各组MSC和具有嘌呤霉素抗性第30代的MSC,按碧云天公司蛋白提取试剂盒说明书操作,提取细胞总蛋白,经考马斯亮蓝法测定蛋白浓度后。以β-actin为内参照,取25μl样品依次行SDS-PAGE电泳、电转至PVDF膜,经过脱脂牛奶封闭后,依次加入一抗、二抗,ECL发光液中显色。放入GBOX-HR凝胶成像分析系统中进行摄像分析。
5.MSC与MSC-HO-1生长曲线的测定:将第4代的MSC与MSC-HO-1按1×104个/孔接种至24孔板中,采用细胞计数法绘制两细胞株生长曲线。
6.MSC与MSC-HO-1免疫表型检测:采用流式细胞仪对MSC与MSC-HO-1表面标志分子进行检测。收集第4代的MSC与MSC-HO-1,PBS洗涤细胞两遍后用1%多聚甲醛固定30min,再次PBS洗涤细胞两遍,用2% FBS+相应直标抗体(PE标记抗CD29、CD73、CD105、CD34和CD11b以及FITC标记的anti-CD90、anti-CD45和anti-CD14)在室温下暗室中孵育1h,PBS清洗抗体,离心弃去上清,用500μl PBS重悬,置于流式专用管中上机检测。
7.MSC与MSC-HO-1多向分化能力测定:收集第4代MSC与MSC-HO-1,接种于6孔板中,接种密度为1×106个/孔。待细胞融合度达60%时,吸弃原培养液,再加入成骨、成脂肪或成软骨诱导分化完全培养基,继续孵育2周后分别采用茜素红染色、油红染色及阿利新蓝染色评估MSC与MSC-HO-1成骨、成脂肪及成软骨染色情况。

结 果
1.Lenti-HO-1转染MSC后转染效率评估:重组慢病毒Lenti-HO-1按MOI=50感染MSC 96h后,分别在普通倒置光镜下及荧光倒置显微镜下观察,可以在荧光倒置显微镜下观察到绿色荧光即存在GFP的表达。进一步提取细胞总蛋白,用Western blot法检测MSC内HO-1的表达以评估转染效率,结果显示,与PBS组及Lenti-GFP组比较,Lenti-HO-1组中HO-1的表达被显著上调,差异有统计学意义(P<0.05);而Lenti-GFP组与PBS组比较,HO-1的表达差异无统计学意义(P>0.05,图1)。
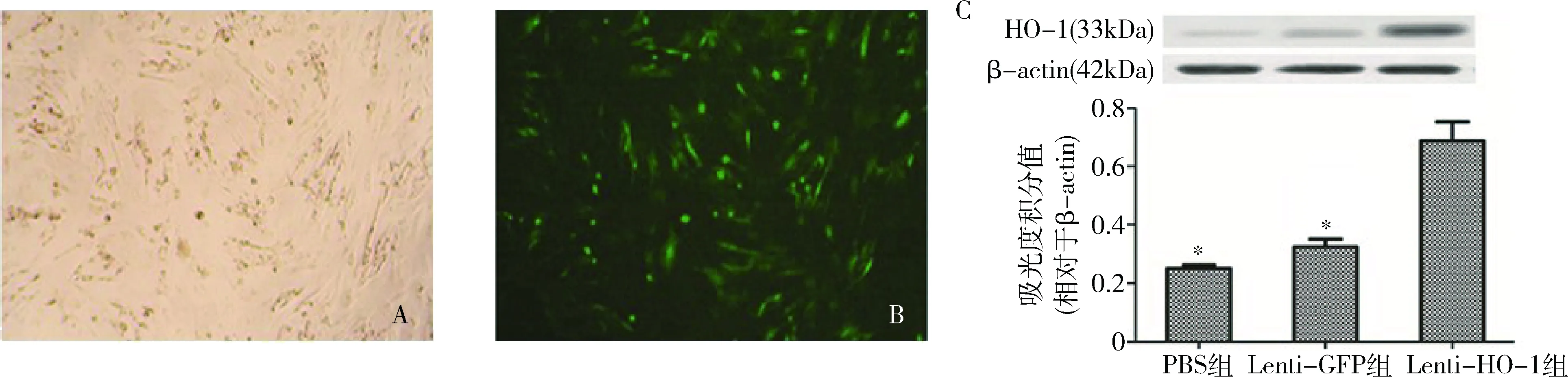
图1 Lenti-HO-1转染效率的评估A.普通光镜下观察转染后MSC(×100);B.荧光显微镜下观察转染MSC(×100);C.Western blot法分析各组MSC中HO-1的表达。与Lenti-HO-1组比较,*P<0.05
2.MSC-HO-1内HO-1蛋白表达检测:Western blot法分析结果显示,与第30代的MSC比较,第30代MSC-HO-1内HO-1蛋白表达明显增高,差异有统计学意义(P<0.05,图2)。
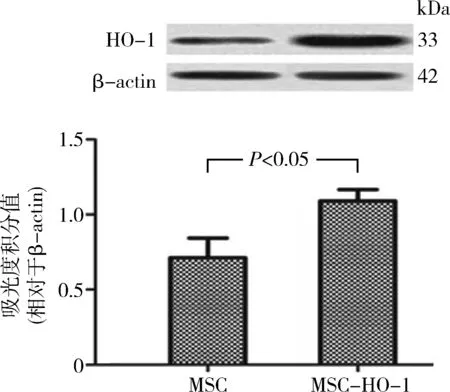
图2 第30代MSC及MSC-HO-1内HO-1蛋白表达水平检测
3.MSC与MSC-HO-1生长曲线的比较:采用细胞计数法比较MSC与MSC-HO-1的生长曲线变化,MSC-HO-1具有与MSC类似的增殖生长活性,生长曲线相似,差异无统计学意义(P>0.05,图3)。
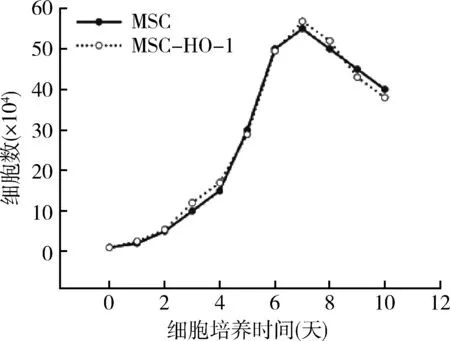
图3 MSC与MSC-HO-1生长曲线的比较
4.MSC与MSC-HO-1表型的比较:采用流式细胞仪对MSC与MSC-HO-1免疫表型进行检测,MSC与MSC-HO-1一样表达表面标志物CD29、CD90、CD73和CD105,但近乎不表达CD34、CD45、CD14和CD11b(图4)。
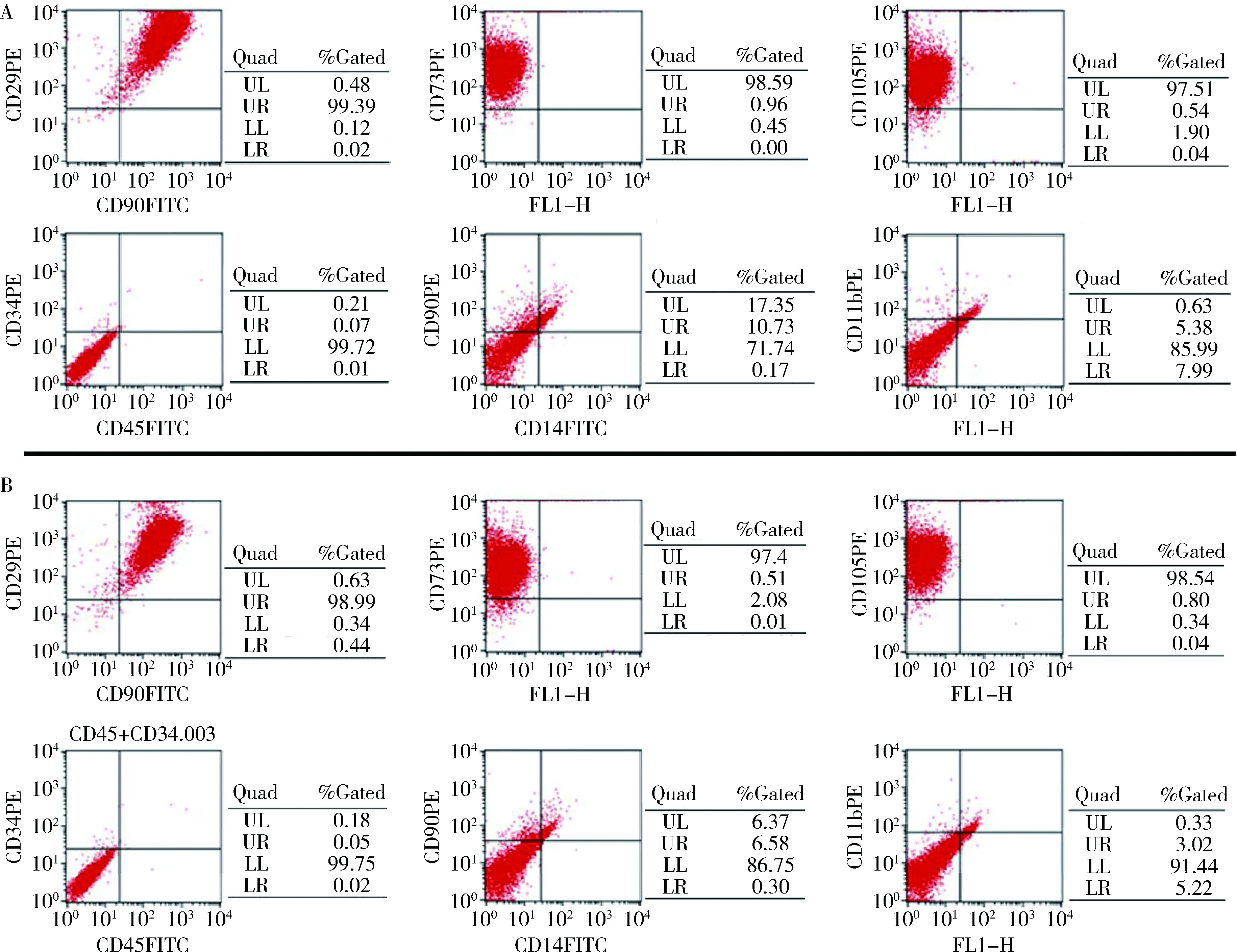
图4 MSC与MSC-HO-1免疫表型比较A.MSC表面标志的流式细胞仪检测;B.MSC-HO-1表面标志的流式细胞仪检测
5.MSC与MSC-HO-1多向分化能力的比较:分别采用茜素红染色、油红染色及阿利新蓝染色评估MSC与MSC-HO-1多向分化能力。MSC与MSC-HO-1在相应诱导培养基的作用下,均可成功分化为骨、脂肪及软骨(图5)。
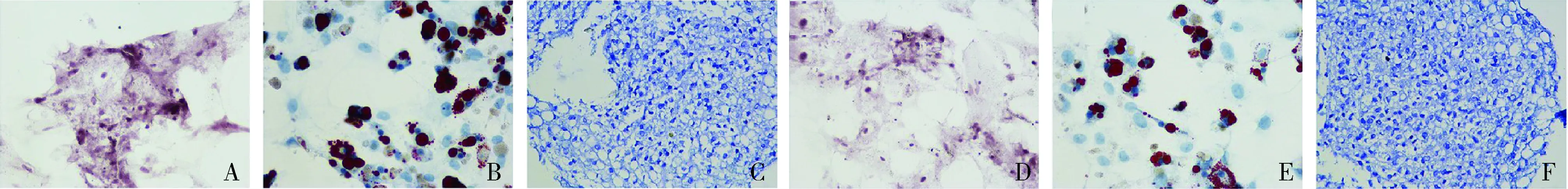
图5 MSC与MSC-HO-1多向分化能力比较(×400)A、D.成骨分化(茜素红染色);B、E.成脂分化(油红染色);C、F.成软骨分化(阿利新蓝染色)
讨 论
干细胞是近年来研究的热点,以干细胞工程为代表的现代组织工程学为组织器官的修复与替代提供了一个崭新的领域。MSC更新率低而代谢活力高,理论上可通过转基因技术使其获得外源目标基因并在体内体外长期稳定高效表达,是理想的基因治疗载体细胞[7]。本研究结果表明,利用Lenti-HO-1可成功转染MSC并对其实现基因修饰;与MSC比较,经HO-1修饰的MSC(MSC-HO-1)在增殖生长活性、免疫表型及多向分化能力方面未发生显著变化。
MSC是源于中胚层的成体干细胞的总称,目前发现骨髓、脂肪、脐带血中均存在自身MSC[8]。间充质干细胞干性是指干细胞自我复制和分化能力[9]。MSC干性的维持依赖于细胞的自我更新,即在MSC非分化性增殖的同时抑制细胞的凋亡并保持其多向分化的潜能[10]。自我更新是指干细胞分裂产生至少1个具有干细胞特性子细胞的过程。分化潜能是指未分化的干细胞在一定条件下可分化为各种类型的细胞[11]。MSC的干性维持包括自我更新和分化潜能两个方面,增殖和分化的平衡决定了MSC的最后归宿[12]。在平衡状态下,MSC可发育成脂肪、骨及软骨或其他类型组织细胞,而在失衡状态下则可能发生骨肉瘤及癌变等病变。在干细胞治疗过程中干性的维持对治疗效果起着决定性作用,干性特征的下降或丢失将影响治疗效果[9, 13]。因此,在利用基因工程对MSC进行基因修饰时,并保持MSC的干性特征是十分重要的。研究表明,HO-1在MSC的免疫调控中起着重要作用,抑制HO-1会逆转MSC的抗排异作用[14]。而上调HO-1表达则可改善MSC的缺氧耐受能力[5]。
本研究利用Lenti-HO-1成功构建了过表达HO-1的间充质干细胞,即MSC-HO-1。通过对MSC多向分化潜能的检测,结果显示,与MSC比较,MSC-HO-1同样具有向骨、软骨、脂肪多个胚层分化的能力,在相应诱导培养基的作用下,依然可成功分化为骨、脂肪及软骨组织。此外,笔者还比较了MSC-HO-1与MSC的生长曲线,结果显示,与MSC比较,MSC-HO-1具有类似的生长曲线。以上结果提示,经HO-1基因修饰后并未改变MSC的增殖生长活性及多胚层分化能力,即保留了MSC的干性特征。
国际细胞治疗学会间充质及组织干细胞委员会提出,人来源BMSC的表面标志分子包括CD105+、CD73+及CD90+,且阳性表达率达95%,而缺乏CD45、CD34、CD14、CD11b、CD79a、CD19、HLA-DR等细胞表面抗原标志物,阳性表达率应低于2%[15]。为了验证MSC-HO-1表型,取MSC-HO-1行流式细胞仪检测,结果显示,MSC-HO-1高表达CD29、CD90、CD73及CD105,表达率均>95%;同时几乎不表达CD34、CD45、CD14和CD11b,与未转染的MSC表型结果一致,提示慢病毒载体转染本身及HO-1表达并未改变MSC的免疫表型。
综上所述,本研究利用重组慢病毒载体Lenti-HO-1对MSC成功实施了HO-1基因修饰,结果还显示,成功构建的MSC-HO-1与MSC比较,具有相似的干性特征,HO-1基因修饰上调了MSC内HO-1的表达,同时也保留了MSC的基本特征。

