小干扰RNA沉默甲胎蛋白基因对HepG2细胞迁移及侵袭的影响
韩 伟, 魏丰贤, 张有成
兰州大学第二医院 普通外科, 兰州 730030
原发性肝癌是全球尤其我国癌症死亡的主要原因之一,总生存率仅为12.1%[1-2]。手术治疗目前仍是肝癌治疗的首选方案,但临床中往往面临早期确诊率低,大部分就诊患者存在肝内乃至远处转移情况,导致长期生存率较低[3]。总体而言,肝癌侵袭性强相关的早期转移和复发是导致患者生存率差的最主要原因,因此侵袭、转移相关通路一直是肝癌临床转化研究的重点领域。
甲胎蛋白(AFP)目前仍是临床工作中肝癌诊断、预后和随访监测的重要标记[4-5]。AFP在肝癌中表现出多种生物活性,前期研究发现用合成AFP小干扰RNA(small interference RNA, siRNA)转染肝癌细胞,靶向沉默AFP基因的表达可以抑制肝癌Huh7细胞的增殖,并可诱导肿瘤细胞的早期凋亡[6],但是目前关于AFP与肝癌侵袭、转移的关系及机制尚不完全清楚,因此本实验通过沉默AFP基因在肝癌HepG2细胞中的表达,观察其对HepG2细胞侵袭、转移等生物学行为的作用,以及探讨其相关机制,为肝癌相关侵袭和转移的临床应用转化提供一定支持。
1 材料与方法
1.1 材料 HepG2细胞(中科院上海细胞生物研究所),PMI1640培养基(HyClone公司),胎牛血清(HyClone公司),AFP siRNA转染试剂盒(Invitrogen公司),Trizol,cDNA反转录试剂盒、qRT-PCR试剂盒(大连TaKaRa公司),红色荧光标记的寡核苷酸(Invitrogen公司),AFP ELISA检测试剂盒(上海西塘公司),Transwell小室(Millipore公司),Matrigel(BD Biosciences公司),AFP一抗(北京博奥森公司),vimentin (Sigma-Aldrich公司),AKT,p-AKT,N-cadherin,E-cadherin(美国CST公司),GAPDH一抗(上海碧云天公司)。
1.2 方法
1.2.1 实验分组 HepG2细胞接种于6孔板,无血清RPMI1640培养基恒温箱继续培养24 h,分为空白对照组(不做任何处理)、阴性对照组(转染阴性siRNA)和AFP siRNA组(转染AFP siRNA)。
1.2.2 siRNA转染 AFP siRNA正义链序列:5′-AAUUGCAGUCAAUGCAUCUUUCACC-3′,反义链序列5′-GGUGAAAGAUGCAUUGACUGCAAUU-3′,按照确定的最佳转染条件,在6孔板中加入无血清培养基500 μl、AFP siRNA/阴性对照siRNA 10 nM/L以及脂质体转染试剂5 μl混匀后室温静置15 min。取已计数并稀释的HepG2细胞2.5 ml(细胞计数为1×105/ml)分别加入6孔板中,晃动培养板5 min并轻轻混匀后,恒温(37 ℃,5% CO2)温箱中孵育24 h后荧光显微镜下观察转染效率。之后弃用混合液后加入含血清的1640培养基(1 ml)后继续培养48 h。
1.2.3 qRT-PCR检测AFP基因的相对表达量 提取各组细胞总RNA,按逆转录试剂盒说明书操作得到cDNA。qRT-PCR检测各组细胞中AFP的表达,引物序列为正义链5′-GGAAGTCTGCTTTGCTGAAGA-3′和反义链5′-CACACCGAATGAAAGACTCGT-3′, β-actin正义链5′-GCAAGCAGGAGTATGACGAGT-3′和反义链5′-GCAAGCAGGAGTATGACGAGT-3′。扩增条件为95 ℃预变性30 s,95 ℃变性5 s,60 ℃ 30 s循环40次,72 ℃ 30 s退火,实验重复3次,2-ΔΔCt法对AFP mRNA的表达进行相对定量分析。
1.2.4 ELISA法检测细胞上清液中AFP的表达量 各组干预细胞转染48 h后,收集细胞上清液后进行ELISA实验。将酶联免疫仪设置采集450波长处各孔的吸光度值,按ELISA试剂盒说明书,根据所得的标准曲线,计算各组中AFP的含量,并重复3次。
1.2.5 迁移实验 Transwell上室加入干预后细胞100 μl(细胞数为2×104,培养基不含血清),下室加入完全细胞培养基750 μl,置于37 ℃恒温培养24 h,取出上室,固定后染色、漂洗并风干,显微镜下观察并计数迁移细胞的数量(200倍镜下,随机5个视野,取其平均值,均重复3次)。
1.2.6 侵袭实验 将经过干预的细胞100 μl(细胞数为2×104)加入Transwell上室(用稀释的Matrigel胶包被),每孔下室加入完全细胞培养基750 μl,余实验同上,并都重复3次。
1.2.7 Western blotting法测侵袭、转移相关蛋白表达量
按蛋白提取试剂盒说明书提取HepG2细胞中Vimentin、N-cadherin、E-cadherin、AKT和p-AKT蛋白。行SDS-PAGE分离蛋白,湿转法印迹到PVDF膜上,使用脱脂奶粉封闭1 h。分别加入vimentin、N-cadherin、E-cadherin、AKT及p-AKT等一抗4 ℃孵育过夜,TBST漂洗3遍。然后加入二抗后室温孵育1 h,TBST漂洗3遍达30 min。ECL试剂盒显影后凝胶成像仪显像,所得条带灰度扫描后行相对定量分析。

2 实验结果
2.1 转染效率 在siRNA为15 nmol/L、脂质体转染试剂为5 μl/3 ml和细胞数为1×105/ml的体系下,24 h后荧光显微镜下观察转染效率可达80%以上(图1)。
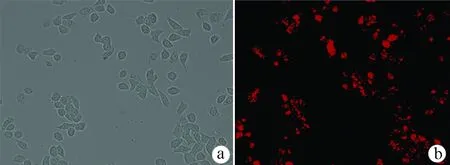
注:a,普通光镜视野下所见;b,荧光显微镜同一视野下所见。
2.2 AFP siRNA沉默效率检测 通过qRT-PCR及ELISA检测AFP mRNA和蛋白表达变化。与空白对照组相比,AFP siRNA组中AFP mRNA的相对表达量明显降低(P<0.01),抑制率达86.440%(表1);与空白对照组相比,AFP siRNA组细胞上清液中AFP蛋白表达水平降低了85.590%,为(33.930±11.690) ng/ml,差异有统计学意义(P<0.01)(表1)。上述结果表明,AFP siRNA能够显著抑制HCC HepG2细胞中AFP的表达。
2.3 沉默AFP基因能够抑制HepG2细胞的迁移和侵袭能力 迁移实验结果显示,与空白对照组相比,AFP siRNA组在Transwell小室的穿膜细胞数下降(P<0.01)(表1)。侵袭实验结果显示,与空白对照组相比,AFP siRNA干预组细胞在Transwell小室实验中的穿膜细胞数下降(P<0.01)(表1)。结果表明,沉默AFP后,细胞的迁移、侵袭能力均被明显抑制(图2)。

表1 沉默AFP在mRNA、蛋白水平表达以及肝癌HepG2细胞穿膜细胞率的变化
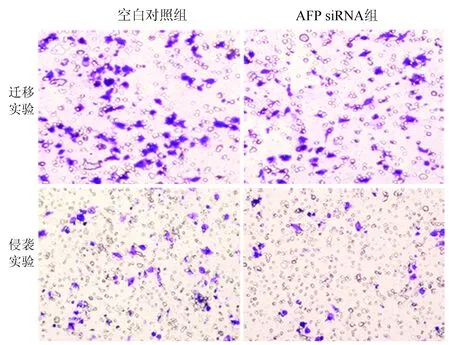
图2 沉默AFP对肝癌HepG2细胞纵向迁移和侵袭能力的影响
2.4 沉默AFP基因对HepG2细胞上皮-间质转化(EMT)相关蛋白的影响 Western blotting实验发现,各组肝癌HepG2细胞在处理48 h后,与空白对照组相比,AFP siRNA组Vimentin和N-cadherin的蛋白的表达明显降低(P值均<0.05),而E-cadherin的表达水平升高(P<0.01)(图3,表2)。
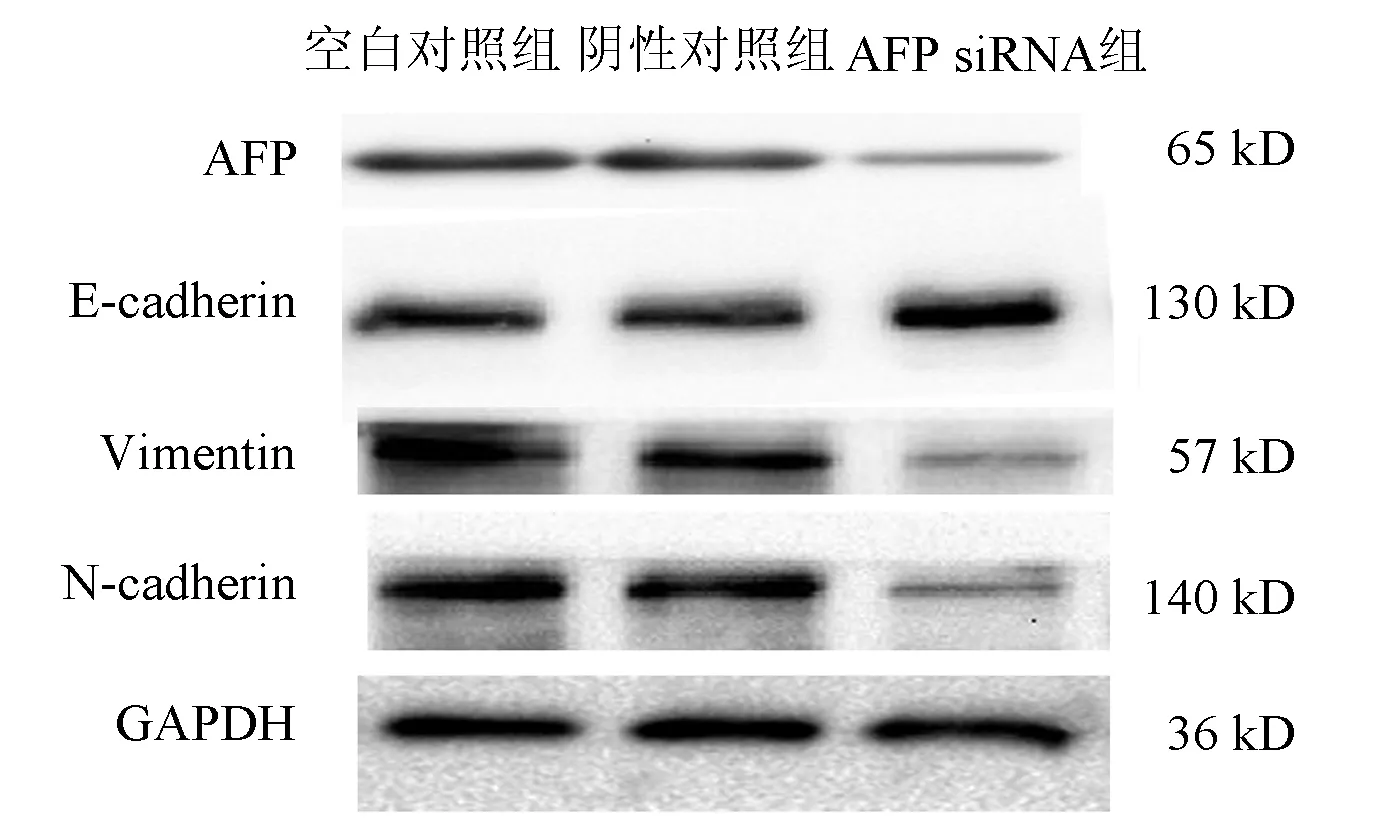
图3 Western blotting法检测各组细胞中AFP及EMT相关
2.5 沉默AFP基因对肝癌HepG2细胞PI3K/AKT信号通路的影响 HepG2细胞在AFP siRNA组转染48 h后,与空白对照组相比,AFP siRNA组细胞中PI3K/AKT信号通路相关蛋白p-AKT的表达被明显抑制(P<0.01)(表2,图4)。
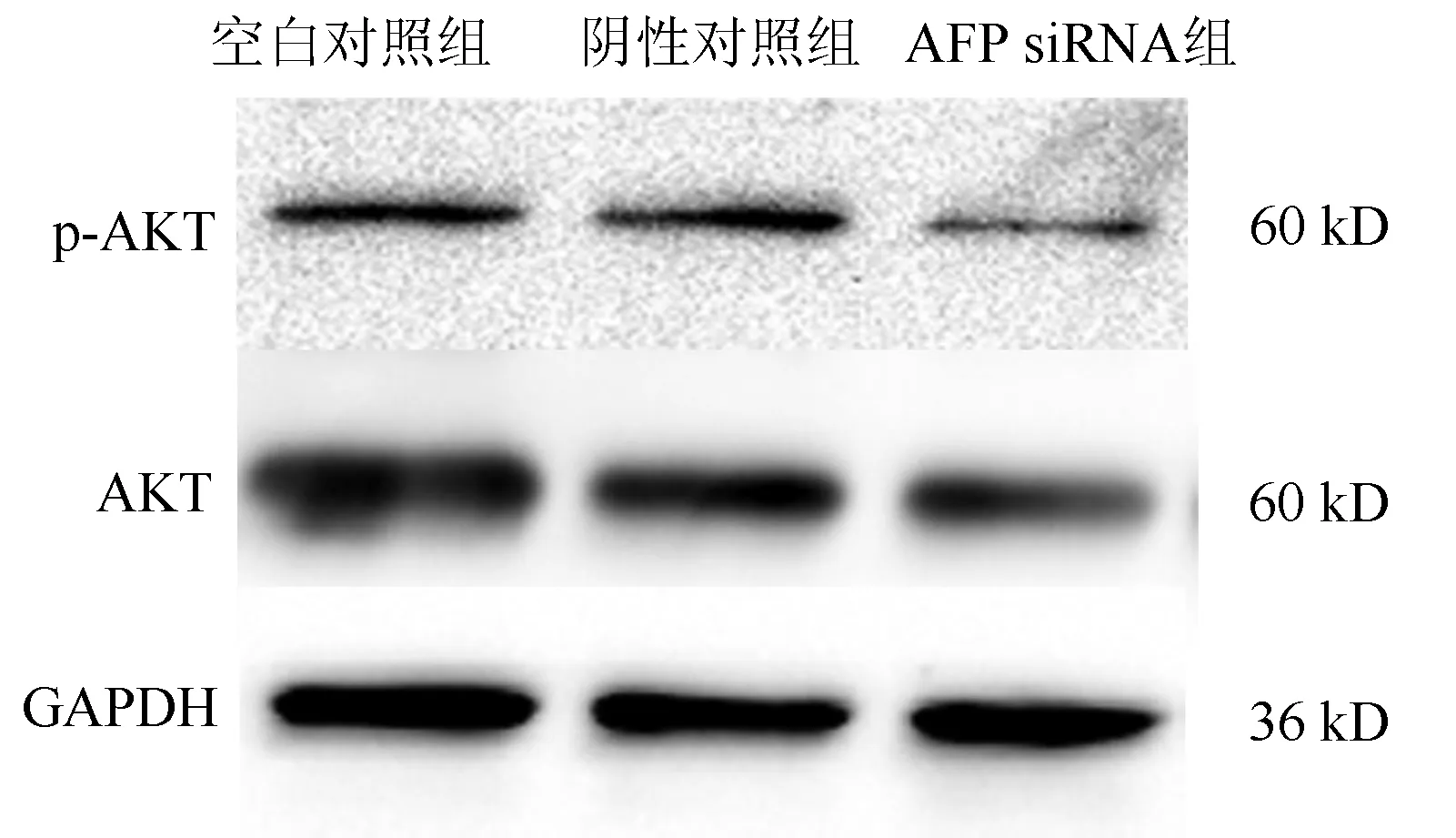
图4 AKT和p-AKT在蛋白水平的表达
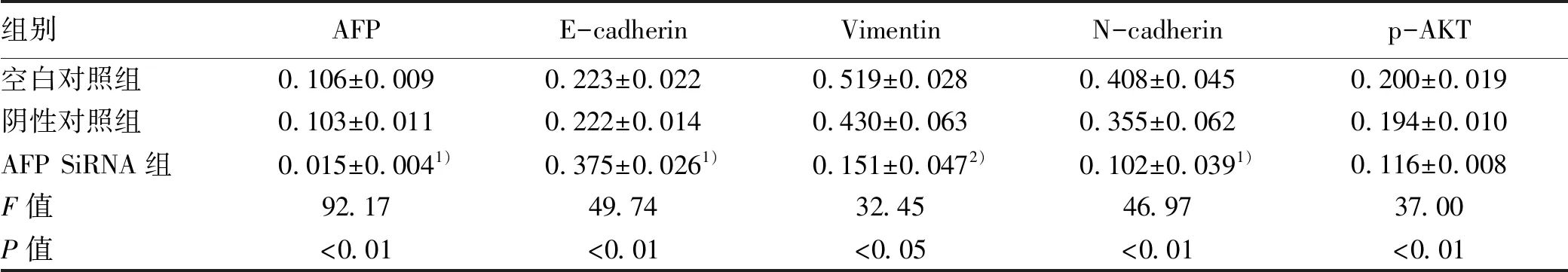
表2 各组细胞AFP、N-cadherin、Vimentin、E-cadherin、p-AKT蛋白相对表达量统计分析
3 讨论
AFP作为一种诊断HCC的重要的血清学标志物[7],研究[8-9]表明其与肝癌的复发和转移密切相关。AFP被报道同时参与了细胞内重要的病理生理过程,例如肿瘤发生、分化及生长等[10]。此外,AFP可以通过PI3K/AKT、p53/Bax/cytochrome c/caspase-3和JAK2/STAT3等转导途径抑制细胞增殖并诱导肝癌细胞凋亡[6,11-13],说明AFP也参与到细胞分化和肿瘤发生等过程[14]。因此,AFP不但是一种肝癌伴随的肿瘤相关抗原,而且在其发生、发展和转移中也起着重要的作用。然而,AFP在肿瘤侵袭、转移中的确切作用和机制尚不清楚。在本研究中,初步通过在HepG2细胞株中使用 siRNA进行转染来沉默AFP基因,能使AFP的表达显著降低,继而观察到细胞的迁移及侵袭性显著下降。此外,抑制AFP的表达后表现出EMT相关蛋白的表达变化。
肿瘤细胞的转移是一种涉及多个基因的复杂过程,向外周侵袭是促成转移的关键步骤[14]。EMT在促成肿瘤细胞侵袭和转移的过程中发挥了重要作用,包括细胞黏附素的丧失,细胞骨架成分的丧失、基因表达和细胞外基质的改变[15-16],其中N-cadherin和Vimentin被认为是最为关键的分子之一,已被发现可诱导HCC发生转移[17]。E-cadherin的表达降低、Vimentin和N-cadherin的表达升高是EMT加速肿瘤细胞侵袭和转移的关键步骤[18]。本研究中,用AFP siRNA转染人肝细胞细胞系HepG2可导致E-cadherin的上调和Vimentin、N-cadherin蛋白的降低,从而抑制EMT的过程。
在肿瘤的发生和转移相关的信号通路中,PI3K/Akt信号通路被认为是细胞内重要的信号转导相关通路[19-20],在肝癌中可观察到该通路的异常活化[21]。研究[22]表明,抑制PI3K/Akt信号通路会降低N-cadherin、Vimentin的表达,增加EMT中上皮标志物E-cadherin的表达,并与肿瘤侵袭转移过程的EMT相互影响。然而,AFP是如何通过肝癌中的PI3K/Akt信号通路调控肿瘤侵袭的机制尚未见报道。通过沉默AFP的表达,本研究发现p-Akt的表达受到抑制,从而导致PI3K/Akt信号通路的中断,这表明沉默AFP可能通过阻断PI3K/Akt通路抑制EMT的过程,进而抑制肝癌的侵袭过程。目前常用的肝癌细胞株较多,本研究仅在最为常用的人HepG2细胞中进行了实验,限于不同细胞株的特性,其他肝癌细胞内的变化情况尚需进一步研究论证。
综上所述,AFP在肝癌的侵袭和转移中起着关键性的作用。沉默AFP可能通过阻断PI3K/Akt通路抑制HepG2细胞EMT的过程,进而抑制肿瘤细胞迁移和转移的能力。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:韩伟负责课题设计,基础实验,资料分析,撰写论文;魏丰贤参与基础实验,修改论文;张有成负责拟定课题设计和写作思路,指导撰写文章并最后定稿。

