基于网络药理学探析5种经典方剂治疗肝细胞癌的作用机制
程秋骆, 刘 柳, 白长川, 丛庆伟, 朱 英
1 大连医科大学附属第一医院 中西医结合肝病中心, 辽宁 大连 116011; 2 大连医科大学 中西医结合学院,辽宁 大连 116044; 3 大连市中医医院 中医科, 辽宁 大连 116013
肝癌是世界主要高发癌症,70%~90%的病理类型为肝细胞癌(HCC)[1],是癌症导致死亡的第二大常见原因[2]。大多数HCC患者在临床Ⅲ或Ⅳ期才被诊断,而中晚期肝癌除索拉非尼、免疫检测点治疗以及经动脉化疗栓塞外的可用治疗手段非常稀少[3-5]。目前,HCC患者中位总生存期为9个月,5年生存率约为10%[6]。
为了寻找新的治疗方案以及改善患者生活质量,中医药在癌症中的运用越来越得到重视。中医药具有多组分、多靶点和协同作用的特征[7]。网络药理学是将中医药和现代医学结合起来的一个重要桥梁,从整体角度揭示药物作用机制,具有完整性、协同作用和动态特征,将单一靶点,单一药物转变为多靶点,多组分模式[8],与中医整体理论相吻合[9]。
中医认为肝癌属于“肥气、痞气、积气、肝积、鼓胀、黄疸”范畴,多由于脏腑气血耗伤,情志内伤,脾虚湿盛,痰湿结聚,使全身气机失调,邪毒由表入里,气、血、湿、热、痰、瘀互结而成。《原发性肝癌诊疗规范(2019年版)》[10]中将肝癌分为五大证型:肝郁脾虚、肝胆湿热、肝热血瘀、脾虚湿困、肝肾阴虚。其代表方剂分别为逍遥散合四君子汤(出自《太平惠民和剂局方》)、茵陈蒿汤(出自《伤寒论》)、龙胆泻肝汤(出自《医方集解》)、下瘀血汤(出自《金匮要略》)、五皮饮(出自《证治准绳》)、一贯煎(出自《续名医类案》)。基于此,本研究拟对5种方剂进行网络药理及分子对接筛选出相应的活性成分以及活性靶点。
1 材料与方法
1.1 中药活性成分筛选及药物靶点预测 汇总5种方剂中各单味药的标准中药名称在TCMSP(http://ibts.hkbu.edu.hk/LSP/tcmsp.php)、TCMID (http://www.megabionet.org/tcmid)、BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm)、TCM-MESH(http://mesh.tcm.microbioinformatics.org)数据库以及相关研究文献搜索出的全部化学成分,根据药代动力学参数:口服生物利用度≥30%和类药性指数≥0.18筛选出符合条件的候选活性成分。以活性成分全称为检索词在Pubchem (https://pubchem.ncbi.nlm.nih.gov/)数据库中检索其Carcinoma Smiles号,然后将其导入Swiss Target Prediction(http://www.swisstargetprediction.ch/)数据库对活性成分靶点进行预测。
1.2 肝癌疾病靶点预测 以“Liver cancer” 为关键词在TTD(https://db.idrblab.org/ttd)、Drugbank(https://www.drugbank.ca)、Disgenet(http://www.disgenet.org/web/DisGeNET/menu/home)、Liverome(http://liverome.kobic.re.kr/index.php)、OncoDB.HCC(http://oncodb.hcc.ibms.sinica.edu.tw/index.htm)数据库检索,在GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库筛选出同时含有肝癌组织和正常组织的人源基因芯片,文件编号:GSE121248、GSE58208,使用GEO2R在线分析,以adj.P.Val<0.05 为条件,筛选出肝癌组织与正常组织的差异基因。
1.3 构建“活性成分-作用靶点”网络 通过Venny绘图软件,将肝癌疾病靶点与活性成分靶点进行映射,从而获得5种辨证方剂治疗肝癌的潜在作用靶点。将5种方剂的活性成分以及其治疗肝癌的潜在作用靶点分别导入Cytoscape3.7.1软件中,节点代表5种方剂中活性成分以及治疗肝癌潜在靶点;边展现了5种方剂活性成分与作用靶点之间的联系。运用Cytoscape软件中 “Network Analyzer” 功能对5种方剂的活性成分-作用靶点网络分别进行分析,选取连接度较高的活性成分作为关键活性成分,根据连接度调节网络中的相应节点大小、颜色的深浅和排序。
1.4 PPI网络构建及Hub基因筛选 为了明确5种方剂中成分预测靶点与肝癌作用靶点之间的相互作用,将映射后的共同靶基因上传至STRING在线网络平台(https://string-db.org/),设置蛋白种类为“人”,设置置信度>0.9,从而获得蛋白互作关系,将结果导入Cytoscape 3.7.1软件中,并使用软件中“Cytohubber”的“Degree”功能筛选出度值排名前5的Hub基因。
1.5 Hub基因生存分析 将筛选出的Hub基因在GEPIA在线网站(http://gepia.cancer-pku.cn/)上进行生存分析,得出结果P<0.05则提示该基因为肝癌的预后靶点,提示该基因与患者预后的关系。
1.6 核心活性成分与Hub基因分子对接验证 在Pubchem搜索核心活性成分,下载其3D分子结构,保存为sdf格式,再从PDB数据库下载关键蛋白的3D晶体结构,保存为PDB格式。将活性成分及关键蛋白的结构文件导入DockThor (https://dockthor.lncc.br/v2/)网站进行分子对接,从而验证网络药理学筛选结果,分子对接结合能越小表示蛋白和配体两者之间具有较好的结合活性。
1.7 GO生物学功能富集和KEGG基因通路分析 将治疗肝癌潜在基因信息导入DAVID数据库,然后选择生物学过程、分子功能、细胞组成、KEGG信号通路进行GO生物学功能富集分析以及KEGG通路分析,将与本疾病无关通路删除,选取P<0.05的前15条生物学过程以及前10条通路。
2 结果
2.1 5种经典方剂活性成分及靶点筛选结果 逍遥散合四君子汤活性成分共计110(单位:个,以下均如此),其中柴胡17,白芍8,当归2,薄荷9,生姜4,甘草66,茯苓9,白术2,人参5,活性成分靶点共计7426。茵陈蒿汤活性成分共计19,其中茵陈8,栀子5,大黄8,活性成分靶点共计1435。龙胆泻肝汤合下瘀血汤活性成分共计154,其中柴胡17,栀子5,桃仁12,大黄8,当归2,甘草66,木通5,泽泻6,车前子6,黄芩19,龙胆草8,土鳖虫4,生地黄6,活性成分靶点共计9544。五皮饮合四君子汤活性成分共计121,其中人参5,白术2,茯苓9,甘草66,陈皮5,桑白皮17,大腹皮1,茯苓皮3,生姜皮17,活性成分靶点共计6619。一贯煎活性成分共计51,其中北沙参13,枸杞31,川楝子9,当归6,生地黄6,麦冬3,活性成分靶点共计2427。
GEO数据库筛选出肝癌组织与正常组织的差异基因3422个,其他数据库筛选出655个肝癌疾病靶点,去除重复后筛选出肝癌疾病靶点共计4001个。5种经典方剂的成分靶点与肝癌疾病靶点的交集靶点分别为260、169、276、242、192个(图1)。
2.2 “活性成分-作用靶点”网络可视化分析 利用Cytoscape软件进行网络可视化是网络药理学分析的关键部分,选取平均自由度到最大自由度之间的节点构建“活性成分-作用靶点”网络,如附录1所示,图中圆形节点代表活性成分,菱形节点代表交集靶点,各个节点的大小代表Degree值的大小,各个节点的透明度根据Degree值的大小从低到高排列。如表1所示,前4种方剂取自由度>40的节点,一贯煎取自由度前5的节点,逍遥散合四君子汤各活性成分度值中位数为30,茵陈蒿汤各活性成分度值中位数为36, 龙胆泻肝汤合下瘀血汤各活性成分度值中位数为35,五皮饮合四君子汤各活性成分度值中位数为28,一贯煎中各活性成分度值中位数为18,总结后发现槲皮素是5种经典方剂的共同成分且对应度值大于其对应方剂中活性成分自由度中位数,异补骨脂黄酮和Kanzonol W是逍遥散合四君子汤、龙胆泻肝汤合下瘀血汤以及五皮饮合四君子汤的共同成分且度值大于其对应方剂中活性成分自由度中位数。
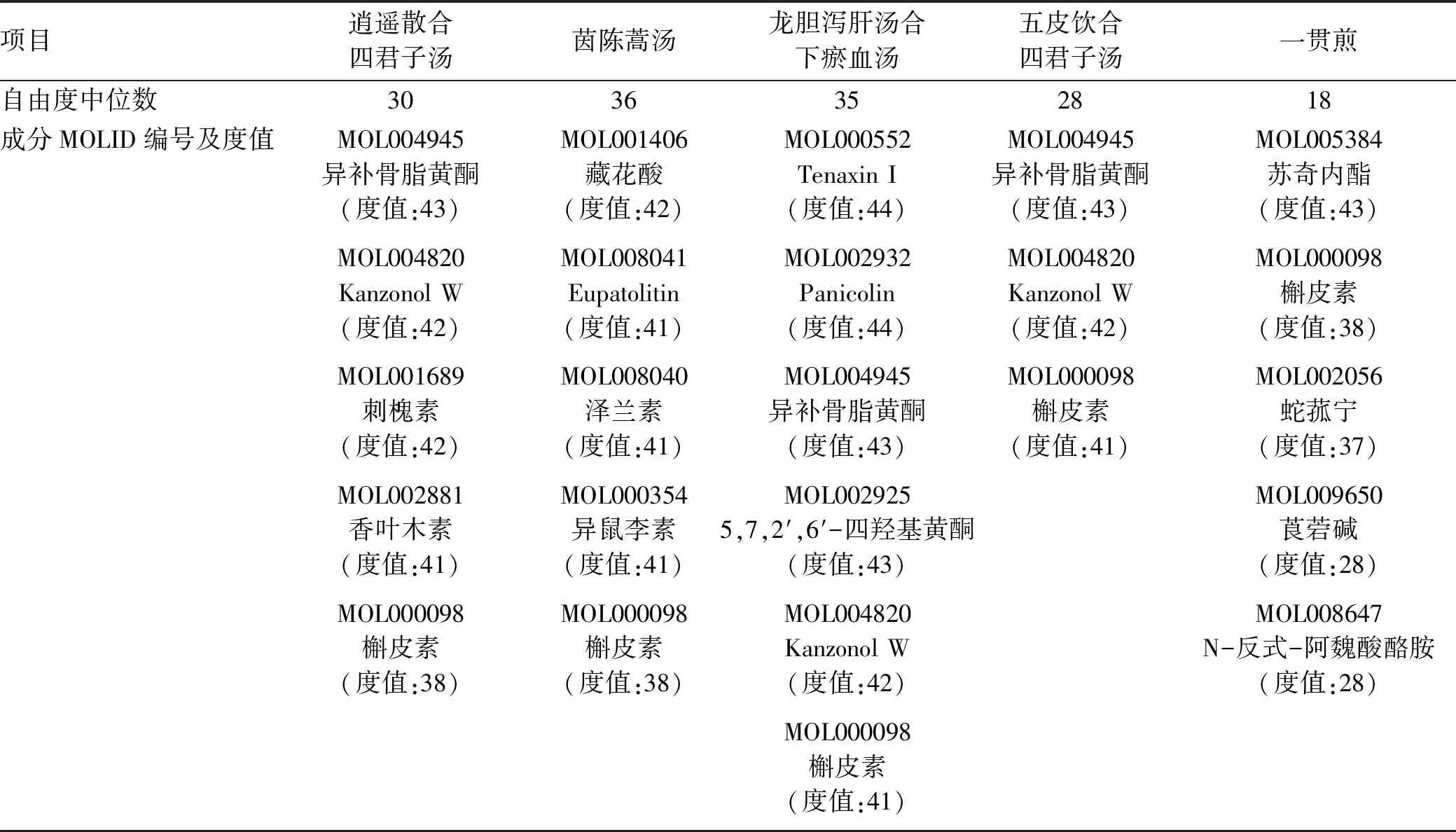
表1 5种经典方剂度值靠前成分及其MOLID编号


注:a,逍遥散合四君子汤;b,茵陈蒿汤;c,龙胆泻肝汤合下瘀血汤;d,五皮饮合四君子汤;e,一贯煎。
2.3 PPI网络及Hub基因筛选结果 通过PPI网络筛选出5种经典方剂治疗肝癌潜在的5个Hub基因,如附录2所示,绿色靶点分别代表5种经典方剂治疗肝癌潜在作用靶点,右侧5个靶点根据度值大小依次由深到浅从上向下排列。度值排名前5的基因分别为PIK3CA、SRC、AKT1、MAPK1、MAPK3,每个靶点具体度值见表2。

表2 5种经典方剂PPI网络中Hub基因度值
2.4 生存分析结果 通过GEPIA数据库的分析,由于AKT1的最终结果P>0.05,所以暂不将其视为肝癌的预后靶点,剩余4个靶点P值均<0.05,可视为肝癌预后靶点,降低其表达可改善患者的生存预后。另外,本课题组前期实验研究[11]发现LOXL2也是肝癌的调控靶点,且为SRC的上游基因,所以将LOXL2也加入其中,分析结果如图2所示。

图2 5个靶蛋白基因表达与肝癌预后关系
2.5 分子对接结果 5种经典方剂治疗肝癌的共同成分为槲皮素,其中3种方剂的共同成分为异补骨脂黄酮和Kanzonols W。其治疗肝癌潜在的Hub基因5个,其中有4个可暂定为肝癌预后靶点,加上LOXL2基因,共计5个靶蛋白与3种活性成分进行分子对接,如表3所示。图3显示Kanzonols W与SRC的结合能力最强,其次为槲皮素和异补骨脂黄酮。从总体趋势来看3种成分与PIK3CA、SRC、LOXL2结合能力相对较好。

表3 5种经典方剂关键活性成分与关键基因的分子对接结果

图3 5种方剂关键活性成分与关键靶点分子对接评分统计图
2.6 Hub基因参与的生物学功能及通路富集分析 5种经典方剂治疗肝癌的潜在靶点进行GO富集和KEGG通路分析结果如下:逍遥散合四君子汤GO结果806(单位:条,以下均如此),KEGG通路113;茵陈蒿汤GO结果554,KEGG通路106;龙胆泻肝汤合下瘀血汤GO结果826,KEGG通路120;五皮饮合四君子汤GO结果806,KEGG通路112;一贯煎GO结果720,KEGG通路109。对各结果的P值进行排序后选取GO结果前10条进行柱状图展示,包括生物进程、细胞组成以及分子功能,如图4所示。KEGG通路选取前15条进行气泡图展示如图5所示。深入分析5种方剂的结果,发现其共同参与的生物学过程是对药物的反应、蛋白质磷酸化、炎症反应、血管生成;细胞组成是胞质溶胶、细胞器、细胞质、蛋白质复合物;分子功能是蛋白激酶活性、蛋白质丝氨酸/苏氨酸激酶活性、ATP结合、蛋白质结合。共同调控的KEGG通路为癌症通路、PI3K-AKT通路、MAPK通路、乙型肝炎通路、丙型肝炎通路。
3 讨论
终末期肝癌在临床较为常见,经循证医学研究[12-15]发现该阶段中医证型多以血瘀证和肝肾阴虚证为主,所以本研究也从血瘀证和肝肾阴虚证为重点研究对象,对“活性成分-作用靶点”网络拓扑结构经行分析后发现槲皮素为5种方剂的共同活性成分,度值均大于节点的中位数,异补骨脂黄酮和Kanzonol W为肝郁脾虚、肝热血瘀、脾虚湿困代表方剂的共同有效成分且度值大于节点中位数,最终选择槲皮素、异补骨脂黄酮和Kanzonol W为重点研究成分。
槲皮素和异补骨脂黄酮属于常见的天然黄酮类化合物,两者均具有良好的抗肿瘤作用。其中槲皮素的生物学效应包括抗氧化、抗炎、抗增殖、抗血管生成的作用,也有着抗肿瘤的作用,其抗肿瘤作用机制包括调节PI3K/AKT/mTOR、Wnt/β-catenin、MAPK/ERK1/2途径来促使细胞活力丧失,促使细胞自噬能力以及诱导细胞凋亡[16-19]。槲皮素在体内外实验[20]中表明其有着良好的抑制HepG2肝癌细胞增殖以及促进其凋亡的作用。异补骨脂黄酮在抗肿瘤及免疫调节具有良好的作用且可以直接抑制SRC激酶的活性[21],且有实验研究[22]证实异补骨脂黄酮有抑制HepG2细胞增殖的作用。Kanzonol W是甘草的活性成分,有研究[23]证实该成分对HepG2细胞的增殖有抑制作用,但由于其提取工艺较为复杂,其研究实行相对困难。
本课题组前期研究[11]的重点基因LOXL2能促进肝癌细胞的侵袭、转移,对肝癌的发生发展有着较为重要的作用,所以将该基因纳入研究中。PIK3CA、SRC、MAPK1、MAPK3、LOXL2与肝癌预后不良有关,其高表达与肝癌患者的总体生存不良有关。将上述5个基因与槲皮素、异补骨脂黄酮、Kanzonol W分子对接总体趋势提示3种成分与PIK3CA、SRC、LOXL2结合能力相对较好。并且搜索5个靶蛋白相关文献后发现均与肝癌有相关性,从而提示该研究方法是科学可行的。
非受体酪氨酸蛋白激酶Src(proto-oncogene tyrosine-protein kinase Src, Src),其编码的蛋白归属于Src家族激酶(SFKs),研究[24]证实,人类SRC的基因产物C-Src通过调节肿瘤细胞的凋亡、增殖、侵袭、迁移与耐药性参与了肿瘤的恶性发展并促进了癌症的发生进展。赖氨酰氧化酶样2(lysyl oxidase-like 2,LOXL2)通过使FAK/SRC信号通路活化而介导上皮细胞间充质转化(epithelial-mesenchymal transition,EMT)[25],表明LOXL2在上皮细胞可塑性方面有着非常规的作用,通过EMT上皮细胞将获得较高的迁移与侵袭及抗凋亡作用,从而在恶性肿瘤的发生发展转移的病理过程发挥着至关重要的作用。就LOXL2基因而言,已经有研究证实其与HCC的不良预后具有相关性,其具体机制可能是通过该基因的过度表达从而增加SNAIL的表达,最终促使血管生成拟态形成和肿瘤的转移,而血管生成拟态是已知肝癌发生的3种微循环模式其中之一,是肿瘤微环境中血管生成的一种新形式,一般恶性程度较高且容易转移[26]。C-Src与受体激酶发挥协同作用,从而传导下游如PI3K/PTEN/Akt最终起到调节增殖、侵袭、转移和血管生成的作用。磷脂酰肌醇4,5-二磷酸3激酶催化亚基α亚型(Phosphatidylinositol 4, 5-bisphosphate 3-kinase catalytic subunit alpha isoform, PIK3CA)隶属于PI3K/AKT/mTOR通路,研究[27]证实该通路是肝癌发生的有效诱导因子且PIK3CA基因具有多态性,基因之间单独或协同作用可以增加肝癌发生的风险。因此,PIK3CA是SRC的下游因子,LOXL2通过激活FAK/SRC通路而介导EMT,3个基因之间存在一定的联系且都被证实与肝癌的发生发展具有相关性。此外,对5种经典方剂治疗肝癌的潜在基因KEGG富集分析可知代谢通路主要发生在PI3K-AKT、MAPK、Ras、HIF-1通路,这些通路与肝癌的发生及治疗密切相关,这些潜在基因还参与了乙型肝炎、丙型肝炎以及癌症通路。
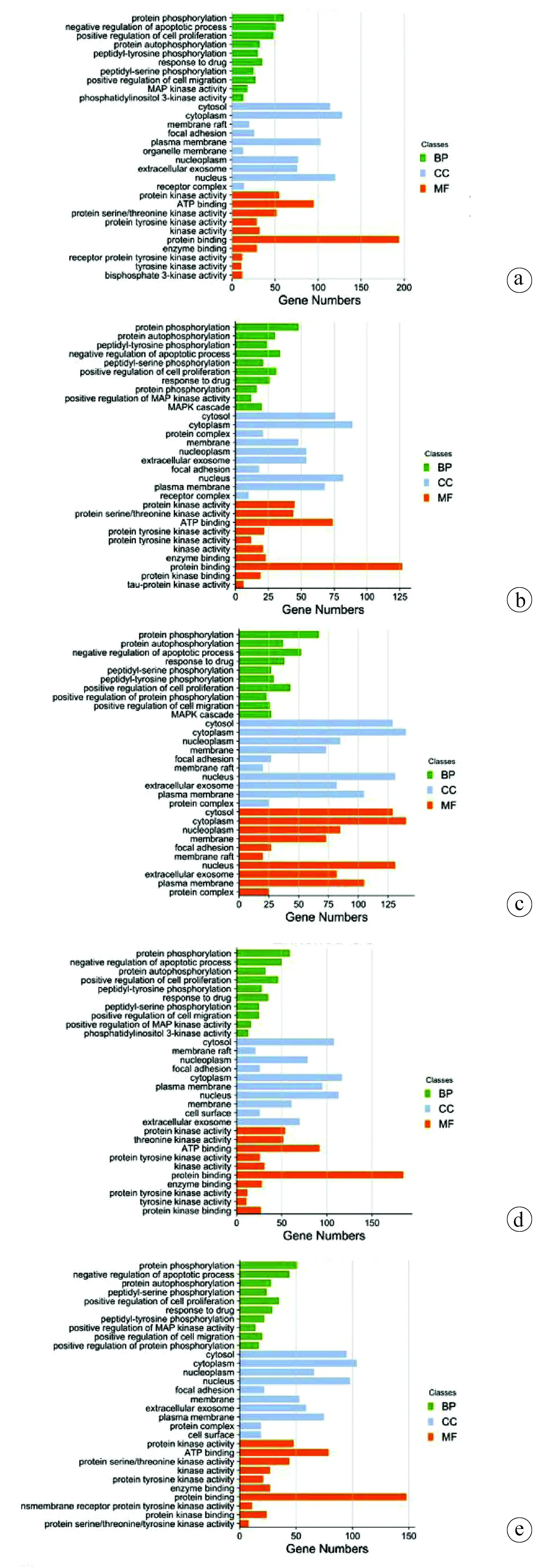
注:a,逍遥散合四君子汤;b,茵陈蒿汤;c,龙胆泻肝汤合下瘀血汤;d,五皮饮合四君子汤;e,一贯煎。

注:a,逍遥散合四君子汤;b,茵陈蒿汤;c,龙胆泻肝汤合下瘀血汤;d,五皮饮合四君子汤;e,一贯煎。
综上所述,本文以5种经典方剂治疗肝癌的潜在作用靶点为对象,利用网络药理学技术分析了其关键活性成分、关键靶点及信号通路,并联合分子对接技术验证了相关成分与肝癌靶点的相互作用关系。初步揭示了槲皮素、异补骨脂黄酮、Kanzonl W可能涉及到多靶点、多通路、多过程协同的抗肝癌特点,为后续深入研究其抗肝癌作用机制提供了参考方向。
利益冲突声明:本文不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:程秋骆负责文章撰写,文献查找与整理,并撰写初稿;刘柳、丛庆伟参与文章网络药理学部分数据查找并检索相关文献;白长川负责中医思路部分指导;朱英负责拟定写作思路,指导撰写文章并最后定稿。

附录1~2见二维码

