CalliSpheres载药微球与传统经肝动脉化疗栓塞术治疗肝细胞癌效果和安全性比较的Meta分析
彭一晟, 何 攀, 朱 刚, 李昕楷, 谭顺德, 陈健飞, 凡 军, 罗 斌, 苏 松, 李 波, 杨小李
西南医科大学附属医院 a.普遍外科(肝胆), b.核医学与分子影像四川省重点实验室, c.四川省院士(专家)工作站, 四川 沪州 646000
肝细胞癌(HCC)是世界上第六大常见癌症,也是第三大癌症相关死亡原因[1]。大多数HCC患者确诊时已为中晚期,此时患者常伴有疾病的快速进展和较差的肝脏储备功能,仅不到20%的患者能获得根治性治疗的机会[2]。
经肝动脉化疗栓塞术(TACE)已成为HCC非手术治疗的首选方法[3]。该术式包括传统TACE(conventional transcatheter arterial chemoembolization,cTACE)和药物缓释微球TACE(drug eluting bead transarterial chemoembolization,DEB-TACE)。cTACE主要是依靠碘油联合化疗药物混合给药,尽管这种给药方式已被认为安全有效,但其本身也存在着一定的局限性,如:化疗药物的流失和肝脏毒性等[4]。DEB-TACE在cTACE的基础上发展而来,利用微球作为载药介质取代了碘油,微球对化疗药物具有更高的吸附能力,既达到局部栓塞,又可以在肿瘤局部、缓慢释放化疗药,并可减轻全身的毒副反应[5-6]。Namur等[7]研究提示阿霉素载药微球能持续释放药物长达1个月,同时增加靶病灶的暴露。CalliSpheres载药微球 (CalliSpheres microspheres, CSM)是我国独立研发的载药微球,可以装载带正电荷的药物,如阿霉素、表阿霉素和吡柔比星,具有良好的药物释放特性和良好的生物相容性,可维持化疗药物的局部浓度、降低全身药物不良反应的发生,在安全性及有效性方面有一定优势[8-9]。但是,目前并没有高级别循证医学研究证明CSM-TACE与cTACE相比具有优越性,其安全性和有效性仍存在争议。
本文通过比较CSM-TACE与cTACE 治疗HCC的安全性和有效性,来探讨CSM-TACE 的临床应用价值。
1 资料与方法
1.1 文献检索 系统的检索PubMed、Web Science、Cochrane Library、中国知网数据库、万方数据库和维普数据库,从建库至2020年10月关于CSM-TACE与cTACE在HCC中应用的临床对照研究。采用主题词与自由词结合检索,以[“DEB” OR “drugeluting” OR “drugeluting microsphere” OR “doxoruboicineluting”OR “CalliSpheres microspheres”] AND [“TACE” OR “transarterial chemoembolization” OR “CSM-TACE”] AND [“hepatocellular carcinoma”] OR [“adenocarcinoma” OR “carcinoma” OR “cancer” OR “tumour” OR “tumor”]为英文检索词,以[“原发性肝癌” OR “肝癌”] AND [“载药微球” OR “CalliSpheres” OR “DEB-TACE” OR “TACE”] AND [“肝动脉”AND “栓塞”AND“化疗”]为中文检索词进行检索。为了获得关于这方面的进一步研究,还审查了纳入文献的参考文献。
1.2 纳入与排除标准 纳入标准:(1)经临床或病理证实为HCC;(2)试验组使用CSM-TACE(CSM为苏州恒瑞迦俐生生物医药科技有限公司生产),对照组为cTACE;(3)至少报告1项下列结果的研究:总生存率、无进展生存率[10]、并发症(发热、腹痛、呕吐、栓塞后综合征、短暂性肝损伤、腹水、骨髓抑制、粒细胞减少)等;(4)研究设计以随机对照试验(RCT)或回顾性研究为主;(5)研究无语言限制。 排除标准:(1)无比较的相关研究;(2)个案报道、摘要、会议报告;(3)没有全文,同时从全文中不能提取有效数据的研究。
1.3 数据提取与质量评估 为避免偏倚,2位研究者独立进行文献检索、资料提取并进行质量评价。如有分歧则通过讨论或征求第3位研究者协助解决。提取的数据包括:第一作者、发表年份、样本量、Child-Pugh分期、BCLC分期和肿瘤大小。分析指标包括:总生存率、无进展生存率、并发症等。大部分原始数据均是直接从研究中提取,部分总生存率、无进展生存率数据通过曲线提取,使用Parmar提供的软件Engauge Digitizer(4.1版)进行分析[11]。
RCT研究的质量拟采用JADAD量表进行评估[12];非随机研究的质量评价拟采用改良的纽卡斯尔-渥太华量表(NOS),该量表最高评分为9分,如果分数>5分,表明该研究方法质量较高。
1.4 统计学方法 采用 RevMan 5.3 软件进行数据合并及处理。对研究中的连续性变量及二分类变量分别采用均数差(MD)及比值比(OR)为效应指标计算它们的合并值及95%CI。并用 Mantel-Haenszel检验法对研究进行异质性检验,若I2≤50.0%,P≥0.05,表明各研究结果差异无统计学意义,则采用固定效应模型分析;若I2>50.0%,P<0.05,表明有统计学异质性,则采用随机效应模型分析;明显的临床异质性采用通过移除单项研究并重复Meta分析来评估。如果纳入研究数量超过10项,其潜在的发表偏倚根据主要结果漏斗图进行评估,如果图形具有良好的对称性,则表明无发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 纳入文献情况 初步检索文献共952篇,其中英文数据库共检索出628篇,中文数据库共检索出324篇,按照纳入标准及排除标准筛选后,最终纳入符合标准的相关文献15篇[9-10,13-25],其中英文文献8篇,中文文献7篇,累计样本量1535例。文献筛选流程图见图1。纳入文献的基本特征及质量学评价见表1。
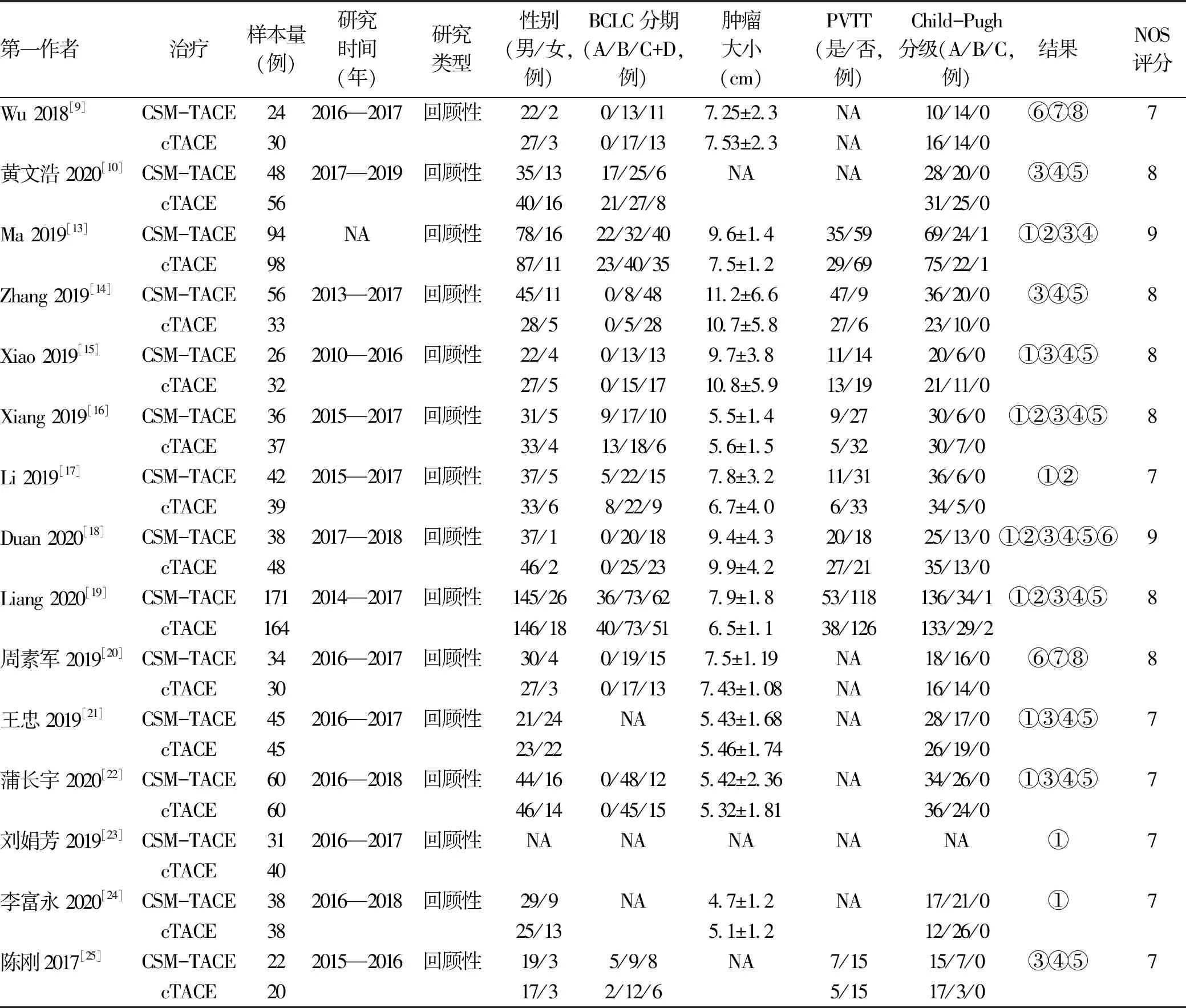
表1 纳入文献的基本特征及质量评价
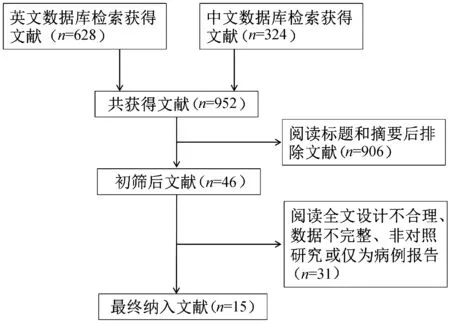
图1 文献检索流程图
2.2 总生存率比较 9篇文献[13,15-19,22-24]报道了1年总生存率,7篇文献[13,15-19,21]报道了2年总生存率,各研究间无明显异质性(I2<50.0%,P>0.05),均采用固定效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者1、2年总生存率显著高于cTACE治疗的患者(OR=2.26,95%CI:1.63~3.13,P<0.000 01;OR=1.73,95%CI:1.20~2.50,P=0.003) (图2)。
2.3 无进展生存率比较 5篇文献[13,16-19]报道了1年和2年无进展生存率,各研究间无明显异质性(I2<50.0%,P>0.05),均采用固定效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者1年无进展生存率与cTACE治疗的患者比较差异无统计学意义(OR=1.48,95%CI:0.97~2.26,P=0.07);CSM-TACE治疗的患者2年无进展生存率显著高于cTACE治疗的患者(OR=1.60,95%CI:1.05~2.43,P=0.03)(图3)。
2.4 术后发热率比较 10篇文献[10,13-16,18-19,21-22,25]报道了术后发热率,各研究间存在明显异质性(I2=65%,P<0.05),采用随机效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者术后发热率与cTACE治疗的患者比较差异无统计学意义(OR=0.87,95%CI:0.50~1.50,P=0.61)(图4)。
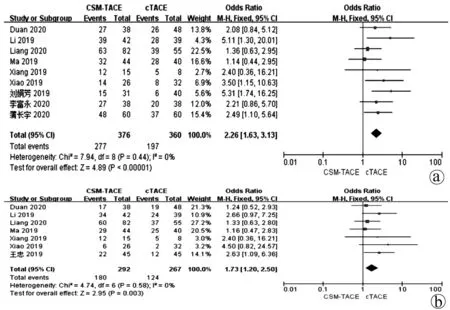
注:a,1年总生存率;b,2年总生存率。
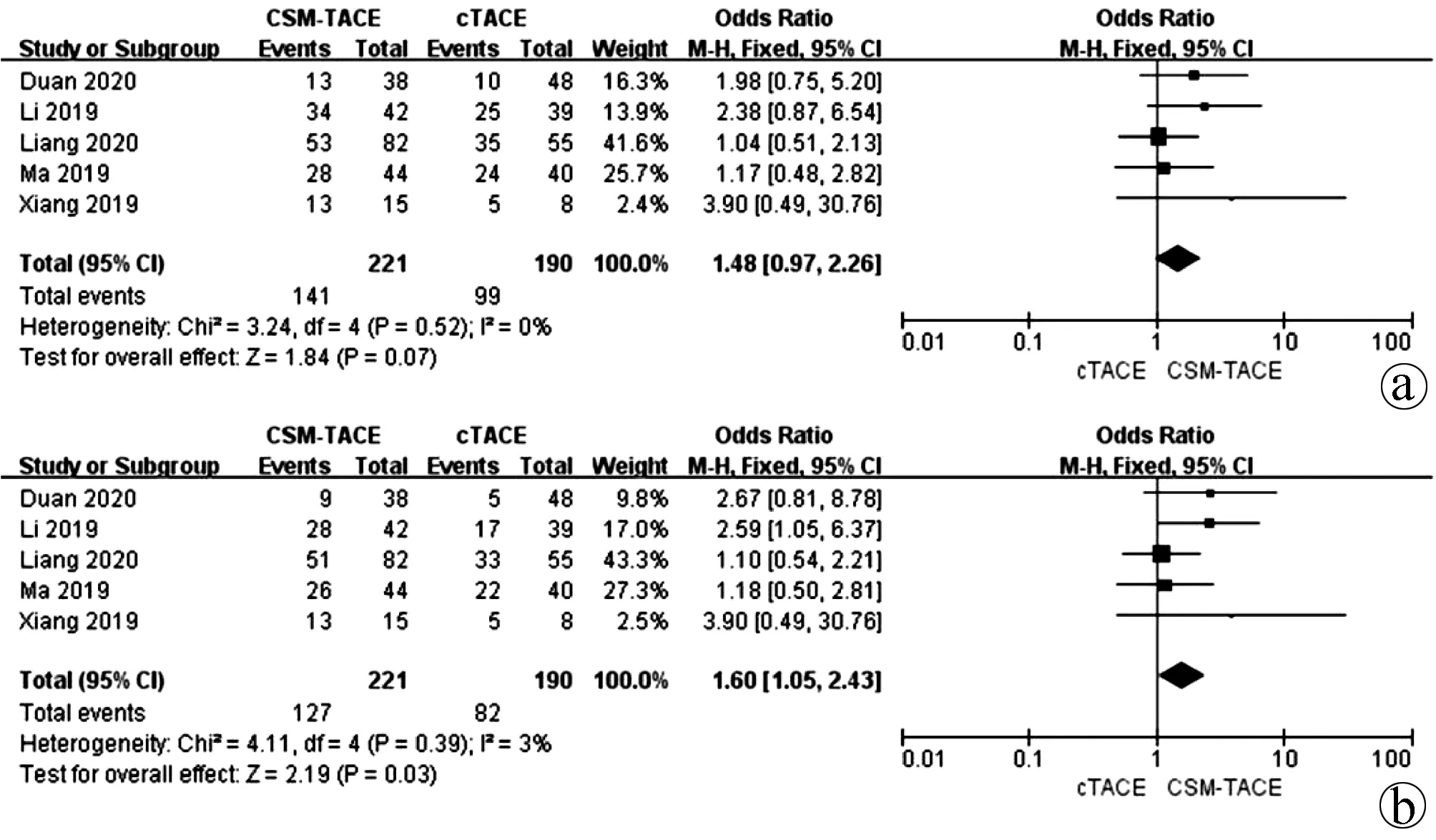
注:a,1年无进展生存率;b,2年无进展生存率。
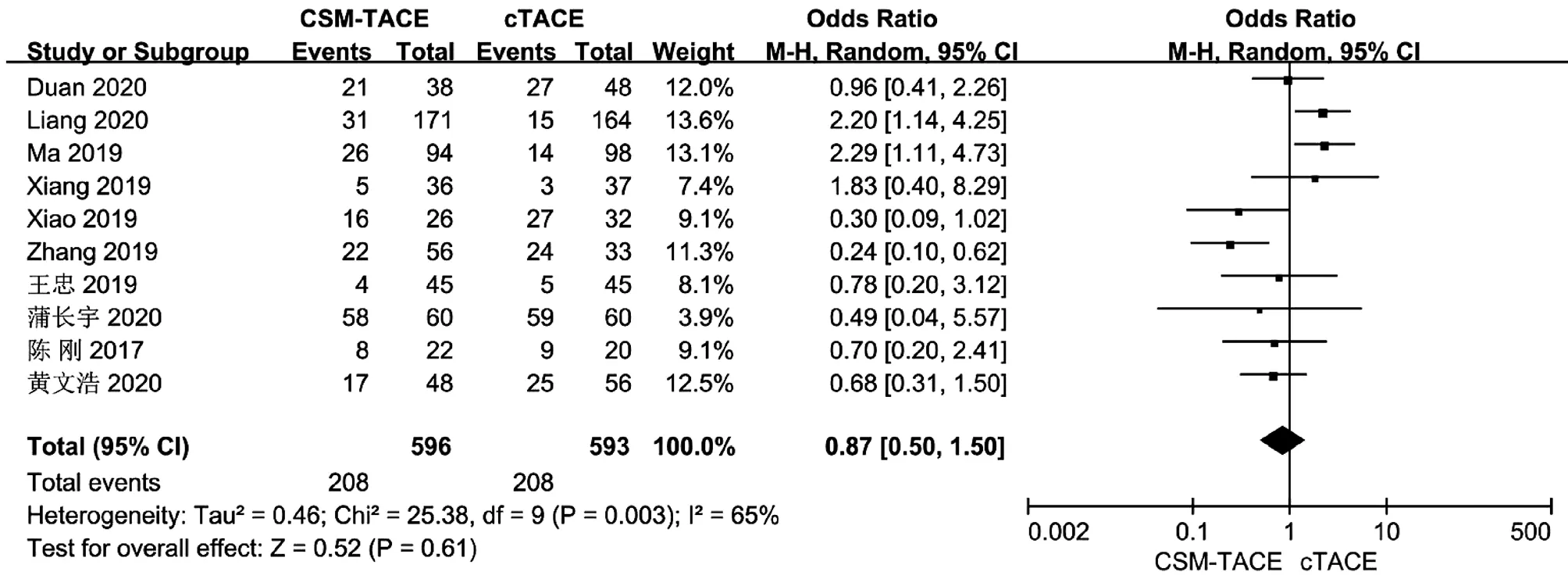
图4 2组术后发热率的Meta分析
2.5 术后腹痛率比较 10篇文献[10,13-16,18-19,21-22,25]报道了术后腹痛率,各研究间存在异质性(I2=53%,P<0.05),采用随机效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者术后腹痛率与cTACE治疗的患者比较差异无统计学意义(OR=0.90,95%CI:0.57~1.40,P=0.63)(图5)。
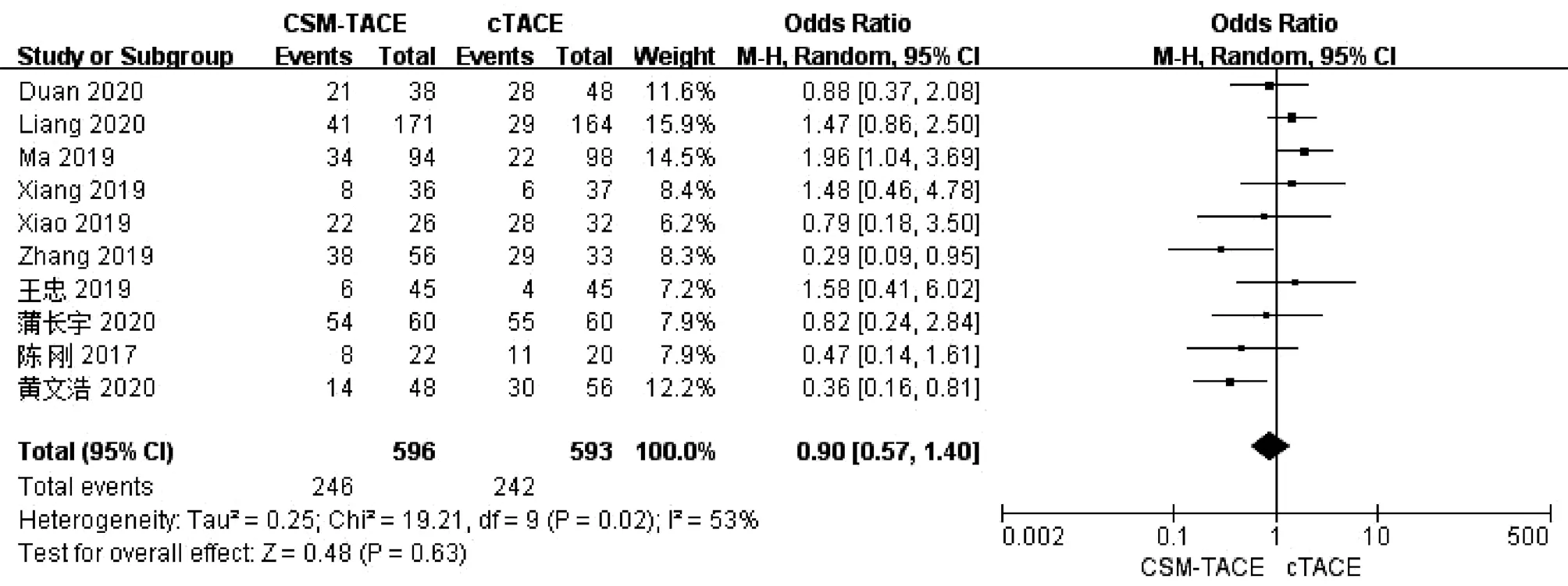
图5 2组术后腹痛率的Meta分析
2.6 术后呕吐率比较 9篇文献[10,14-16,18-19,21-22,25]报道了术后呕吐率,各研究间无明显异质性(I2=43%,P>0.05),采用固定效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者术后呕吐率显著低于cTACE治疗的患者(OR=0.65,95%CI:0.46~0.92,P=0.01)(图6)。
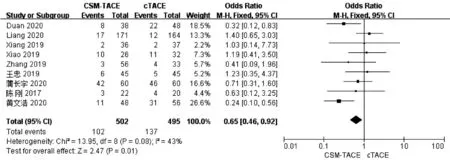
图6 2组术后呕吐率的Meta分析
2.7 术后腹水率比较 3篇文献[9,18,20]报道了术后腹水率,各研究间无明显异质性(I2=0,P>0.05),采用固定效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者术后腹水率较cTACE患者差异无统计学意义(OR=0.57,95%CI:0.30~1.09,P=0.09)(图7)。
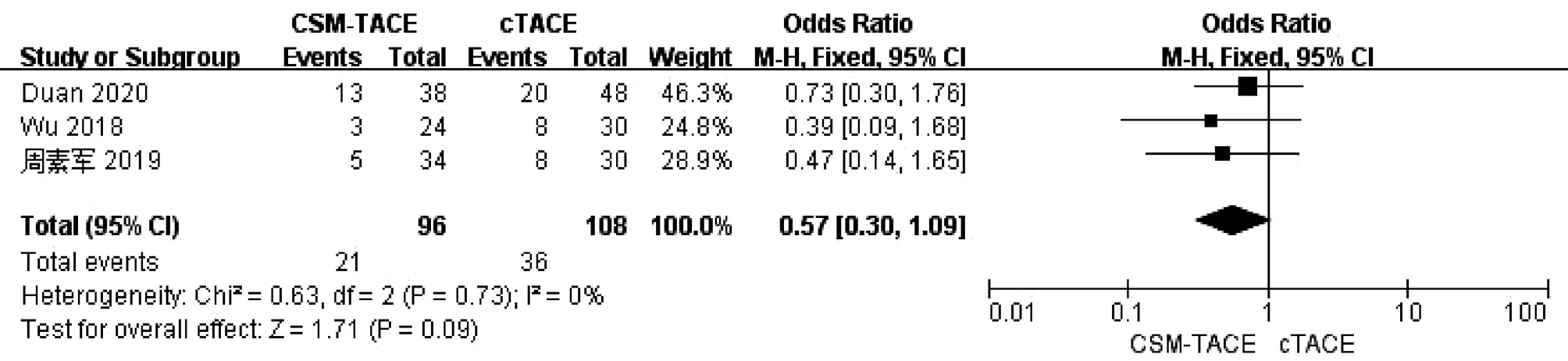
图7 2组术后腹水率的Meta分析
2.8 术后骨髓抑制比较 2篇文献[9,20]报道了术后骨髓抑制,各研究间无明显异质性(I2=0,P>0.05),采用固定效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者术后骨髓抑制显著低于cTACE治疗的患者(OR=0.17,95%CI:0.05~0.54,P=0.003)(图8)。
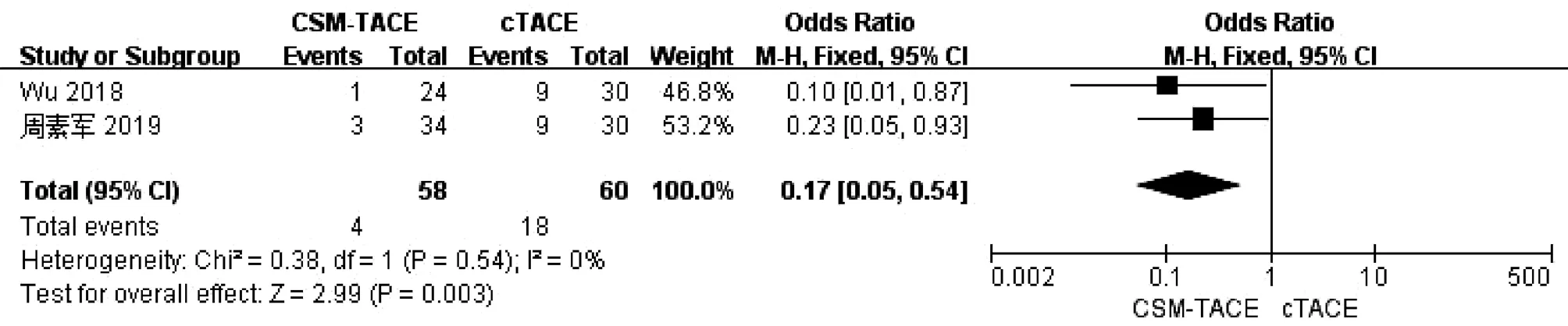
图8 2组术后骨髓抑制的Meta分析
2.9 术后粒细胞减少比较 2篇文献[9,20]报道了术后粒细胞减少,各研究间无明显异质性(I2=0,P>0.05),采用固定效应模型进行分析。Meta分析结果显示接受CSM-TACE治疗的患者术后粒细胞减少显著低于cTACE治疗的患者(OR=0.18,95%CI:0.07~0.45,P=0.000 3)(图9)。
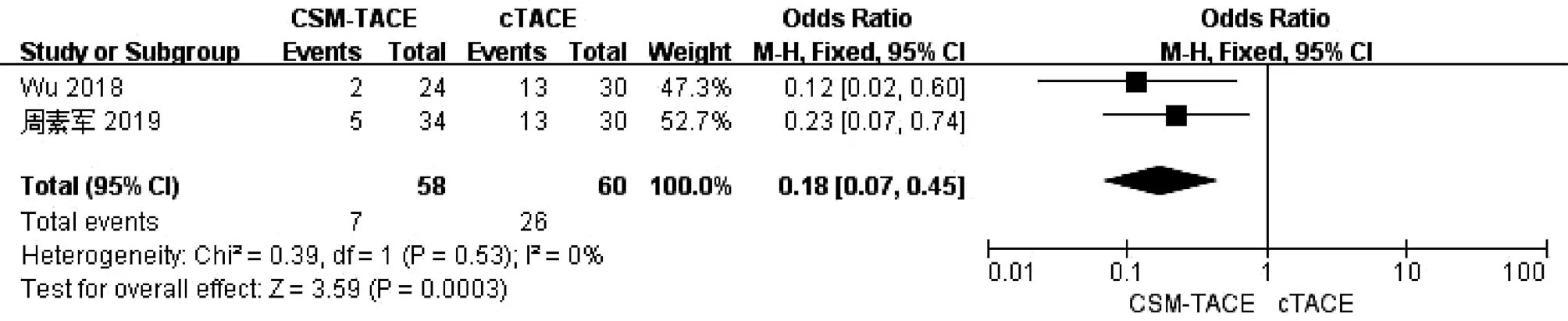
图9 2组术后粒细胞减少的Meta分析
2.10 敏感度分析及发表偏倚 根据术后腹痛率绘制漏斗图观察发表偏倚,图像两侧基本对称,表明该分析无明显发表偏倚(图10)。
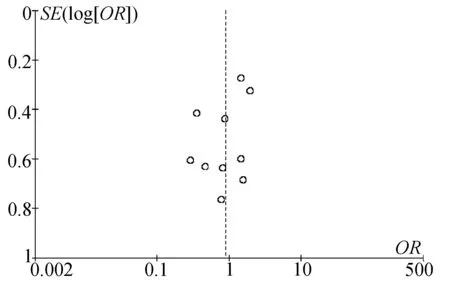
图10 发表偏倚分析
3 讨论
目前,治疗原发性肝癌的首选方法仍是外科手术切除,但其发病早期无明显症状,发现时多为中晚期,已失去手术切除的最佳时机。TACE是治疗晚期HCC最常用的方法之一[3,26]。cTACE栓塞剂是碘化油与化疗药物混合栓塞,而碘化油乳剂携带化疗药物可随血流进人全身循环系统,增加不良反应的发生率。近年来,DEB-TACE已被开发用于递送更高剂量的化学治疗药物并以可控和持续的方式释放[27]。DEB-TACE与cTACE相比,载有多柔比星的微球显著减少了药物到达全身循环所需的剂量,同时还能显著减少药物相关的不良事件[28-29]。然而,CSM作为我国自主研发的一种新型微球产品[8],在世界范围内尚未得到广泛应用。因此,CSM-TACE对HCC患者的有效性和安全性仍存在争议。
本Meta分析显示接受CSM-TACE治疗的患者1年和2年总生存率以及2年无进展生存率显著高于接受cTACE治疗的患者[18],尽管1年无进展生存率没有显著差异[19]。这一结果提示,CSM-TACE比cTACE更能提高患者的总生存率和无进展生存率,与既往Meta分析[29-30]的结果一致。因此,可以认为CSM-TACE是治疗HCC的有效方式。这说明CSM可以使化疗药物在肿瘤组织中维持更高的药物浓度以及延长与癌细胞的接触时间,其临床疗效更佳[9,31]。Li等[17]报道,CSM-TACE组的总生存率和无进展生存率显著高于cTACE组。这些研究结果表明与cTACE相比,CSM-TACE将是更有效的手术方式。
在安全性方面,接受CSM-TACE治疗的患者术后呕吐率、骨髓抑制率、粒细胞减少率均明显低于cTACE组。这可能与CSM的物理特性有关,良好生物相容性的网状球形微球,可缓慢、稳定释放药物,在保证栓塞效果的同时减少肝损伤和不良反应的发生,是较为理想的栓塞材料[32]。同时,由于进入全身血液循环的化疗药物减少,血浆药物浓度降低,因此全身副作用较少[33-34]。这与Lammer等[35]研究载药微球栓塞治疗的肝脏毒性低于cTACE是一致的。在术后发热率、腹痛率、腹水率方面CSM-TACE组与cTACE组未见明显差异。因此,CSM-TACE是一种安全的治疗方法。
本研究还存在一定局限性。首先,所有的文献均为来自中国的研究,这可能会影响结果的推断。其次,所有的纳入文献均为回顾性研究,文献的证据等级可能较RCT低。因此,需要更多的RCT研究来评估CSM-TACE的生存效益,并需要进行更多的长期随访。
综上所述, CSM-TACE治疗HCC是安全、可行的。相对于cTACE,CSM-TACE不仅提高患者1年和2年总生存率以及2年无进展生存率,而且降低患者术后呕吐率、骨髓抑制率、粒细胞减少率。作为我国自主研发的新型微球,未来还需要多中心大样本RCT来予以验证。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:彭一晟、何攀负责资料分析,撰写论文;朱刚、李昕楷、谭顺德、陈健飞参与收集数据,修改论文;凡军、罗斌、苏松负责拟定写作思路及数据分析;李波、杨小李负责课题设计,指导撰写文章并最后定稿。

