半夏野生品和栽培品中8种核苷类成分的含量测定方法建立及差异分析
张勇 李传峰 高桂花 马瑜 任强

中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2021)13-1583-06
DOI 10.6039/j.issn.1001-0408.2021.13.08
摘 要 目的:建立半夏野生品和栽培品中8种核苷类成分含量测定的方法,并进行两者的差异分析。方法:采用高效液相色谱法测定20批半夏药材(野生品YS1~YS8、栽培品ZP1~ZP12)中尿嘧啶、尿苷、肌苷、黄嘌呤、腺嘌呤、鸟苷、β-胸苷和腺苷的含量;以上述8种核苷类成分含量为基础,采用聚类分析、主成分分析(PCA)、偏最小二乘法-判别分析(OPLS-DA)等化学模式识别法对半夏野生品和栽培品进行综合评价。结果:20批半夏药材中尿嘧啶、黄嘌呤、尿苷、肌苷、腺嘌呤、鸟苷、β-胸苷和腺苷的含量分别为0.02~0.24、0.01~0.24、0.06~0.37、0.02~0.14、0.04~0.22、0.14~0.42、0.01~0.09、0~0.32 mg/g。经聚类分析、PCA和OPLS-DA发现,8批野生品(YS1~YS8)聚为一类,12批栽培品(ZP1~ZP12)聚为一类;半夏野生品的主要特征标志物为鸟苷、尿苷、腺苷、腺嘌呤,半夏栽培品的主要特征标志物为尿嘧啶、黄嘌呤、肌苷、β-胸苷。结论:建立了半夏药材中8种核苷类成分的含量测定方法;以核苷类成分为质量标志物可有效区分半夏野生品和栽培品,且野生品质量优于栽培品。
关键词 半夏;野生品;栽培品;核苷类;含量测定;化学模式识别法
Method Establishment for Content Determination of 8 Nucleosides in Wild and Cultivated Pinellia ternata and the Difference Analysis
ZHANG Yong,LI Chuanfeng,GAO Guihua,MA Yu,REN Qiang(School of Pharmacy, Jining Medical University, Shandong Rizhao 276826, China)
ABSTRACT OBJECTIVE: To establish the method for the content determination of 8 nucleosides in wild and cultivated Pinellia ternate, and to conduct the difference analysis. METHODS: The contents of uracil, uridine, inosine, xanthine, adenine, guanosine, β-thymidine and adenosine in 20 batches of P. ternate (wild product YS1-YS8, cultivated product ZP1-ZP12) were determined by HPLC method. Based on the contents of the above 8 nucleosides, cluster analysis, principal component analysis (PCA), partial least squares analysis (OPLS-DA) were used to comprehensively evaluate the wild and cultivated P. ternata. RESULTS: The contents of uracil, uridine, inosine, xanthine, adenine, guanosine, β-thymidine and adenosine in 20 batches of P. ternate were 0.02-0.24, 0.01-0.24, 0.06-0.37, 0.02-0.14, 0.04-0.22, 0.14-0.42, 0.01-0.09, 0-0.32 mg/g, respectively. Cluster analysis, PCA and OPLS-DA showed that 8 batches of wild P. ternate (YS1-YS8) were clustered into one category, and 12 batches of cultivated P. ternate (ZP1-ZP12) were clustered into one category. Main characteristic markers of wild P. ternate were guanosine, uridine, adenosine and adenine, while the main characteristic markers of cultivated P. ternate were urinine, xanthine, inosine, and β-thymidine. CONCLUSIONS: The method for the content determination of 8 nucleosides in P. ternate is established. Nucleosides as quality markers can effectively distinguish wild and cultivated P. ternata, and the quality of the wild P. ternate was better than that of cultivated P. ternate.
KEYWORDS Pinellia ternata; Wild product; Cultivated product; Nucleoside; Content determination; Chemical pattern recognition
半夏是天南星科多年生草本植物半夏Pinellia ternata(Thunb.)Breit.的干燥块茎,其性温味辛、有小毒,具有止咳、平喘、止吐、抗炎等多种药理作用[1-4]。目前,半夏主要分布在四川、甘肃、山东、贵州、湖南、湖北等地[5];其主要化学成分包括核苷类、生物碱类、有机酸类、甾醇类成分及挥发油等[6-10]。随着人类社会的不断拓展,野生半夏资源被无计划、掠夺性地采挖,造成野生半夏资源锐减,已经无法满足市场的大量需求,使栽培品种成为市场上主要商品[11]。由于栽培与野生环境不同,故半夏的块茎形态也出现了部分变异,甚至品质下降[12],造成其在临床上的超量使用[13]。因此,有必要對野生半夏及其栽培品进行区别。
有研究表明,核苷类成分是半夏 “降逆止呕”的主要物质基础[14-15],且其具有广泛的生理活性,是生物细胞维持生命活动的基本组成,参与 DNA 代谢过程,具有抗肿瘤、抗病毒、免疫调节、改善脑细胞代谢、镇静中枢神经、抗血小板凝集、抗心律失常和抗惊厥等多种生物活性[16]。在2020年版《中国药典》(一部)中,半夏并无含量测定相关的要求,仅对其中4种氨基酸(精氨酸、丙氨酸、缬氨酸、亮氨酸)进行薄层色谱鉴别[17];且笔者在前期预实验中发现,采用薄层色谱法并不能鉴别野生半夏及其栽培品。因此,考虑增加半夏中核苷类成分的含量测定项以更好地评价半夏的质量。但野生半夏和其栽培品是否可通过核苷类成分进行区分尚不明确。
化学模式识别法是化学计量学的重要组成部分,也是筛选中药质量标志物的重要数学方法,可划分为无监督的模式识别(包括聚类分析、主成分分析)和有监督的模式识别[偏最小二乘法-判别分析(OPLS-DA)][18]。基于此,笔者拟采用高效液相色谱法(HPLC)建立同时测定半夏中8种核苷酸类成分(尿嘧啶、尿苷、肌苷、黄嘌呤、腺嘌呤、鸟苷、β-胸苷和腺苷)的含量;并以上述8种核苷类成分的含量为基础,采用化学模式识别法分析野生半夏及其栽培品中核苷类成分差异,以期为野生半夏及其栽培品的质量控制提供参考。
1 材料
1.1 主要仪器
1260型 HPLC仪,配有G1329B自动控温自动进样器、G1312B二元泵、G1362A柱温箱、G1315D二极管阵列检测器(DAD)和Agilent OpenLAB CDS数据处理工作站,购自美国Agilent公司; BP121S型万分之一电子天平购自德国Sartorius公司;KQ-500DB 型数控超声波清洗器购自昆山市超声仪器有限公司;ST8R型离心机购自美国Thermo Fisher Scientific公司。
1.2 主要药品与试剂
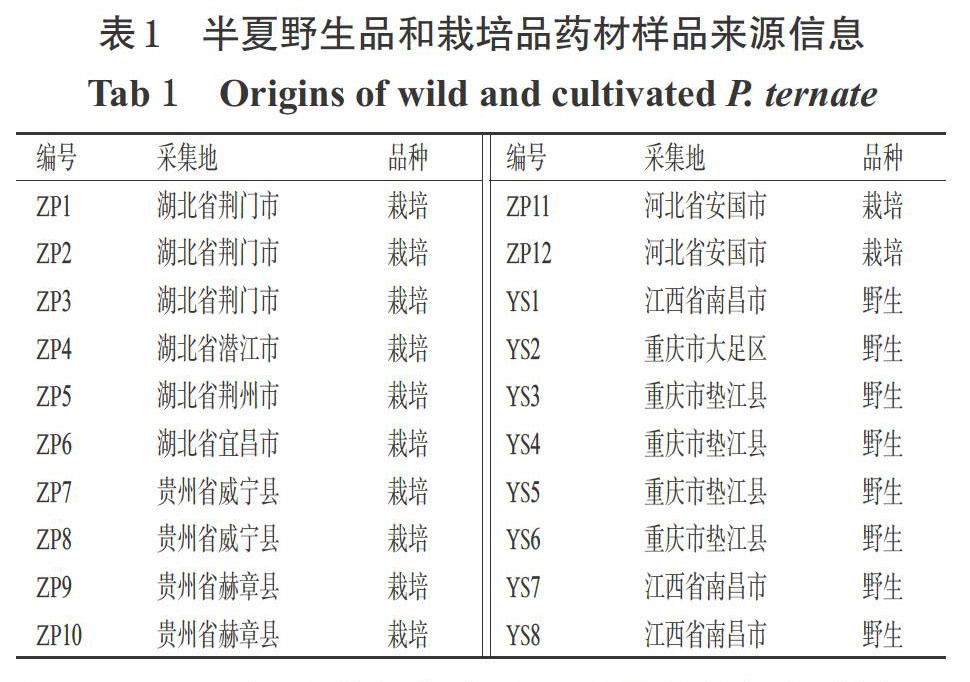
本研究所用半夏野生品和栽培品药材采自全国7个省或直辖市,由济宁医学院药学院王建安教授鉴定为天南星科植物半夏P. ternata(Thunb.)Breit.的干燥块茎(样品来源信息见表1);尿嘧啶对照品(批号C10668189,纯度99%)、尿苷对照品(批号C10633868,纯度99%)、肌苷对照品(批号C10443696,纯度98%)、黄嘌呤对照品(批号C10830281,纯度98%)、腺嘌呤对照品(批号C10492152,纯度98%)、鸟苷对照品(批号C10079911,纯度99%)、β-胸苷对照品(批号C10080693,纯度99%)和腺苷对照品(批号C10825934,纯度99%)均购自上海麦克林生化科技有限公司;其余试剂为实验室常用规格,甲醇为色谱纯,水为超纯水。
2 方法与结果
2.1 半夏野生品和栽培品药材中8种核苷类成分的含量测定
2.1.1 色谱条件 色谱柱为Phenomenex C18(150 mm×4.6 mm,3 μm);流动相为水(A)-甲醇(B)溶液,梯度洗脱(0~6 min,2%B;6~8 min,2%B→5%B;8~15 min,5%B→10%B;15~20 min,10%B→30%B;20~30 min,30%B→80%B;30~50 min,80%B;50~52 min,80%B→2%B);采用DAD,检测波长为265 nm;流速为1.0 mL/min;柱温为30 ℃;进样量为5 μL。
2.1.2 对照品溶液的制备 精密称取尿嘧啶、黄嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、β-胸苷、腺苷对照品适量,置于同一10 mL量瓶中,加水超声(功率200 W,频率50 kHz,下同)溶解后定容,制成上述8种成分质量浓度分别为101、100、99、101、99、100、99、98 μg/mL的混合对照品贮备液。精密量取上述混合对照品贮备液2 mL,置于10 mL量瓶中,加水稀释至刻度,即得混合对照品溶液。另分别取上述8种成分对照品适量,加水稀释制成质量浓度均为10 μg/mL的单一对照品溶液。
2.1.3 供试品溶液的制备 取半夏药材粉末(过60目筛)1 g,精密称定,加水10 mL,超声提取45 min,放冷,以4 500 r/min离心10 min,取上清液,经0.22 μm微孔滤膜滤过,即得。
2.1.4 专属性试验 分别精密吸取“2.1.2”项下混合对照品溶液和“2.1.3”项下供试品溶液(编号ZP8)各5 μL,按“2.1.1”项下色谱条件进样测定,记录色谱图。结果,尿嘧啶、尿苷、肌苷、黄嘌呤、腺嘌呤、鸟苷、β-胸苷和腺苷的色谱峰峰形均较好,且分离度均大于1.5,理论板数以黄嘌呤峰计不低于3 000,详见图1。
2.1.5 线性关系、定量限和检测限考察 分别精密吸取“2.1.2”项下混合对照品贮备液2、1、0.5、0.1、0.05 mL,置于10 mL量瓶中,加水稀释至刻度,混匀。分别精密吸取上述系列溶液适量,按“2.1.1”项下色谱条件进样分析,记录色谱图。以8种核苷类成分的质量浓度(x, μg/mL)为横坐标、峰面积(y)为纵坐标进行回归分析。另外,取“2.1.2”项下8种核苷类成分的单一对照品溶液,以水逐级稀释,再按“2.1.1”项下色谱条件进样分析,记录色谱图,以信噪比10 ∶ 1、3 ∶ 1分别计算定量限(LOQ)和检测限(LOD),结果见表2。
2.1.6 精密度试验 精密吸取“2.1.2”项下混合对照品溶液5 μL,按“2.1.1”项下色谱条件连续进样6次,记录峰面积。结果,尿嘧啶、黄嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、β-胸苷、腺苷峰面积的RSD分别为0.26%、0.31%、0.33%、0.10%、0.38%、0.39%、0.27%、0.10%(n=6),表明儀器精密度良好。
2.1.7 稳定性试验 精密称取同一批半夏药材粉末(编号ZP8,过60目筛),按“2.1.3”项下方法制备供试品溶液,于室温条件下放置0、3、6、9、12、24 h 后,按“2.1.1”项下色谱条件进样分析,记录峰面积。结果,尿嘧啶、黄嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、β-胸苷、腺苷峰面积的RSD 分别为1.3%、0.84%、0.91%、1.1%、1.2%、0.91%、0.88%、0.83%(n=6),表明供试品溶液在室温放置24 h内稳定性良好。
2.1.8 重复性试验 精密称取同一批半夏药材粉末(编号ZP8,过60目筛),共6份,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样分析,记录峰面积,并按外标法计算含量。结果,尿嘧啶、黄嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、β-胸苷和腺苷的平均含量分别为0.19、0.18、0.14、0.06、0.13 、0.17、0.05、0.16 mg/g,RSD分别为1.1%、1.3%、1.5%、0.86%、1.5%、1.3%、0.98%、1.1%(n=6),表明该方法重复性良好。
2.1.9 加样回收率试验 精密称取已知含量的半夏药材粉末(编号ZP8,过60目筛)6份,每份0.5 g,分别加入与样品中待测成分含量相当的尿嘧啶、黄嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、β-胸苷、腺苷的对照品,按照“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样分析,记录峰面积并计算加样回收率,结果见表3。
2.1.10 样品含量测定 取20批半夏药材,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下方法进样测定,采用外标法计算8种核苷类成分的含量。每批样品平行测定3份,取平均值,结果见表4。
2.2 化学模式识别分析
2.2.1 聚类分析 采用SPSS 25.0软件,将20批半夏药材中8种核苷类成分的含量作为变量,采用平方欧氏距离和组间联接法进行聚类分析,结果见图 2。由图2可知,当平方欧氏距离为25时,20 批样品聚为2类:样品ZP1~ZP12号聚为第一类,均为栽培品;样品YS1~YS8聚为第二类,均为野生品。由此说明,野生半夏和其栽培品中核苷类成分的含量存在明显差异。
2.2.2 主成分分析 采用 SPSS 25.0 软件建立20批半夏药材的8种核苷类成分的含量数据矩阵,经标准化后,采用SIMCA-P 14.1软件进行主成分分析,以特征值>1 为标准,得到2个主成分,累积方差贡献率为79.333%(表5),表明2个主成分能较好地解释原有变量所包含的信息;同时得到8种核苷类成分的主成分矩阵(表6)、主成分得分图(图3)和主成分载荷图(图4)。另以8种核苷类成分的含量作为变量,建立主成分分析模型,模型解释率R2X=0.765(该值大于0.5,说明建立的模型具有较高的预测准确率[19])。由表6可知,腺嘌呤、鸟苷和腺苷对主成分1具有较高的载荷,尿苷和β-胸苷对主成分2具有较高的载荷。由图3、图4可知,半夏野生品与栽培品各自聚为一类,说明不同生长条件的半夏中的核苷类成分含量存在明显差异;野生品中鸟苷、尿苷、腺苷、腺嘌呤为其主要的特征标志物,栽培品中β-胸苷、肌苷、黄嘌呤、尿嘧啶为其主要的特征标志物。
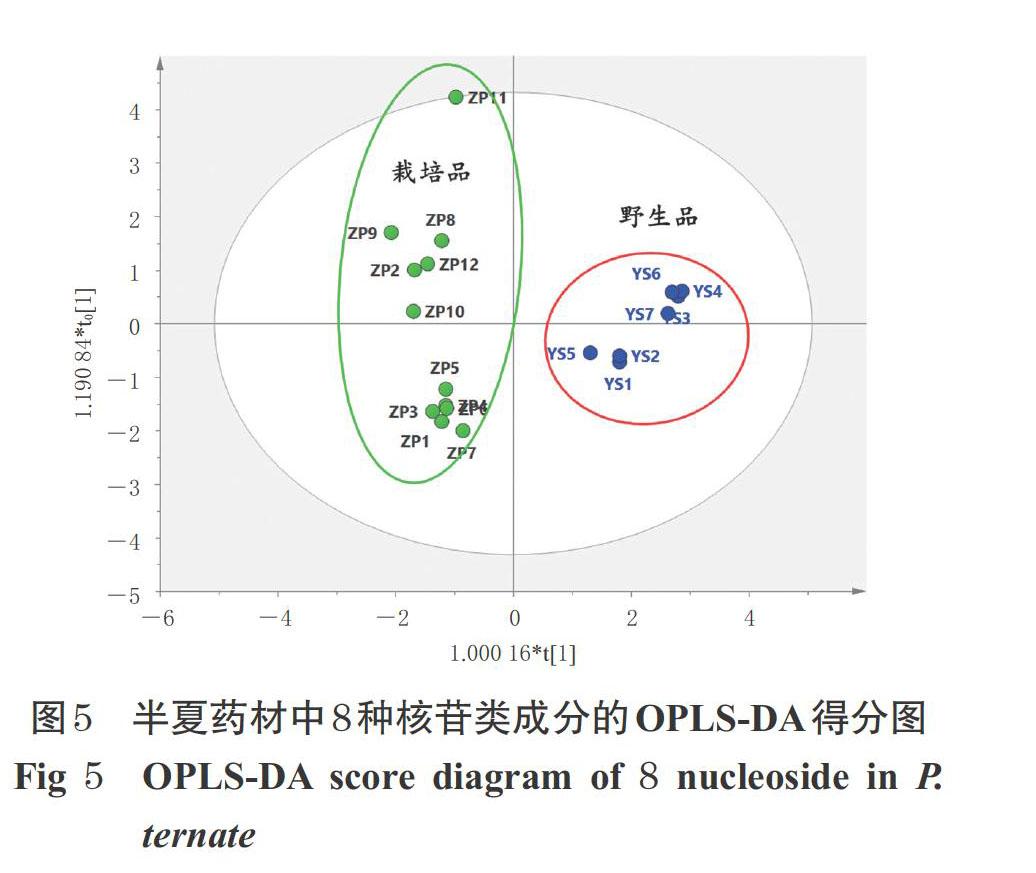
2.2.3 OPLS-DA分析 在主成分分析的基础上,将20批半夏药材中8种核苷类成分的含量数据导入SIMCA 14.1软件中,建立OPLS-DA模型(其得分图见图5)。结果显示,数据矩阵模型质量参数R2X=0.95、R2Y=0.94,模型预测参数Q2=0.87(其中,R2X表示概况X矩阵的结实率;R2Y表示模型的稳定性;Q2表示模型的预测性)。三者均大于0.5,且R2X和Q2之间差距小于0.2,说明所建模型具有较强的解释率和预测准确率[20-21],可用于区分半夏野生品和栽培品。
2.2.4 综合评价 参考文献[22]方法,将“2.2.2”项下所得的主成分得分系数与标准化后的数据相乘后求和,得到两个主成分的表达式F1、F2:F1=-0.189×Z1-0.197×Z2+0.140×Z3+0.176×Z4-0.154×Z5+0.180×Z6-0.090×Z7+0.171×Z8,F2=0.085×Z1+0.177×Z2+0.406×Z3+0.093×Z4+0.240×Z5+0.275×Z6+0.465×Z7+0.039×Z8(Z1~Z8表示8种核苷类成分含量经标准化后的数据)。以每个主成分所对应的特征值占提取主成分的特征值之和的比例作为权重,得到主成分综合模型:H=(57.131%×F1+22.202%×F2)/79.333%;然后,根据此综合模型计算20批半夏药材的主成分得分及综合得分,综合得分越高,表明药材质量越好[23],结果见表7。
由表7可知,从重庆市和江西省收集的半夏野生品的综合得分排名前8位,表明该两地产野生半夏药材的质量较好;也由此说明,对半夏中核苷类成分的分析,能有效地评价其质量。
3 讨论
3.1 检测波长的选择
本课题组采用DAD对混合对照品溶液进行了全波长扫描,结果发现,半夏药材中8种核苷类成分的最大吸收波长均在265 nm附近,且在该波长下图谱的基线稳定、峰形较好,故选择265 nm作为本研究的检测波长。
3.2 色谱条件的考察
核苷类成分极性较强,均可在C18柱上采用低有机溶剂比例的流动相洗脱[24]。本课题组比较了甲醇-水、乙腈-水、甲醇-0.1%甲酸溶液等流动相对半夏药材中核苷类成分洗脱的影响,发现采用甲醇-水为流动相可达到良好的洗脱效果。本研究选择甲醇为有机相进一步优化梯度洗脱条件,使核苷类成分在25 min内全部洗脱,其他成分在50 min内洗脱完毕,且供试品溶液中各成分分离良好。
3.3 供试品溶液制备方法的考察
本课题组在前期预实验中选择水、甲醇、乙醇、甲醇-水、乙醇-水等作为核苷类成分的提取溶剂,结果发现,甲醇和乙醇很难将肌苷、鸟苷提取出来,但水对肌苷和鸟苷的提取效率较高。在提取方法的选择上,本课题组考察了回流提取法与超声提取法,结果发现,超声提取法的效率较高。后续本课题组又对影响超声提取效率的功率(300、400、500 W)、频率(30、40、50 kHz)、提取时间(30、45、60 min)等因素进行了考察,结果发现,选择超声功率500 W、频率40 kHz提取45 min可将半夏中的核苷类成分完全提取。
综上所述,本研究建立了一种同时测定半夏中8种核苷类成分含量的方法;经化学模式识别法分析后发现,以核苷类成分为质量标志物可有效区分半夏的野生品和栽培品,且野生品质量优于栽培品。
参考文献
[ 1 ] SHENG M M,JIA H K,ZHANG G Y,et al. Siderophore production by rhizosphere biological control bacteria brevibacillus brevis GZDF3 of Pinellia ternata and its antifungal effects on Candida albicans[J]. J Microbiol Biotechnol,2020,30(5):689-699.
[ 2 ] TANG D,YAN R,SUN Y,et al. Material basis,effect,and mechanism of ethanol extract of Pinellia ternata tubers on oxidative stress-induced cell senescence[J]. Phytomedicine,2020,77:153275-153285.
[ 3 ] LEE M Y,SHIN I S,JEON W Y,et al. Pinellia ternate Breitenbach attenuates ovalbumin-induced allergic airway inflammation and mucus secretion in a murine model of asthma[J]. Immunopharmacol Immunotoxicol,2013,35(3):410-418.
[ 4 ] KURATA K,TAI T,YANG Y,et al. Quantitative analysis of anti-emetic principle in the tubers of Pinellia ternata by enzyme immunoassay[J]. Planta Med,1998,64(7):645- 648.
[ 5 ] JI X,HUANG B K,WANG G W,et al. The ethnobotanical,phytochemical and pharmacological profile of the genus Pinellia[J]. Fitoterapia,2014,93:1-17.
[ 6 ] 王依明,王秋紅.半夏的化学成分、药理作用及毒性研究进展[J].中国药房,2020,31(21):2676-2682.
[ 7 ] 崔美娜,钟凌云,张大永,等.中药半夏复制法炮制的研究进展[J].中国中药杂志,2020,45(6):1304-1310.
[ 8 ] IWASA M,IWASAKI T,ONO T,et al. Chemical composition and major odor-active compounds of essential oil from Pinellia tuber (dried rhizome of Pinellia ternata) as crude drug[J]. J Oleo Sci,2014,63(2):127-135.
[ 9 ] 翟兴英,张凌,李冰涛,等.采用UPLC-Q-TOF-MS/MS分析半夏药材中的化学成分[J].中国实验方剂学杂志,2019,25(7):173-183.
[10] 杨冰月,敬勇,赖月月,等. HPLC法同时测定半夏中5个代表性成分的含量[J].药物分析杂志,2019,39(11):1992-1997.
[11] 王彩琴,杜娟,王一敏,等.甘肃半夏资源及研究现况[J].西部中医,2015,28(3):22-24.
[12] 王化东,吴发明.我国半夏资源调查研究[J].安徽农业科学,2012,40(1):150-151.
[13] 叶巧旦,李伟平,谢蔚鹏,等.半夏资源问题的探讨及超药典剂量现象分析[J].中国药师,2014,17(12):2133-2135.
[14] 郝鹏飞,吴琼,张超云,等.超高效液相-质谱联用测定不同产地半夏中10种成分含量及质控指标筛选[J].中国医院药学杂志,2021,41(1):46-51.
[15] 曹国琼,游珊丽,徐剑,等.化风丹药母指纹图谱的建立及不同发酵时间样品中7种核苷类成分的含量测定[J].中国药房,2021,32(2):158-163.
[16] 黄鲛,易进海,刘玉红,等.天南星、半夏、白附子中8种核苷成分的含量测定[J].中国实验方剂学杂志,2013,19(16):59-62.
[17] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:123-125.
[18] 李士敏,李强,孙崇鲁,等.基于多模式识别结合指纹图谱的三叶青产地鉴别比较研究[J].中草药,2020,51(1):197-203.
[19] 梁苍宇,刘小康,葛威,等.基于指纹图谱与化学计量法的淡竹叶药材质量评价研究[J].中药材,2021,44(2):384- 387.
[20] 李園,李秀丽,王淑,等.不同淫羊藿羊脂油烘制品的HPLC指纹图谱建立、多元统计分析及烘制工艺优化[J].中国药房,2020,31(12):1480-1486.
[21] 许莉,黄晓婧,高鹏,等.基于多组分含量测定和化学计量学的风寒感冒颗粒整体质量评价研究[J].中草药,2020,51(14):3670-3678.
[22] 江华娟,李敏敏,何瑶,等.基于HPLC指纹图谱和化学模式识别的经典名方桃红四物汤制备过程质量评价研究[J].中草药,2021,52(4):1000-1010.
[23] 杨玉莹,张丹丹,罗心遥,等.指纹图谱及多成分定量结合化学模式识别法评价不同产地青钱柳质量[J].中草药,2020,51(4):1082-1088.
[24] 王朋展,相美容,李灿,等. HPLC法同时测定不同来源半夏及其伪品中9种核苷类成分的含量[J].药物分析杂志,2017,37(2):212-218.
(收稿日期:2021-02-04 修回日期:2021-05-18)
(编辑:唐晓莲)

