红花黄色素对慢性阻塞性肺疾病模型大鼠肺功能的改善作用
包海蓝 特日格乐 其木格


中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2021)13-1578-05
DOI 10.6039/j.issn.1001-0408.2021.13.07
摘 要 目的:研究红花黄色素对慢性阻塞性肺疾病(COPD)模型大鼠肺功能的改善作用。方法:将SD大鼠随机分为对照组、模型组、阳性对照组(地塞米松,0.09 mg/kg)和红花黄色素低、中、高剂量组(5、10、20 mg/kg),对照组10只大鼠,其余组各11只大鼠。除对照组外,其余各组大鼠以注射脂多糖联合烟熏法复制COPD模型。造模成功后,对照组和模型组大鼠灌胃等体积生理盐水,给药组灌胃相应药物,每天1次,连续12周。末次给药后,采用酶联免疫吸附试验检测大鼠血清中肿瘤坏死因子α(TNF-α)、白细胞介素(IL-6)、IL-8水平;采用血气分析仪检测全血中血气指标[动脉氧分压(PaO2)、血氧饱和度(SaO2)、动脉二氧化碳分压(PaCO2)]水平;采用肺功能检测仪检测大鼠肺功能指标[肺活量(FVC)、1秒用力呼气量(FEV1)、FEV1/FVC、最大呼气量(PEF)、最大呼气时中期流速(MMEF)]水平;采用Western blot法检测大鼠肺组织中Toll样受体4(TLR4)、核因子κB(NF-κB)、NF-κB抑制蛋白(IκBα)表达水平;采用苏木精-伊红染色法观察大鼠肺组织的病理学形态变化。结果:与对照组比较,模型组大鼠血清中TNF-α、IL-6、IL-8水平,全血中PaCO2水平以及肺组织中TLR4、NF-κB蛋白表达水平均显著升高(P<0.01);全血中PaO2、SaO2水平,肺功能指标FVC、FEV1、FEV1/FVC、PEF、MMEF水平以及肺组织中IκBα蛋白表达水平均显著降低(P<0.01);肺组织上皮细胞出现明显的变性、坏死,细胞间质有明显的炎性浸润现象。与模型组比较,红花黄色素各剂量组大鼠血清中炎症因子水平、全血中血气指标水平、肺功能指标水平及肺组织中相关蛋白的表达水平(低剂量组的IκBα除外)均显著逆转(P<0.05或P<0.01);肺组织上皮细胞坏死、脱落、炎性浸润等情况均不同程度地改善。结论:红花黄色素能明显改善COPD模型大鼠的肺功能;其作用机制可能与抑制炎症因子表达,调控TLR4/NF-κB通路相关蛋白的表达有关。
关键词 红花黄色素;慢性阻塞性肺疾病;炎症因子;Toll样受体4;核因子κB
Improvement Effects of Safflower Yellow on Lung Function of Chronic Obstructive Pulmonary Disease Model Rats
BAO Hailan1,Terigele2,Qimuge3(1. School of College of Mongolian Medicine, Inner Mongolia University for Nationalities, Inner Mongolia Tongliao 028000, China; 2. Network Center, Inner Mongolia University for Nationalities, Inner Mongolia Tongliao 028000, China; 3. Dept. of Mongolian Respiratory Medicine, the Affiliated Hospital of Inner Mongolia University for Nationalities, Inner Mongolia Tongliao 028000, China)
ABSTRACT OBJECTIVE: To study the improvement effects of safflower yellow on lung function in chronic obstructive pulmonary disease (COPD) model rats. METHODS: SD rats were randomly divided into control group, model group, positive control group (dexamethasone, 0.09 mg/kg), safflower yellow low-dose, medium-dose and high-dose groups (5, 10, 20 mg/kg), with 10 rats in control group and 11 rats in other groups. Except for control group, other groups were given lipopolysaccharide combined with fumigation to induce COPD model. After modeling, control group and model group were given constant volume of normal saline intragastrically, and administration groups were given relevant medicine intragastrically, once a day, for consecutive 12 weeks. After last medication, the levels of TNF-α, IL-6 and IL-8 were detected by ELISA. The levels of blood gas indexes (PaO2, SaO2 and PaCO2) in whole blood were detected by blood gas analyzer. The levels of lung function indexes (FVC, FEV1, FEV1/FVC, PEF and MMEF) were detected by lung function analyzer. The expression of TLR4, NF-κB and IκB-α protein were detected by Western blot. HE staining was used to observe the pathological changes of lung tissue. RESULTS: Compared with control group, the serum levels of TNF-α, IL-6 and IL-8, the level of PaCO2 in whole blood as well as the protein expression of TLR4 and NF-κB in lung tissue were increased significantly in model group (P<0.01); the levels of PaO2 and SaO2 in whole blood, the levels of lung function as FVC, FEV1, FEV1/FVC, PEF and MMEF as well as the protein expression of IκBα in lung tissue were decreased significantly (P<0.01); there were obvious degeneration and necrosis in the epithelial cells of lung tissue, and obvious inflammatory infiltration in the interstitial cells. Compared with model group, the levels of inflammatory factors in serum, blood gas indexes in whole blood and lung function indexes as well as the expression of related protein in lung tissue (except for IκBα in low-dose group) were reversed significantly in safflower yellow groups (P<0.05 or P<0.01); the necrosis, exfoliation and inflammatory infiltration of epithelial cells in lung tissue were improved in varying degrees. CONCLUSIONS: Safflower yellow can significantly improve the lung function of COPD model rats, and its mechanism may be related to inhibiting the expression of inflammatory factors and regulating the expression of TLR4/NF-κB pathway-related proteins.
KEYWORDS Safflower yellow; Chronic obstructive pulmonary disease; Inflammatory factors; TLR4; NF-κB
慢性阻塞性肺疾病(COPD)是一种具有气流阻塞特征的慢性支气管炎和(或)肺气肿,主要表现为进行性的肺功能衰退及慢性炎症反应[1-3],且随着其病程发展可能会导致动脉粥样硬化、静脉栓塞等多种并发症[4-6],极大程度地损害了患者的生命安全。因此,寻找能够有效治疗、改善COPD的用药方案具有重要的临床意义。近年来,随着中医药产业的发展壮大,中药在COPD方面的应用逐渐受到关注[7]。红花黄色素是从中药红花中提取的一种天然色素,属于查耳酮类化合物,具有降血压、保护心血管、抗氧化、抗炎、抗癌等多种药理作用[8-9]。研究发现,红花黄色素对COPD具有一定的治疗效果[10-12],但其作用机制尚不清楚。
气道内的炎症反应是COPD的重要发病机制。COPD患者气道内出现大量炎性细胞浸润,并产生大量肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-8等炎症因子,对患者气道造成损伤[13]。有研究发现,Toll样受体4(TLR4)的激活可刺激NF-κB炎症通路,引发一系列炎症反应[14];且已有研究证明,TLR4/NF-κB通路在COPD患者体内被激活,并参与了其炎症反应的发展进程[15]。基于此,本研究通过构建COPD大鼠模型,研究红花黄色素对COPD模型大鼠肺功能的改善作用及其对TLR4/NF-κB通路的影响,以期为COPD的临床治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有:ABL90型血气分析仪(上海雷杜米特医疗设备有限公司)、SCIREQ型小动物肺功能检测仪(北京广源达科技发展有限公司)、MR-96A型酶标仪(深圳迈瑞生物医疗电子股份有限公司)、KL01A型离心机(湖南凯达科学仪器有限公司)、FA2104型电子天平(上海恒平科学仪器有限公司)、DYCZ-40K型电泳仪(北京六一生物科技有限公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂包括:红花黄色素对照品(南京道斯夫生物科技有限公司,批号78281-02-4,纯度>98%),地塞米松片(广东华南药业集团有限公司,批号A14202002484,规格0.75 mg),脂多糖(美国Sigma公司,批号08168),TNF-α检测酶联免疫吸附(ELISA)检测试剂盒、IL-6 ELISA检测试剂盒、IL-8 ELISA检测试剂盒(南京建成生物科技有限公司,批号分别为H052 、H007、H008),BCA蛋白定量试剂盒(英国Abcam公司,批号ab102536),鼠源TLR4单克隆抗体、兔源NF-κB单克隆抗体、兔源核因子κB抑制蛋白(IκBα)单克隆抗体、鼠源β-actin单克隆抗体、山羊抗小鼠免疫球蛋白G(IgG)二抗、山羊抗兔IgG二抗(英国Abcam公司,批号分别为ab22048、ab32536、ab32518、 ab8226、 ab205719、 ab205718);其余试剂为实验室常用规格,水为纯净水 。
1.3 动物
本研究所用动物为成年雄性SD大鼠,SPF级,体质量(200±20) g,购自武汉大学实验动物中心,动物生产合格证号为 SCXK(鄂)2017-0004。 大鼠饲养于室温20~25 ℃、相对湿度50%~60%的动物房内,通风良好。大鼠自由进食饮水,适应性喂养1周后进行后续实验。
2 方法
2.1 分组、造模与给药
将大鼠分为对照组、模型组、地塞米松组(阳性对照,0.09 mg/kg,剂量参考文献[16]设置)和红花黄色素低、中、高剂量组(5、10、20 mg/kg,剂量参考文献[17]设置),除对照组10只大鼠外,其余组各11只大鼠。参考文献[18]方法,将除对照组之外的大鼠置于自制有机玻璃箱内,每日烟熏1 h,每次20支香烟,并于实验开始后第7、14、21天向其气管内注射脂多糖(1 mg/kg,注射当日不熏烟),持续8周,以复制COPD模型。造模结束后,除对照组外,其余各组分别取1只大鼠处死,剖取其肺组织,进行病理学变化观察。当大鼠肺组织呈明显的病理形态,且肺上皮细胞变性、坏死,细胞间隙伴有大量炎性细胞浸润时,表明造模成功。造模成功后,对照组和模型组大鼠灌胃等体积生理盐水,各给药组大鼠灌胃相应药物(临用时以生理盐水溶解),灌胃体积为10 mL/kg,每天1次,连续12天。
2.2 样本采集
末次给药后,各组大鼠腹腔注射2%戊巴比妥钠(30 mg/kg)进行麻醉,于腹腔主动脉取血适量,一部分经枸橼酸钠抗凝处理后直接保存,作为全血样品;一部分以3 000 r/min离心10 min,取上清液,作为血清样品。在测定肺功能指标水平后,处死各组大鼠,剖取其肺组织,一部分用于相关蛋白表达水平的检测,一部分进行病理学观察。
2.3 大鼠血清中炎症因子水平的测定
取“2.2”项下各组大鼠血清样品,按ELISA试剂盒说明书方法操作,采用酶标仪于450 nm波长下,测定血清中炎症因子TNF-α、IL-6、IL-8的水平。
2.4 大鼠全血中血气相关指标水平的测定
取“2.2”项下各组大鼠全血样品,使用血气分析仪检测相关血气相关指标[动脉氧分压(PaO2)、血氧饱和度(SaO2)、动脉二氧化碳分压(PaCO2)]的水平。
2.5 大鼠肺功能指标水平的测定
各组大鼠取血后,采取仰卧位将其放置于肺功能检测仪内,并进行气管插管,然后记录大鼠肺功能指标[肺活量(FVC)、1秒用力呼氣量(FEV1)、FEV1/FVC、最大呼气量(PEF)、最大呼气时中期流速(MMEF)]水平。
2.6 大鼠肺组织中TLR4/NF-κB通路相关蛋白表达水平的检测
采用Western blot法进行检测。取“2.2”项下各组大鼠肺组织,切取其右中叶部分的肺组织(距肺门3 mm处)适量,加入蛋白裂解液提取总蛋白,然后以12 000 r/min离心10 min,取上层蛋白液,以BCA蛋白定量试剂盒检测蛋白浓度。蛋白经变性处理后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE);转膜,以5%脱脂奶粉在室温的条件下封闭1 h;以TBST清洗5 min×3次,加入TLR4、NF-κB、IκBα、β-actin一抗(稀释度均为 1 ∶ 1 000),并于4 ℃条件下孵育过夜;以TBST清洗5 min×3次,加入相应二抗(稀释度均为1 ∶ 5 000),于室温条件下孵育1 h;以TBST清洗5 min×3次,加入ECL发光剂显色后,置于全自动凝胶成像系统中成像。采用Image Pro Plus 6.0软件分析图像,以目的蛋白与内参β-actin的灰度值的比值表示目的蛋白的表达水平。
2.7 大鼠肺组织的病理学形态观察
取“2.2”项下各组大鼠肺组织,于10%甲醛溶液中固定3 天后,经石蜡包埋、切片(5 μm),再进行苏木精-伊红(HE)染色,然后于显微镜下观察肺组织的病理学形态变化并拍照。
2.8 统计学分析
采用SPSS 20.0统计学软件对数据进行分析,首先采用方差齐性检验,将符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用LSD检验。P<0.05表示差异有统计学意义。
3 结果
3.1 红花黄色素对大鼠血清中炎症因子水平的影响
与对照组比较,模型组大鼠血清中TNF-α、IL-6、IL-8水平均显著升高(P<0.01);与模型组比较,地塞米松组和红花黄色素各剂量组大鼠血清中上述指标水平均显著降低(P<0.01),详见表1。
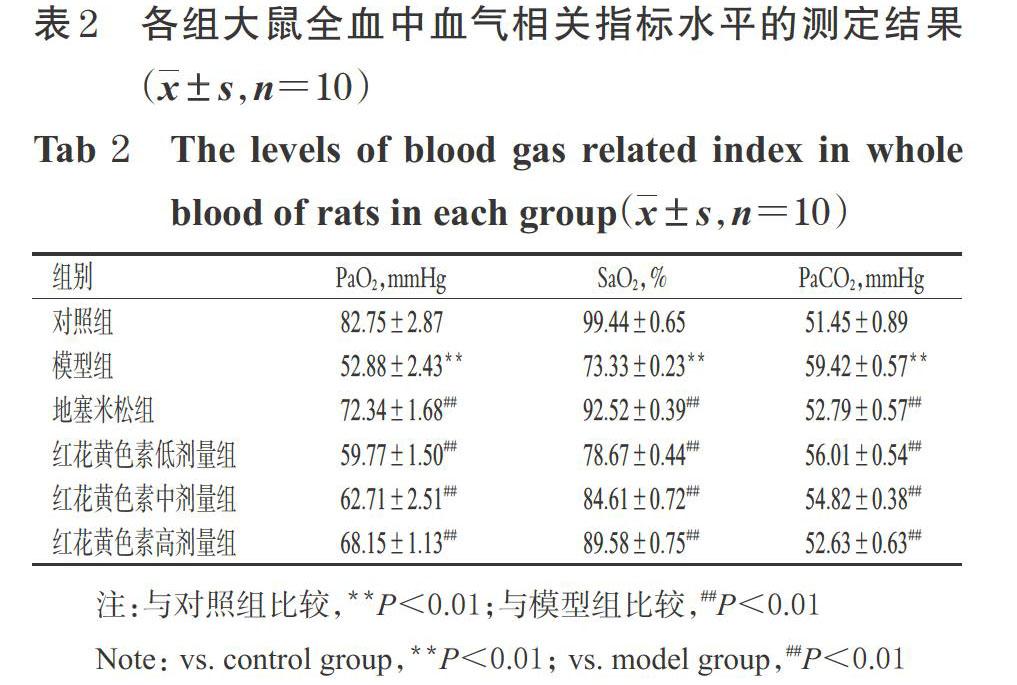
3.2 红花黄色素对大鼠全血中血气相关指标水平的影响
与对照组比较,模型组大鼠全血中PaO2、SaO2水平均显著降低(P<0.01),PaCO2水平显著升高(P<0.01);与模型组比较,地塞米松组和红花黄色素各剂量组大鼠的PaO2、SaO2水平均显著升高(P<0.01),PaCO2水平均显著降低(P<0.01),详见表2(表中,1 mmHg≈0.133 kPa)。
3.3 红花黄色素对大鼠肺功能指标水平的影响
与对照组比较,模型组大鼠FVC、FEV1、FEV1/FVC、PEF、MMEF水平均显著降低(P<0.01);与模型组比较,地塞米松组和红花黄色素各剂量组大鼠上述指标水平均显著升高(P<0.05或 P<0.01),详见表3。
3.4 红花黄色素对大鼠肺组织中TLR4/NF-κB通路相关蛋白表达水平的影响
与对照组比较,模型组大鼠肺组织中TLR4、NF-κB蛋白表达水平均显著升高(P<0.01),IκBα蛋白表达水平显著降低(P<0.01);与模型组比较,地塞米松组和红花黄色素各剂量组大鼠肺组织中TLR4、NF-κB蛋白表达水平均显著降低(P<0.01),IκBα(红花黄色素低剂量组除外)蛋白表达水平均显著升高(P<0.01),详见图1、表4。
3.5 红花黄色素对大鼠肺组织病理学形态的影响
对照组大鼠肺组织结构完整,上皮细胞未出现坏死、脱落,细胞间质未发现炎性浸润或组织增生等情况;模型组大鼠肺组织上皮细胞出现明显的细胞变性、坏死,细胞间质有明显的炎性浸润现象;地塞米松组和红花黄色素各剂量组大鼠肺组织上皮细胞坏死、脱落、炎性浸润等情况均不同程度地改善,详见图2。
4 讨论
COPD的发生与吸烟、过敏、感染等多种因素有关,但其具体发病机制尚不明确[4]。目前,大多数学者认为,可通过降低体内炎症反应来抑制COPD的发展[19]。宋丽娟等[20]研究发现,红花黄色素对急性肺损伤模型小鼠体内的炎症反应有明显的抑制作用,且能明显抑制小鼠体内TLR4基因及蛋白的表达。TLR4是一类天然免疫受体,是NF-κB通路的上游信号分子,TLR4被激活后可进一步激活NF-κB通路,进而激活该通路的下游靶蛋白,引起一系列炎症反应[14]。TNF-α、IL-6、IL-8均是常见的炎症因子,其在COPD患者体内的水平均显著升高,从而刺激气道释放黏液、促进炎症反应,进而加重肺组织损伤[13]。基于此,本研究拟探讨红花黄色素对COPD模型大鼠肺功能的改善作用及其对TLR4/NF-κB通路的影响。此外,因目前临床治疗COPD主要以地塞米松片为主,故本研究以其作为阳性对照药进行研究。
本研究发现,COPD模型大鼠血清中TNF-α、IL-6、IL-8水平均显著升高;全血中PaO2、SaO2及肺功能指标FVC、FEV1、FEV1/FVC、PEF、MMEF水平均显著降低,全血中PaCO2水平显著升高;肺组织中TLR4、NF-κB蛋白表达水平均显著升高,IκBα蛋白表达水平显著降低;大鼠肺组织出现明显病变及炎性浸润。这提示COPD模型大鼠体内TLR4/NF-κB炎症通路被激活,使大鼠体内炎症反应加剧,同时损伤了大鼠的肺组织。但经红花黄色素干预后显示,大鼠血清中上述炎症因子水平均显著降低,肺功能指标水平和肺组织病变情况均得到明显改善,且肺组织中TLR4、NF-κB蛋白表达水平均显著降低,IκBα(红花黄色素低剂量组除外)蛋白表达水平均显著升高。由此说明,红花黄色素可能通过抑制TLR4/NF-κB信号通路的表达,从而减少炎症反应的发生,进一步抑制COPD模型大鼠的疾病发展进程,改善模型大鼠的肺功能水平。
综上所述,红花黄色素能明显改善COPD模型大鼠的肺功能,其作用機制可能与抑制炎症因子表达,调控TLR4/NF-κB通路相关蛋白的表达有关。
参考文献
[ 1 ] GAO H X, SU Y, ZHANG A L,et al. MiR-34c-5p plays a protective role in chronic obstructive pulmonary disease via targeting CCL22[J]. Exp Lung Res,2019,45(1/2):1-12.
[ 2 ] PANEVINA A S,SMETNEVA N S,VASILENKO A M,et al. The effects of menopausal hormone therapy on proinflammatory cytokines and immunoglobulins in perimenopausal patients with type 2 diabetes mellitus and chronic obstructive pulmonary disease (COPD)[J]. Ter Arkh,2018,90(10):79-83.
[ 3 ] 陶阳,郭洪花,张彩虹.慢性阻塞性肺疾病相关性衰弱发病机制及营养干预的研究进展[J].中国全科医学,2021,24(6):684-689.
[ 4 ] 李洪晓,吴细英.老年哮喘-慢性阻塞性肺疾病重叠综合征临床特征及危险因素[J].中国老年学杂志,2019,39(21):5264-5266.
[ 5 ] 朱晓敏,罗健,李苗苗,等.慢性阻塞性肺疾病患者并发静脉血栓栓塞症危险因素的Meta分析[J].中华护理杂志,2019,54(5):746-752.
[ 6 ] 杜飞,张李,陈代刚,等.不同程度的慢性阻塞性肺疾病患者合并心血管疾病及其危險因素的比较[J].中国呼吸与危重监护杂志,2017,16(4):311-313.
[ 7 ] 刘淑玲,蔡海荣,陈燕虹,等.红花黄色素对动脉粥样硬化大鼠内皮功能、炎症反应、氧化应激的影响[J].中国老年学杂志,2019,39(18):4585-4588.
[ 8 ] 袁琴琴,刘文营.红花生物活性成分及功能特性研究进展[J].食品工业科技,2020,41(3):332-338,344.
[ 9 ] 马嘉翼,褚松龄.羟基红花黄色素A改善缺血性脑卒中机制的研究进展[J].中国现代应用药学,2019,36(8):1012-1017.
[10] 刘永刚,李芳君,汤芳.羟基红花黄色素A对大鼠心肌细胞缺血再灌注损伤的保护作用[J].中药药理与临床,2015,31(1):71-74.
[11] 刘金连,王海芳,马淑惠,等.羟基红花黄色素A通过抑制动脉内皮细胞中TNFR1/NF-κB信号通路而发挥抗炎作用[J].细胞与分子免疫学杂志,2015,31(7):945-948.
[12] 高峰,韦彬祥,卢肖芳.小剂量肝素钠联合红花黄色素治疗老年慢性阻塞性肺疾病急性加重期的临床疗效[J].临床合理用药杂志,2020,13(12):1-2,5.
[13] 王会娟,王昌明,唐灵,等.慢性阻塞性肺疾病模型大鼠核因子κB及肿瘤坏死因子α、白细胞介素8的表达水平及其意义[J].广西医学,2020,42(5):586-590.
[14] WANG X X,LUO B J,LU Y Y,et al. The triggering receptor expressed by myeloid cells-1 activates TLR4- MyD88-NF-κB-dependent signaling to aggravate ventilation-induced lung inflammation and injury in mice[J]. Cell Tissue Res,2018,374(1):137-148.
[15] 封继宏,祁海燕,李美凤,等.扶正祛邪方对慢性阻塞性肺疾病稳定期模型大鼠肺组织细菌菌落的影响[J].中医杂志,2016,57(4):337-341.
[16] 薛晓明,王洋,赵勤萍,等.宣肺平喘胶囊对慢性阻塞性肺疾病大鼠模型的影响[J].中国实验方剂学杂志,2017,23(2):120-125.
[17] 张园,张妍.羟基红花黄色素A对心肌缺血再灌注损伤大鼠血清炎性因子及心肌组织NF-κB表达的影响[J].中西医结合心脑血管病杂志,2020,18(16):2603-2607.
[18] 王玮,王琦,张永生,等.香烟联合脂多糖建立慢性阻塞性肺疾病大鼠模型[J].中华中医药杂志,2018,33(9):3866-3871.
[19] 黄园,李璐.丹红注射液联合低分子肝素对老年COPD患者的临床症状、血清炎症因子及肺功能的影响[J].中国药房,2017,28(21):2922-2925.
[20] 宋丽娟,朱煜,金鸣.羟基红花黄色素A抑制脂多糖诱导的急性肺损伤小鼠炎症因子表达的研究[J].中国呼吸与危重监护杂志,2016,15(6):577-582.
(收稿日期:2021-01-13 修回日期:2021-04-16)
(编辑:唐晓莲)

