NaCl胁迫对藜麦幼苗生长及生理特性的影响
权有娟 袁飞敏 李想 刘德梅 陈志国
摘 要: 為探讨盐胁迫下两类不同地区藜麦品种幼苗的耐盐机制,该文利用不同浓度的NaCl溶液,对来自青海省海东市乐都区的‘LD-13(低盐地区)和来自青海省海西州乌兰县的‘WL-192(高盐地区)的2个藜麦品种的种子和幼苗进行盐胁迫处理,研究了种子萌发指标(发芽率、发芽势、发芽指数),生长指标(鲜重、根长、茎长)及生理指标(MDA含量及SOD、POD、CAT活性)等的变化。结果表明:低浓度盐(NaCl浓度小于250 mmol·L-1)胁迫下,2个藜麦品种种子的萌发、幼苗生长及生理活性表现均较适宜;但中、高浓度盐(NaCl浓度大于250 mmol·L-1)胁迫下,其种子萌发、生长及幼苗生理活性均受到不同程度的抑制。从耐盐性综合评价值D值来看,虽然同为山谷型的藜麦品种,但适应盐碱地栽培的‘WL-192品种比低盐土壤中生长的‘LD-13品种更耐盐。推测‘WL-192比‘LD-13耐盐性除了受选育地区土壤盐度的影响外,还可能与品种自身及光周期、温度、海拔、纬度等外部生长环境等因素有关。结合青海西部地区气候环境和盐碱土地资源开发利用,‘WL-192品种更适合在青海地区推广种植。
关键词: 藜麦, NaCl胁迫, 幼苗生长, 生理特性, 耐盐性
中图分类号: Q945
文献标识码: A
文章编号: 1000-3142(2021)05-0823-08
Response of seedling growth and physiological characteristics of Chenopodium quinoa under NaCl stress
QUAN Youjuan1,2, YUAN Feimin3, LI Xiang1,2, LIU Demei1, CHEN Zhiguo1*
( 1. Northwest Plateau Institute of Biology, Chinese Academy of Sciences/Key Laboratory of Adaptation and Evolution, Chinese Academy of Sciences/Key Laboratory of Crop Molecular Breeding in Qinghai Province, Xining 810008, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Northwest A & F University, Yangling 712100, Shaanxi, China )
Abstract: In order to explore the mechanism of salt tolerance in seedlings of Chenopodium quinoa varieties in two different regions, the seeds of two C. quinoa varieties ‘LD-13 (low salt area) from Ledu District, Haidong City, Qinghai Province and ‘WL-192 (high salt area) from Wulan County, Haixi Prefecture, Qinghai Province were treated with different concentrations of NaCl solution to study the changes of seed germination indexes (germination rate, germination potential, germination index), growth indexes (fresh weight, root length, stem length) and physiological indexes (MDA content, SOD, POD, CAT activities). The results were as follows: Under the stress of low salt concentration (NaCl concentration less than 250 mmol·L-1), the seed germination, seedling growth and physiological activities of the two C. quinoa varieties were suitable. However, under the high salt concentrations (NaCl concentration > 250 mmol·L-1) stress, the seed germination, growth and seedling physiological activity were inhibited to varying degrees. According to the comprehensive evaluation value of salt tolerance, although the same valley type of C. quinoa varieties, ‘WL-192 variety adapted to saline-alkali soil were more salt-tolerant than ‘LD-13 variety which grown in low-salt soil. It is speculated that the salt tolerance of ‘WL-192 than ‘LD-13 may be affected not only by soil salinity, but also by varieties themselves, photoperiod, temperature, altitude, latitude and other external growth environment factors. Combined with the climatic environment and the development and utilization of saline-alkali land resources in the western region of Qinghai, ‘WL-192 variety are more suitable for popularization and cultivation in Qinghai.
Key words: Chenopodium quinoa, NaCl stress, seedling growth, physiological characteristics, salt tolerance
全球气候变化通过影响农作物的生长环境条件成为世界粮食供给的限制性因素,尤其是干旱导致土壤盐分增加,对粮食生产构成主要威胁,预计到2050年盐碱地将占所有可耕地面积的50% 以上(Flowers et al.,2010; Banerjee et al.,2017)。盐胁迫几乎能影响世界上所有植物的产量(Flowers & Colmer, 2015)。因此,有必要寻找一种潜在的盐生代替作物,在土壤盐渍化程度加快的情况下仍能适应农业生产(Koyro,2003),即所谓的“盐生经济作物”,它既能可持续利用,减少气候条件变化对作物产量及粮食需求的影响,扩大世界上干旱、半干旱土地利用的面积,又可改善土地盐渍化和荒漠化问题等(Geissler et al.,2009; Eisa et al.,2012)。
藜麦(Chenopodium quinoa)是苋科藜亚科藜属植物中典型的“假禾谷类”作物,主要用于收获籽粒,适应范围广,从海平面到海拔4 000 m以上的高山峡谷地区都可以生长,籽粒中具有较高的营养物质(Abugoch,2009; Alvarez-Jubete et al.,2009 ),是目前风靡全世界的“黄金谷物”。由于特殊的生境选择,藜麦具有较强的耐非生物胁迫能力,尤其是耐盐和抗旱特性(Adolf et al.,2013),被大多数学者认为是所有盐生植物中最具潜力的一种盐生替代作物,也被当做研究植物耐盐机制的模式作物(Ruiz et al.,2015)。
青海境内有近270.14 × 104 hm2盐碱地,盐碱化土地面积排在全国前列,主要以氯化物-硫酸盐为主(庞宁菊等,2001;王予声等,1997)。本文通过研究NaCl胁迫对不同地区选择的藜麦品种的种子萌发、幼苗生长和生理指标特性等的影响,探讨藜麦苗期的耐盐机制,为青海地区藜麦品种的选育和推广提供理论指导。
1 材料与方法
1.1 供试材料
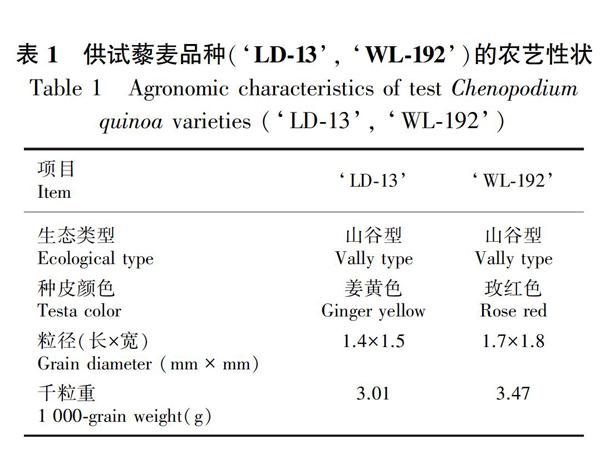
供试藜麦品种为‘乐都-13号(简称‘LD-13)和‘乌兰-192号(简称‘WL-192)。‘LD-13品种由本课题组选育,选育地点在青海省海东市乐都区中国科学院西北高原生物研究所海东生态农业试验站。该站位于湟水河流域,海拔1 967 m,属于青海省东北部农业主产区,年平均气温6 ℃,年降水量350 mm,年日照时数2 600~2 800 h,土壤中的盐分含量低。‘WL-192品种由乌兰三江沃土生态农业科技有限公司引种培育,选育地点在青海省海西州乌兰县希里沟镇,位于柴达木盆地东部,为农牧业交错区,海拔2 950 m,年平均气温3.5 ℃,年平均降水量只有178.6 mm,全年日照百分率为65%~70%,是青海太阳辐射富集地区之一,土壤含盐量较高。
供试种子分别于2018年8月和10月完成采集,采集后將种子自然晾干,调查农艺性状并分装到纸袋中备用。品种详细信息见表1。
1.2 试验设计
将采集的藜麦种子过直径1.5 mm筛,挑选成熟度好、饱满、大小一致的种子,用70%的酒精消毒后用蒸馏水清洗3次,用无菌滤纸吸干水分备用。配制200、250、300、350和400 mmol·L-1 5个梯度的NaCl溶液,用蒸馏水做对照(CK),每个梯度溶液分别取12 mL,倒入铺有两层滤纸的发芽盒(12 cm × 12 cm × 6 cm)中,发芽盒中摆放30粒种子并置于人工智能种子培养箱中,参数设置为白天(16 h)25 ℃,夜晚(8 h)20 ℃,湿度控制在50%~60%之间,夜间无光照,每天定时在发芽盒中加入蒸馏水,以保持NaCl浓度相同,每处理3次重复。每天统计种子发芽数,以胚根长大于2 mm为准,连续统计7 d,计算种子发芽率、发芽势、发芽指标,第8天测量根长、茎长、鲜重,待幼苗长出真叶时,测定幼苗生理指标。
1.3 指标及测定方法
1.3.1 种子萌发指标的测定
发芽率(GR)、发芽势(GV)分别采用孙时轩(1991)、袁飞敏等(2018)的方法进行计算。
(1)发芽率(GR)=n/N×100%。式中:n为第7天萌发种子数;N为供试种子数。
(2)发芽势(GV)=第3天的种子萌发数/供试种子数×100%。
(3)发芽指数(GI)=∑(Gt/Dt)。式中:Gt为第t天的萌发数;Dt为总的萌发天数)。
1.3.2 生长指标的测定 每个处理的每个重复随机选取10株藜麦幼苗,用20 cm直尺、游标卡尺、千分之一的电子天平测量胚根长、茎长(与发芽盒底部垂直的部分)及鲜重,取平均值。
1.3.3 幼苗生理指标的测定 采用南京建成生物公司生产的试剂盒在酶标仪上分别测量丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性和过氧化物酶(POD)活性4个生理指标,每个指标重复测3次。
1.4 数据分析
用Excel 2016、SPSS 22.0 软件对试验数据进行统计与处理,显著性P<0.05。耐盐性综合评价D值的计算参考自杨佳鑫(2019)。
2 结果与分析
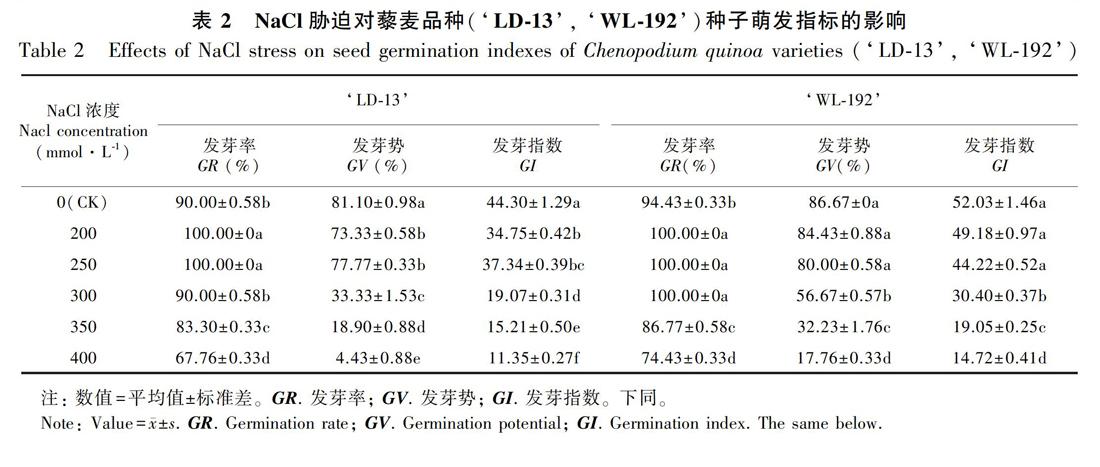
2.1 NaCl胁迫对种子萌发特性的影响
‘LD-13种子萌发的各项指标随NaCl浓度的升高而呈先升高后降低的趋势(表2)。与CK相比,NaCl胁迫浓度在200~250 mmol·L-1时对发芽率、发芽势及发芽指数都具有显著促进作用;而当NaCl胁迫浓度大于250 mmol·L-1时对各萌发指标均具有显著的抑制作用。
‘WL-192种子的发芽率随NaCl浓度的升高呈先上升后下降趋势,但发芽势和发芽指数随NaCl浓度的升高呈下降趋势。当NaCl胁迫浓度在200~300 mmol·L-1时,对发芽率的促进作用明显,均达到100%,显著高于CK;当NaCl胁迫浓度大于300 mmol·L-1后发芽率被明显抑制,显著低于CK;发芽势和发芽指数在200~250 mmol·L-1 NaCl胁迫浓度之间下降趋势不明显,和CK相比差异不显著;而当NaCl胁迫浓度大于250 mmol·L-1时,发芽势和发芽指数的下降趋势明显,和CK相比差异显著。
2.2 NaCl胁迫对藜麦幼苗生长特性的影响
由表3可知,‘LD-13品种的幼苗鲜重、根长、茎长随着NaCl浓度的升高呈先上升后下降的趋势。与CK相比,200~250 mmol·L-1NaCl胁迫可显著促进幼苗鲜重、胚根及幼茎增长;在NaCl胁迫浓度大于250 mmol·L-1时,3个生长指标均被抑制,显著低于CK;当NaCl浓度大于等于350 mmol·L-1时对茎的生长抑制作用最明显,幼苗基本没有长出茎。
‘WL-192的幼苗鲜重、根长、茎长随着NaCl处理浓度的升高呈显著下降趋势并低于CK。3个生长指标在
200~250 mmol·L-1NaCl胁迫浓度之间下降趋势不明显,和CK相比差异不显著;而当NaCl胁迫浓度大于250 mmol·L-1时,各指标下降趋势明显,和CK相比差异显著;400 mmol·L-1NaCl胁迫下,根长仅为CK的18.5%,对茎的抑制作用显著,没有分化出茎。
2.3 NaCl胁迫对幼苗生理特性的影响
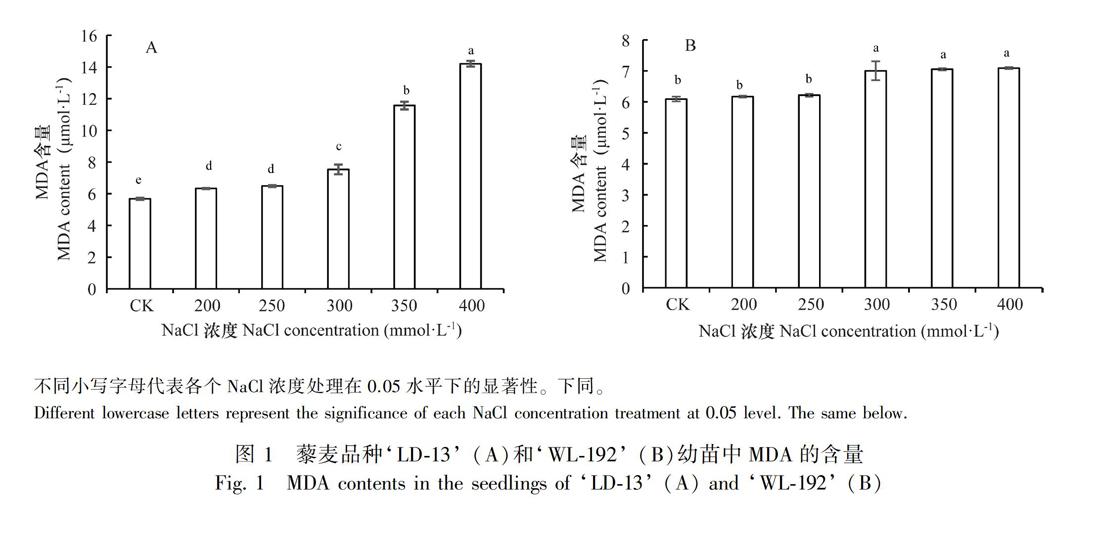
2.3.1 NaCl胁迫下丙二醛(MDA)含量的变化 MDA的量可反映植物组织内脂质过氧化的程度,间接反映细胞膜损伤程度,含量越高说明细胞膜受损严重,抗逆境胁迫能力越弱(刘文瑜等,2017)。
2个品种幼苗中MDA的含量随NaCl浓度的升高呈上升趋势,且均高于CK(图1:A,B)。‘LD-13品种在所有浓度NaCl胁迫处理下的MDA含量均显著上升,分别比CK高10.3%、12.5%、24.7%、50.9%和60.0%,差异显著(图1:A)。‘WL-192品种在200~250 mmol·L-1 NaCl胁迫下MDA的含量分别比CK升高了1.3%、2.4%,差异不显著;NaCl浓度大于250 mmol·L-1时,MDA的含量分别比CK升高了18.9%、19.4%、19.9%,且差异显著(图1:B)。
在非NaCl胁迫下,‘WL-192幼苗中MAD的含量比‘LD-13高,当受到不同浓度NaCl胁迫时,‘LD-13幼苗中MDA的含量都高于‘WL-192,并且上升幅度比‘WL-192大。这说明随着盐浓度的升高, ‘LD-13在盐胁迫下比‘WL-192的细胞膜受损更严重,‘LD-13较‘WL-192对盐胁迫敏感。
2.3.2 NaCl胁迫下超氧化物歧化酶(SOD)的变化
植物体内SOD酶在氧化与抗氧化平衡中起着关键作用,它能清除超氧阴离子自由基(O-2·)以保护细胞不受损伤。
2个藜麦品种幼苗中SOD酶活性随NaCl浓度的升高而呈先升高后降低的趋势(图2:A,B)。‘LD-13品种在200~250 mmol·L-1 NaCl胁迫下,SOD酶活性显著上升,分别比CK高6.4%和12.6%;在300~400 mmol·L-1NaCl浓度之间,SOD酶活性降低,分别比CK低0.5%、12.5%、17.5%,其中,350和400 mmol·L-1NaCl胁迫下差异显著(图2:A)。‘WL-192在200~300 mmol·L-1盐胁迫下,SOD酶活性比CK分别高18.8%、25.3%、25.5%,其中200、250 mmol·L-1NaCl胁迫下差异显著;350和400 mmol·L-1NaCl胁迫下SOD酶活性下降,仍然比CK高22.0%和10.57%,差异显著(图2:B)。
无论是CK或NaCl胁迫处理,‘WL-192藜麦幼苗中的SOD酶活性始终比‘LD-13高,‘LD-13中SOD酶活性在250 mmol·L-1 NaCl浓度处理时开始下降,而‘WL-192在大于300 mmol·L-1盐浓度时才开始下降。由此可见,‘WL-192幼苗中SOD酶活性比‘LD-13高,细胞较不易受损伤。
2.3.3 NaCl胁迫下过氧化物酶(POD)的变化 POD酶是植物体内重要的一种抗氧化酶,它可通过清除逆境胁迫下细胞产生的活性氧,保持细胞膜结构完整,增强植物的抗逆性。
2个藜麦品系幼苗中POD酶活性随盐浓度的升高而呈先升高后降低的趋势(图3:A,B)。‘LD-13 在200~250 mmol·L-1盐胁迫下,POD酶活性比CK分别升高24.0%、24.2%,差异显著;300~400 mmol·L-1浓度下,POD酶活性比CK分别降低5.9%、21.6%和43.6%,差异显著(图3:A)。‘WL-192在200~300 mmol·L-1 NaCl胁迫下,与CK相比,POD酶活性分別显著升高了2.7%、6.0%、6.8%;350~400 mmol·L-1盐胁迫下,POD酶活性显著下降,分别比CK低15.5%和17.3%(图3:B)。
2个藜麦品种相比,无论胁迫与否,‘LD-13幼苗中POD酶活性始终高于‘WL-192,说明低盐土壤中生长的‘LD-13品种幼苗中的POD酶清除有害物质的能力强,保护细胞膜不受伤害,而生长在高盐土壤中的‘WL-192随盐浓度的升高,植物体内的活性氧被积累,导致细胞膜受损。
2.3.4 NaCl胁迫下过氧化氢酶(CAT)的变化 CAT酶通过清除植物体内的过氧化氢而使细胞免受伤害。
‘LD-13幼苗中CAT酶活性隨盐浓度的升高而呈先上升后降低趋势(图4:A)。在200~300 mmol·L-1NaCl胁迫下,CAT酶活性比CK分别上升了20.8%、20.1%和18.4%,差异显著;350~400 mmol·L-1盐胁迫下,CAT活性显著降低,分别比CK低29.0%和53.1%。‘WL-192幼苗中CAT酶活性随盐浓度的升高而呈上升趋势(图4:B)。与CK相比,CAT酶活性分别上升了 60.3%、55.9%、38.8%、17.5%、11.5%,差异显著。
在无盐胁迫时,‘LD-13中的CAT活性比‘WL-192高很多,但是受到盐胁迫时,‘WL-192藜麦幼苗中的CAT活性比‘LD-13高,说明‘WL-192幼苗在盐胁迫下清除体内过氧化氢的能力比‘LD-13强。
2.4 不同地区藜麦品种耐盐性综合评价
2个来自不同地区的藜麦品种对NaCl胁迫耐受性存在较大差异(表4),分别表现在种子萌发、生长及幼苗生理活性等方面。‘LD-13中除了发芽率、发芽指数、POD及CAT酶活性外,其他指标的隶属值均低于‘WL-192。根长的权重最大,为0.201,CAT的权重最小,为0.043。从综合评价D值看出,‘WL-192的耐盐性高于‘LD-13。
3 讨论
3.1 NaCl胁迫对藜麦种子萌发和幼苗生长、生理活性的影响
芽苗期是藜麦对盐胁迫最敏感的时期(Jacobsen et al.,1999),低浓度盐胁迫可增加种子的吸胀能力而促进萌发,充足的水分有利于合成萌发所需的各种酶和结构蛋白,从而完成细胞分裂、分化和胚的生长;相反,高浓度盐胁迫会造成种子吸水困难,种萌发和幼苗生长被抑制(韩润燕等,2014)。本研究结果表明,‘LD-13品种在低浓度NaCl胁迫下可促进种子萌发、幼苗生长以及增强抗氧化酶活性,高浓度NaCl胁迫则产生了明显的抑制作用;‘WL-192品种中,低浓度和高浓度NaCl胁迫对种子萌发、幼苗生长及抗氧化酶活性均有抑制作用,低盐胁迫下抑制较轻,高盐胁迫下抑制较重。
植物在逆境下其离子平衡、渗透平衡被打破,SOD、POD、CAT三种抗氧化酶起保护细胞膜系统作用,在盐胁迫环境下,较高的抗氧化酶活性才能有效地清除活性氧,从而减缓对细胞膜结构的损伤。本试验中,在低浓度NaCl胁迫下,2个藜麦品种的三种抗氧化酶活性均增强,而高浓度NaCl胁迫下则明显抑制了抗氧化酶活性;不同浓度的盐胁迫使2个藜麦品种中SOD、CAT及POD酶活性的变化趋势有所不同,耐盐型藜麦品种‘WL-192比盐敏感型藜麦品种‘LD-13的酶活性更强。2个藜麦品种对NaCl胁迫表现出不同的萌发和生长应答反应,可能因为不同产地品种对盐分敏感程度不同。
3.2 藜麦耐盐性与品种自身的特性和外部生长环境有关
植物耐盐性是一个复杂的特性,与形态、生理、生化及分子机制等多方面相关,而这些机制又都与盐分制约植物生长的渗透作用、气体交换、离子毒性和营养失衡等因素相关联(Flowers & Colmer,2008)。藜麦作为典型的泌盐植物,其叶脉附近有盐腺或盐囊,特殊的表皮细胞能隔离和外排代谢细胞中多余的盐分,高度耐盐的藜麦品种其盐囊呈淡红色,在盐胁迫下具有较强的竞争优势(Agarie et al.,2007)。虽然‘LD-13和‘WL-192两个藜麦品种同属山谷型,但对NaCl胁迫分别做出不同的响应,这可能跟品种选育过程中对外部环境如纬度、海拔、温度、气候条件及光周期等的适应有关。
4 结论
综上所述,低浓度NaCl刺激对藜麦种子萌发、生长、幼苗生理活性具有促进作用,高浓度NaCl胁迫则有抑制作用。在不同盐浓度土壤介质中选育的2个藜麦品种在200~250 mmol·L-1 NaCl浓度胁迫下,其萌发指标、生长指标及生理特性表现均较好。在盐碱土中选择的‘WL-192藜麦各项萌发指标和生长生理指标都比‘LD-13强,耐盐性更好。结合2个藜麦品种在青海不同种植地区生产实际中的综合农艺性状表现,认为青海西部地区的盐渍土比东部地区的低盐分土壤更适合藜麦的种植。
参考文献:
ABUGOCH LE, 2009. Quinoa(Chenopodium quinoa Willd.): composition, chemistry, nutritional and functional properties [J]. Adv Food Nutr Res, 58: 1-31.
ADOLF VI, SHABALA S, ANDERSEN MN, et al.,2013. Salt tolerance mechanism in quinoa (Chenopodium quinoa Willd.) [J]. Environ Exp Bot, 92: 43-54.
AGARIE E, SHIMODA T, SHIMIZU Y, et al., 2007. Salt tolerance, salt accumulation, and ionic homeostasis in an epidermal bladder-cell-less mutant of the common ice plant Mesembryanth-emum crystallinum [J]. J Exp Bot, 58(8): 1957-1967.
ALVAREZ-JUBETE L, ARENDT EK, GALLAGHER E, 2009. Nutritive value and chemical composition of pseudocereals as gluten-free ingredients [J]. Int J Food Sci Nutr, 60(4): 240-257.
BANERJEE K, GATTI RC, MITRA A, 2017. Climate change-induced salinity variation impacts on a stenoecious mangrove species in the Indian Sundarbans [J]. AMBIO, 46(4): 492-499.
EISA S, HUSSIN S, GEISSLER N, et al., 2012. Effect of NaCl salinity on water relations, photosynthesis and chemical compositon of Quinoa (Chenopodium quinoa Willd.) as a potential cash crop halophyte [J]. Crop Sci, 6(8): 357-368.
FLOWERS TJ, GALAL HK, BROMHAM L, 2010. Evolution of halophytes: Multiple origins of salt tolerance in land plants [J]. Funct Plant Biol, 37(7): 604-612.
FLOWERS TJ, COLMER TD, 2015. Plant salt tolerance: Adaptations in halophytes [J]. Ann Bot, 115(3): 327-331.
FLOWERS TJ, COLMER TD, 2008. Salinity tolerance in halophytes [J]. New Phytol, 179(4): 945-963.
GEISSLER N, HUSSIN S, KOYRO HW, 2009. Interactive effects of NaCl salinity and elevated atmospheric CO2 concentration on growth, photosynthesis, water relations and chemical composition of the potential cash crop halophyte Aster tripolium L. [J]. Environ Exp Bot, 65(2-3): 220-231.
HAN RY, CHEN YY, ZHOU ZH, et al., 2014. Effects of NaCl stress on seed germination and seedling growth of sweet clover [J]. Agric Res Arid Areas, 32(5): 78-83. [韓润燕, 陈彦云, 周志红, 等, 2014. NaCl胁迫对草木樨种子萌发及幼苗生长的影响 [J]. 干旱地区农业研究, 32(5): 78-83.]
JACOBSEN SE, JOERNSGARD B, CHRISTIANSEN JL, et al., 1999. Effect of harvest time, drying technique, temperature and light on the germination of quinoa (Chenopodium quinoa) [J]. Seed Sci Technol, 27(3): 937-944.
KOYRO HW, 2003. Study of potential cash crop halophytes by a quick check system: Determination of the threshold of salinity tolerance and the ecophysiological demands [M]. Netherland, Springer: 5-17.
LIU WY, YANG FR, HUANG J, et al., 2017. Response of seedling growth and the activities of antioxidant enzymes of Chenopodium quinoa to salt stress [J]. Acta Bot Boreal-Occident Sin, 37(9): 1797-1804. [刘文瑜, 杨发荣, 黄杰, 等, 2017. NaCl胁迫对藜麦幼苗生长和抗氧化酶活性的影响 [J]. 西北植物学报, 37(9): 1797-1804.]
PANG NJ, DU XN, LI YM, et al., 2001. Causes and improvement of soil salinization along the Yellow River in Qinghai Province [J]. Chin J Soil Sci, 32 (6): 52-55. [庞宁菊, 都学宁, 李月梅, 等, 2001. 青海黄河沿岸农田土壤盐渍化成因及改良途径 [J]. 土壤通报, 32(6): 52-55.]
RUIZ KB, BIONDI S, MARTINEZ EA, et al., 2015. Quinoa—A model crop for understanding salttolerance mechanisms in halophytes [J]. Giorn Bot Ital, 150(2): 357-371.
SUN SX, 1991.Afforestation science [M]. Beijing: China Forestry Press: 65-142. [孙时轩, 1991. 造林学 [M]. 北京: 中國林业出版社: 65-142.]
WANG YS, SHI SL, LIU SY, et al., 1997. Qinghai Soil [M]. Beijing: China Agricultural Publishing Press: 21-414. [王予生, 史书乐, 刘守月, 等, 1997. 青海土壤 [M]. 北京:中国农业出版社: 21-414.]
YANG JX, LI QW, GUO ZY, et al., 2019. Comprehensive evaluation on salt tolerance of three Prunus mume varieties [J]. J NW A & F Univ(Nat Sci Ed), 47(8): 65-74. [杨佳鑫, 李庆卫, 郭子燕, 等, 2019. 3个梅花品种幼苗耐盐性综合评价 [J]. 西北农林科技大学学报(自然科学版), 47(8): 65-74.]
YUAN FM, QUAN YJ, CHEN ZG, 2018. Effects of sodium stress on seed germination of Chenopodium quinoa Willd. [J]. J Arid Land Resour Environ, 32(11): 182-187. [袁飞敏, 权有娟, 陈志国, 2018. 不同钠盐胁迫对藜麦种子萌发的影响 [J]. 干旱区资源与环境, 32(11): 182-187.]
(责任编辑 何永艳)
收稿日期: 2019-11-06
基金项目: 中国科学院种子创新研究院项目(INASEED);海西州财政支持农业项目(HXNM001);青海省种子工程项目(2019016);青海省重点研发与转化计划项目(2019-NS-045)[Supported by the Innovative Academy of Seed Design(INASEED); Financial Support Agriculture Program of Haixi Prefecture(HXNM001); Qinghai Seed Engineering Program(2019016); Key R & D and Transformation Program of Qinghai Province(2019-NS-045)]。
作者简介: 权有娟(1994-),硕士研究生,主要从事植物遗传育种研究,(E-mail)quanyoujuan828@163.com。
通信作者: 陈志国,研究员,博士研究生导师,主要从事作物遗传育种研究,(E-mail)zgchen@nwipb.cas.cn。

