牛至生殖生物学特性研究
刘 艳,卓 维,卢圣鄂,朱晓富,辛元尧,申 杰,黄红燕,任风鸣
(重庆市药物种植研究所 特色生物资源研究与利用川渝共建重点实验室,重庆 南川 408435)
牛至(OriganumvulgareL.)隶属于唇形科(Lamiaceae)牛至属(Origanum),多年生草本或半灌木,芳香,产河南、江苏、浙江、安徽、江西、福建、台湾、湖北、湖南、广东、贵州、四川、云南、陕西、甘肃、新疆及西藏,生于路旁、山坡、林下及草地,海拔500~3 600 m,欧、亚两洲及北非也有分布,北美亦有引入[1]。牛至是一种重要的经济植物,在西班牙、墨西哥和地中海地区的饮食中被作为香料长期使用[2],在中国作为一味传统的中草药,用于预防流感,治疗急性胃肠炎、腹痛、小儿食积腹胀等症[1,3]。从牛至中提取的牛至精油具有良好的抑菌消炎、抗氧化等作用,能较好地促进动物生长、提高动物机体免疫力,且不具有耐药性,是一种理想的抗生素替代品,已是世界范围内公认的天然饲料添加剂[4-7]。
由于牛至精油的重要作用,目前对于牛至的研究多集中于牛至精油成分及活性[7-13]、次生代谢产物生物合成[14]、引种栽培技术[15-17]、扩繁技术[18-20]等方面。国内牛至生产中,主要通过野外收集种子或采挖野生植株作种[15],缺乏统一纯化的良种,栽培品种退化严重[19]。这致使牛至人工种植规模小,产量不稳定,质量参差不齐,严重限制牛至的生产发展[21]。对植物生殖特性及繁育系统的了解是进行良种选育、杂交育种及可持续利用的基础,而当前针对牛至生殖特性的研究报道较少。已有研究大多仅关注到牛至开花生物学特性[22-24],对其繁育系统的研究还很匮乏。本研究重点开展了牛至花粉活力、柱头可授性及繁育系统的研究,探索其生殖生物学特性及繁育系统特征,旨在提高牛至繁殖效率,为良种选育、杂交育种等提供理论依据,对于推动牛至资源可持续利用具有重要意义。
1 材料与方法
1.1 材 料
试验所用牛至均为野外采集新鲜植株,采自云南省丽江、大理等地,在种质资源圃栽种一年,开花时经重庆市药物种植研究所刘正宇研究员鉴定为牛至OriganumvulgareL.。根据Ietswaart[25]牛至属的分类系统,牛至包含6个亚种,我国分布有OriganumvulgareL. ssp.vulgareL.和OriganumvulgareL. ssp.viride(Boissier) Hayek两个亚种。根据牛至亚种检索表[25],这两个亚种的主要鉴别特征为:O.vulgaressp.vulgare苞片紫色、花粉红色;O.vulgaressp.viride苞片绿色、花白色。本研究中试验材料为苞片绿色、花白色的牛至亚种,此亚种为O.vulgaressp.viride。
本研究试验主要在重庆市药物种植研究所的牛至种质资源圃中开展,物候观察及结实率统计还包括牛至的野外采集地。于2019年10~11月和 2020年4~10月进行开花、结实物候观察及结实率统计,2020年4~8月进行花粉、柱头可授性测定及人工控制授粉试验等。
1.2 研究方法
1.2.1 花期物候及形态学观察
从2020年4月1日开始,每3 d观察1次现蕾情况。现蕾之后,随机选取5株植株进行标记,每天观察其形态特征并记录开花顺序、初花、盛花、末花及结实时间等。同时标记即将开放的10朵花蕾,定位观察单花水平的开花进程,观测记录花的状态、雌雄蕊的变化等,并测量花冠长度、直径、雌雄蕊高度等。
1.2.2 花粉活力及柱头可授性检测
于盛花期随机采集开花前不同大小及开花后不同天数的新鲜花朵,每个阶段5朵左右,取其花粉进行活力检测。将少量花粉置于载玻片上,滴1~2滴0.5% TTC溶液,充分混匀后盖上盖玻片,置于35 ℃恒温箱中15 min,之后在Nikon eclipse 55i显微镜下观察计数。选取5个视野,每个视野花粉数约为70~130粒不等,凡被染成红色的花粉为具有活力的花粉,淡红色或无色者视为不具有生活力的花粉。花粉活力(%)=红色花粉数÷花粉总数×100%。
采用联苯胺-过氧化氢法检测不同开花时期柱头的可授性。随机选取开花前不同大小及开花后不同天数的新鲜花朵,每个阶段5朵左右。在凹面载玻片中加入体积比为1%联苯胺∶3%过氧化氢∶水=4∶11∶22的反应液,将待检柱头浸入其中,在Nikon eclipse 55i显微镜下观察柱头是否呈现蓝色并产生大量气泡,如柱头呈现蓝色并产生大量气泡为具活力的柱头,不呈现蓝色并且不产生气泡的为不具活力的柱头,同时根据气泡的多少来衡量柱头可授性的强弱。
1.2.3 杂交指数(Outcrossing index,OCI)的估算
按照Dafni的标准[26]进行花朵直径、花朵大小、开花行为的测定及繁育系统的评判。①花朵或花序直径:<1 mm赋值为0,1~2 mm赋值为1,2~6 mm赋值为2,>6 mm赋值为3。②花药开裂时间与柱头可授期之间的时间间隔:同时或雌蕊先熟赋值为0;雄蕊先熟赋值为1。③柱头与花药的空间位置:同一高度赋值为0;空间分离赋值为1。以上三者之和为杂交指数(OCI)。OCI=0时,繁育系统为闭花受精;OCI=1时,为专性自交;OCI=2时,为兼性自交;OCI=3时,为自交亲和,有时需要传粉者;OCI=4时,为部分自交亲和,异交,需要传粉者。
1.2.4 花粉胚珠比
随机选取5朵花药未开裂的花。将1朵花中所有的花药置于EP管中,加200 μL染液,将花药捣碎使花粉散出成为悬浊液,在涡旋仪上震荡60 s,然后取5份1 μL的样本于载玻片上,于Nikon eclipse 55i显微镜下观察计数,取平均值。1朵花中总的花粉数=1 μL样本中的花粉数×200。将同一朵花的子房在Nikon eclipse 55i显微镜下观察记录胚珠数。花粉胚珠比(P/O)=花粉数/胚珠数。根据Cruden的标准[27]进行繁育系统的判断:P/O为2.7~5.4,繁育系统为闭花受精;P/O为18.1~39.0,为专性自交;P/O为31.9~396,为兼性自交;P/O为244.7~2 588,为兼性异交;P/O为2 108~195 525,为专性异交。
1.2.5 繁育系统检测
为检测其繁育系统,于盛花期随机选取即将开放的花朵,开展6个试验处理:①不去雄,不套袋:作为自然对照。②去雄,套袋,不授粉:检测是否具有无融合生殖。③不去雄,套袋:检测是否具有自发的自花授粉。④去雄,套袋,人工自花授粉:检测自花自交情况。⑤去雄,套袋,人工同株异花授粉:检测同株异花自交情况。⑥去雄,套袋,人工异株授粉:检测异交情况。
全部人工控制授粉试验均提前进行去雄操作并标记好,然后用6 cm×6 cm孔径为0.1 mm的尼龙网袋将所在花序套住,待柱头张开具可授性之后打开网袋完成人工授粉后继续套住。授粉时选取完整没有开裂的花药,取其中花粉进行授粉。自然对照及其余每个处理几十至一百多朵花不等,7~8周后统计结实率。因其每朵花4个胚珠可结4个坚果,因此其结实率(%)=果实数÷花数÷4×100%。
1.3 数据统计分析
试验数据采用Excel 2003和SPSS17.0软件进行统计分析。
2 结果与分析
2.1 开花物候和形态学
O.vulgaressp.viride花序为伞房状圆锥花序,多花密集(图1,A);苞片长圆状倒卵形,绿色,长约5 mm;花萼钟状,长3 mm;花冠白色,管状钟形,长约7 mm,冠檐二唇形,上唇直立,2裂,下唇张开,3裂(图1,B);花冠管底部分泌有微量花蜜;雄蕊4,后对短于上唇,前对略伸出花冠;柱头先端不相等2浅裂,裂片钻形(图1,F)。果熟时果序棕褐色,小坚果卵圆形,棕色。
O.vulgaressp.viride的花期出现在2020年4月至8月,其中5月中下旬至7月中下旬为盛花期。定位观察结果显示,O.vulgaressp.viride于4月10日左右现蕾,4月27日开始开花,8月陆续开始结实,8月底已没有开花花序。同一花序上的花随机开放。单花花期6~8 d左右,花朵大约在上午9~12时开放,最初是从上下唇连接处开裂,然后下唇逐渐张开。随着花柱的伸长,柱头在花开放后的24~48 h逐渐伸出花冠外张开。雄蕊在花开放后的1~2 d逐渐伸出花冠外。花朵开始凋谢时花冠出现棕色斑块,雌雄蕊逐渐变为棕色,最后花冠全部变成棕色,整朵花萎缩(图1,D),花冠脱落,花萼宿存。

图1 Origanum vulgare ssp. viride形态及访花昆虫Fig. 1 Morphologies and flower visitors of Origanum vulgare ssp. viride注:A.开花时花序形态;B.不同大小花的开放状态;C.胚珠数量及形态(可见4个卵圆形胚珠);D.花朵衰败时的形态;E.MTT检测的花粉形态;F.联苯胺-过氧化氢法检测的柱头形态;G,H.昆虫钻入花朵中访花。标尺:A,B,D=5 mm;C,F=500 μm;E=100 μm;G,H=2 mm。
2.2 花粉活力及柱头可授性
经过观察,O.vulgaressp.viride的花药从开花第1天开始开裂散粉,持续到花朵枯萎(表1)。TTC检测结果显示,其花粉自蕾期花药未开裂时即开始具有一定活力(花长3.0 cm以上)(表1),经TTC染色后花粉粒呈现红色(图1,E)。随着花朵的生长花粉活力逐渐增强,开花第1天花粉活力最高,达到(92.77±1.54)%,其花粉活力期持续时间长,并且保持较高的活力,直至第8天花朵开始枯萎时,仍具有(73.74±2.35)%的活力(表1)。
根据联苯胺-过氧化氢法检测结果(表 1),O.vulgaressp.viride的柱头裂片处于闭合状态时不具有可授性,直至开花第2天柱头裂片张开后才开始具有可授性(表1),浸入联苯胺-过氧化氢液体中柱头周围产生大量气泡(图1,F)。开花第1天柱头裂片并未张开,此时不具可授性,开花第3~4天柱头可授性较强,当花朵开始衰败柱头变枯黄时,有些柱头仍具有一定可授性(表 1)。
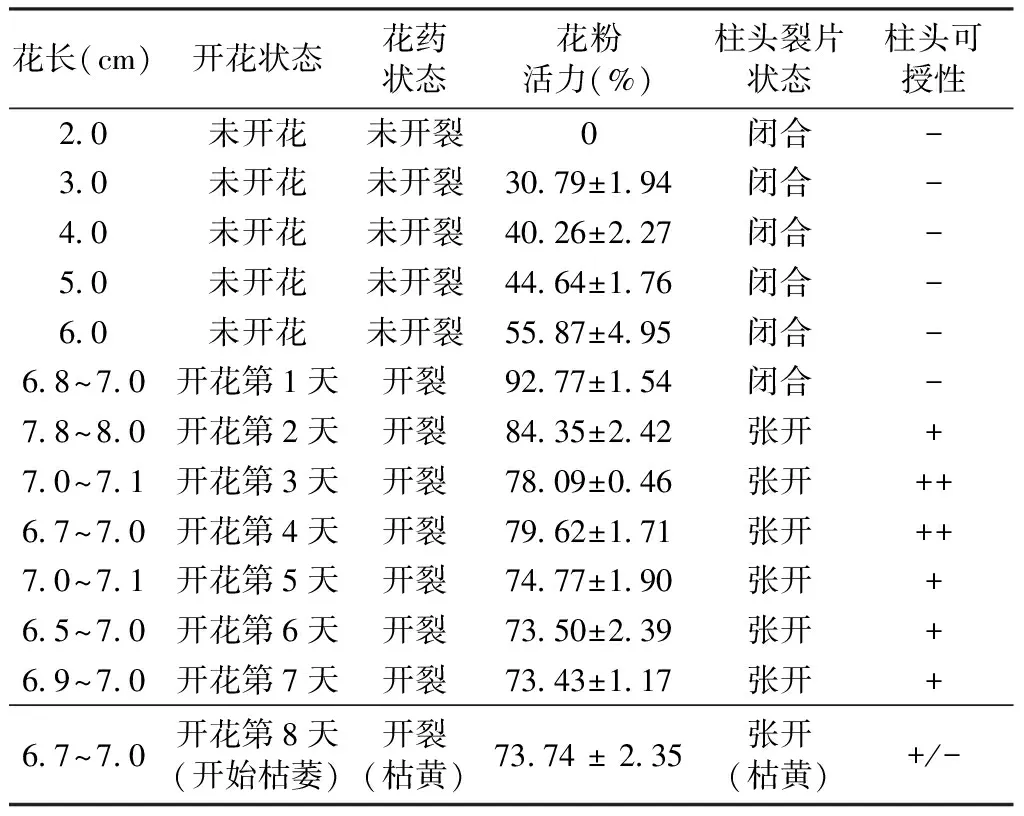
表1 不同开花时期Origanum vulgare ssp. viride的花粉活力及柱头可授性Table 1 The pollen viability and stigma receptivity of Origanum vulgare ssp. viride at different flowering periods
2.3 杂交指数(OCI)
O.vulgaressp.viride的花朵直径约为3.5~4.9 mm,根据Dafni的标准[26],赋值为2;其雄蕊先熟,花药从开花第1天开始开裂散粉,而此时柱头尚不具有可授性(表1),赋值为1;开花时柱头与花药在空间位置上是分离的,柱头位置高于较长的后对花药约1.5 mm,赋值为1。因此,O.vulgaressp.viride的OCI值为4。根据Dafni的标准[26],其繁育系统为部分自交亲和,异交,需要传粉者。
2.4 花粉胚珠比
试验结果显示,O.vulgaressp.viride单花花粉数为9 816±203,单花胚珠数为4(图1,C),其花粉胚珠比(P/O)为2 454.00±50.85。依据Cruden的标准[27],其繁育系统为兼性异交或专性异交。
2.5 繁育系统
自然对照和人工控制授粉试验结实率情况见表2。自然状态下,O.vulgaressp.viride野外居群的结实率较高,丽江居群和大理洱源居群的结实率分别为(45.36±5.51)%和(41.24±4.60)%,而种质资源圃中的结实率较低,仅为(4.17±1.80)%。去雄套袋后并未结实,说明其不存在无融合生殖现象。人工自花、同株异花和异株授粉均能结实,异交的结实率高于自交结实率(表2)。不去雄、套袋的结实率为0,说明其不能自动自花授粉,需要借助传粉媒介完成授粉。综合杂交指数和花粉胚珠比的试验结果来看,O.vulgaressp.viride的繁育系统为兼性异交,部分自交亲和,需要传粉者。
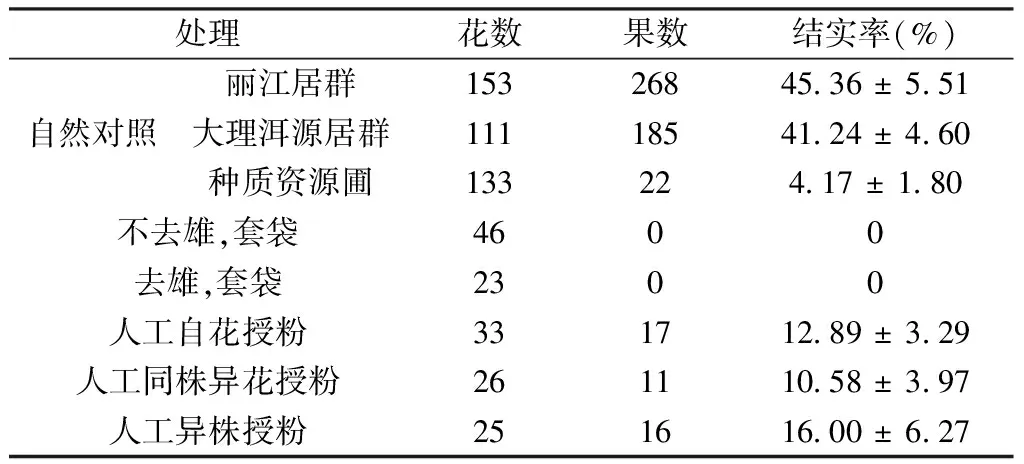
表2 Origanum vulgare ssp. viride自然和人工控制授粉结实率Table 2 Fruit set ratio of Origanum vulgare ssp. viride under natural and manipulated treatments
3 讨 论
O.vulgaressp.viride花朵开放时间为上午9~12时,单花花期6~8 d,这与Zimina对生长于莫斯科地区牛至的开花生物学研究[22]结果相一致。Zimina还发现单花花期最长的可达37 d[22],在观察过程中尚未发现O.vulgaressp.viride开放时间这么久的花朵。而Godin对莫斯科地区牛至的观察结果表明两性花的花期为2~3 d,Godin认为单花花期会在不利环境条件下延长以延长昆虫授粉时间[23]。
有些地区的牛至具有雌全异株现象[1,23-24],据研究观察结果O.vulgaressp.viride均为两性花植株,未发现有雌性花植株。Godin研究发现牛至两性花的开花进程分为雄性阶段和雌性阶段,开花时花药开裂,此时雌蕊不具功能,为雄性阶段;在开花30~35 h后柱头裂片张开,雌性阶段开始,此后花药干燥,雄性阶段结束[23]。根据检测结果,O.vulgaressp.viride的开花进程不能区分为雌、雄两个阶段,虽然也是雄蕊先熟,但是雌蕊具功能之后雄性功能并未结束,直至花朵枯萎花粉仍具有较高活力(表1)。
对花粉活力和柱头可授性的研究是有性生殖研究的基础,在育种过程中理想亲本最佳生殖期不相遇是影响杂交的主要因素,因此需要全面了解认识亲本的物候期,准确把握最佳授粉时间[28]。研究结果显示,O.vulgaressp.viride柱头可授期与花粉活力期同期且持续时间都较长(表1)。因此,在育种工作中可以在花开前后十余天的时间里开展人工授粉或收集花粉进行保存,为了保证授粉成功率,尽量选取花粉活力高的时间段采集花粉。同样,应选用可授性强的柱头进行授粉以提高成功率。
O.vulgaressp.viride的杂交指数为4,依据Dafni的标准[26]其繁育系统为部分自交亲和,异交,需要传粉者;其花粉胚珠比为2 454.00 ± 50.85,依据Cruden的标准[27]它的繁育系统为兼性异交或专性异交;人工控制授粉试验结果显示其自交、异交均可结实,不能自动自花授粉,需要借助传粉媒介。综上而言,三种方法检测的繁育系统结果一致,其繁育系统为兼性异交,部分自交亲和,需要传粉者。
牛至的传粉昆虫种类较多,有蜜蜂、蜂虻、蝶类、熊蜂等[22,29]。观察结果显示在O.vulgaressp.viride种质资源圃中没有上述传粉昆虫,只有蚂蚁(图1,G)、蝇类(图1,H)等少量昆虫。Zimina研究发现牛至除虫媒外还能进行风媒传粉[22]。风媒花常具有单性、花被片高度退化、无花蜜、花粉量大、花丝长、花粉粒光滑易于被风吹走等特点,虫媒花通常小型、有香味和花蜜[30]。根据花部形态,O.vulgaressp.viride符合虫媒传粉综合征,其去雄、不去雄套孔径0.1 mm的网袋后均不结实,自然结实率很低(4.17±1.80)%,表明其尚未呈现风媒传粉现象。
O.vulgaressp.viride野外居群结实率高,而种质资源圃中的结实率总体而言较低(表2)。推测造成结实率低的原因主要为:①引种栽培地环境条件(气温、光照、降水等)不如原生地适宜,影响了其开花结实过程。②花粉限制通常会影响结实率[31],种质资源圃搭建了遮荫棚等设施,遮挡影响了昆虫访花,传粉昆虫缺乏使得授粉率不高,导致结实率较低。因此,在实际生产中采挖栽培时应选取生境气候相似的地区作为种植地,另外要建立有效的传粉机制,如增加传粉昆虫、人工辅助授粉等以提高结实率。
为了保证物种的繁衍,植物往往会发展出无性繁殖和有性繁殖并存的生殖补偿机制。O.vulgaressp.viride即是一种兼具有性繁殖和无性繁殖的物种,当生境条件恶劣、缺乏传粉昆虫等使其有性繁殖过程不能顺利进行时,它能以根茎的无性繁殖保持其种群繁衍的能力。当前生产中应用广泛的分株繁殖方式就是利用其根茎的无性繁殖特性。但长期无性繁殖会导致品种退化、病虫害严重等问题,影响其产量和质量。要解决这些问题,应该多采用有性繁殖方式,利用种子播种进行育苗种植,并利用杂交育种技术选育优良品种。
综上所述,牛至是一种重要的天然“抗生素”植物,是无抗饲料添加剂的主要原料之一。本文对中国产牛至亚种O.vulgaressp.viride的物候期、有性生殖特性、繁育系统特征等进行了深入研究探讨,对指导国内实际生产应用中科学引种种植、人工辅助授粉等具有重要的意义,同时也为牛至的繁殖栽培及杂交育种工作提供依据和参考,助推牛至产业发展。

