产香真菌GS-1挥发性物质特征分析及抑菌作用观察
王春生,智亚楠,陈利军*,刘 铭,侯梦圆
(1.信阳农林学院农学院,信阳 464000;2.河南省豫南农作物有害生物绿色防控院士工作站,信阳 464000)
微生物的挥发性有机物(volatile organic compounds,VOCs)又称微生物的挥发性物质,是微生物代谢过程中产生的小分子化合物(<300 Da),具有低极性和高蒸汽压的特性[1],能够在空气、土壤空隙中高效率的扩散,是理想的信息化学物质[2,3]。一些微生物挥发性物质可以抑制植物病原微生物的生长、繁殖[4,5],促进植物的生长和提高植物抗病性[6,7],同时具有低毒、环保等特点,使其可以作为仓储、设施农业、土壤等的熏蒸剂防控植物病害[8]。相对于植物,微生物具有繁殖快、生长周期短、易培养、易改良、适应性强、不受季节限制等优点[9]。因此,微生物的挥发性物质作为生物熏蒸剂在农业领域符合可持续发展策略,具有广阔的发展前景,有替代传统化学熏蒸剂的巨大潜力。
真菌产生的挥发性物质在植物病害防治中具有重要发展潜力和应用价值而受到国内外研究者的关注[7,10-12]。在10万多种已描述的真菌中,已进行挥发性物质研究的约100种,从这些真菌中鉴定超过300种挥发性物质,主要有萜烯类、芳烃类、酯类、杂环、酸类、醇类、醛类、酮类、硫醇类等化合物[7,13]。顶空固相微萃取技术(HS−SPME)是一种集萃取、浓缩、解吸于一体的挥发性物质样品前处理技术,具有操作简单、无需有机溶剂、样品用量少、活体取样、灵敏度高等优点,与气质联用仪(GC−MS)联用实现对收集到的挥发性物质的化学组分进行分析和确定其相对含量,适合于多个领域测量样品的前处理[14],近年来在真菌挥发性物质组分鉴定中得到了广泛应用[7,15,16]。
产香真菌GS−1为分离自构树枯枝的一株真菌,其有性型为丛赤壳Nectriacinnabarina,该菌株产生浓郁的香味,其挥发性物质对灰葡萄孢Botrytiscinerea、禾谷镰刀菌Fusariumgraminearum、核盘菌Sclerotinia sclerotiorum等植物病原菌均有明显的熏蒸抑制作用,初步光学显微观察发现其挥发性物质可造成灰葡萄孢菌丝畸形、分支增多、原生质外渗等,生测试验表明产香真菌GS−1挥发性物质具有良好的植物病害生防潜能[10]。菌株GS−1对植物病原菌的熏蒸抑菌机制尚未深入研究,挥发性物质化学组分及菌株生长过程中挥发性物质释放量的动态规律尚不清楚,这些因素均限制了菌株 GS−1的开发应用。本研究拟在前期基础上利用电镜进一步观察GS−1菌株挥发性物质对灰葡萄孢的熏蒸抑菌作用,通过HS−SPME−GC−MS法分析GS−1菌株挥发性物质的化学组分,进而明确挥发性物质释放量的时间规律,以期为菌株GS−1挥发性物质在植物病害防控中的合理开发和高效利用提供理论依据。
1 材料与方法
1.1 供试材料
产香真菌丛赤壳GS−1分离自构树,植物病原真菌灰葡萄孢分离自番茄,由信阳农林学院植物病理实验室保存。
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖18 g,琼脂粉17 g,水1000 mL。
试剂及仪器:正癸烷(98%,上海阿拉丁生化科技股份有限公司),2.5%戊二醛固定液(福州飞净生物科技有限公司),电镜用锇酸、Spurr包埋剂(SPI−CHEM公司)。
手动SPME进样器、50/30 μm DVB/CAR/PDMS萃取头、15 mL SPME专用顶空样品采集瓶均为美国Supelco公司;气相色谱(GC)/质谱(MS)联用仪为美国Agilent 7890B/7000D型和6850/5975型,NIST17谱图库;UC7型超薄切片机,德国Leica公司;SU−8010型扫描电镜和H−7650型透射电镜,均为日本Hitachi公司。
1.2 试验方法
1.2.1 产香真菌GS−1对灰葡萄孢熏蒸抑制作用的观察 抑菌作用的观察参照陈利军等[10]对扣法,略有修改。用接种针挑取菌株GS−1接种至PDA平板25 ℃条件下黑暗培养,7 d后在菌落边缘打取直径5 mm菌饼,取一块菌饼接种到新PDA平板上25 ℃条件下黑暗培养,培养9 d后与培养灰葡萄孢的平板对扣,菌株GS−1在下,灰葡萄孢在上。灰葡萄孢的培养方法同菌株GS−1,分别在3 d后取菌饼,24 h后对扣。以空白PDA平板代替菌株GS−1与灰葡萄孢平板对扣为对照。对扣培养72 h后,扫描电镜和透射电镜制样,观察灰葡萄孢菌丝形态和细胞结构的变化,样品采集方法参照陈利军等[17]。
1.2.2 HS−SPME法萃取产香真菌GS−1挥发性物质 取5 mL融化后冷却到(50~60)℃的PDA倒入15 mL顶空样品瓶内灭菌并摆斜面,制成样品瓶斜面培养基。用接种针挑取产香真菌GS−1接种到PDA平皿,25 ℃条件下黑暗培养7 d后,在菌落边缘打取直径5 mm菌饼,取一块菌饼接种到样品瓶斜面培养基上,并将瓶盖内垫换为16 mm已灭菌的滤纸片,然后置于25 ℃培养箱中培养。12 d后对GS−1菌株产生的挥发性物质进行萃取,萃取前24 h将滤纸片更换为原用的内垫;萃取头使用前在260 ℃的GC−MS进样口中活化30 min。25 ℃条件下顶空吸附2 h,然后进行GC−MS分析,解吸附时间为5 min。
1.2.3 产香真菌GS−1挥发性物质释放时间规律的测定 正癸烷内标溶液的配置:用正己烷将正癸烷稀释1000倍得到1 μL/mL正癸烷内标溶液,备用。挥发性物质收集参考王静等[18]方法,有修改。HS−SPME法收集产香真菌GS−1挥发性物质:菌株GS−1的培养同1.2.2,0 h起利用SPME装置对挥发性物质进行收集,1~15 d每天收集1次,之后每隔2 d收集1次,第21 d后截止,每次3个样品。收集前,沿顶空瓶内侧注入1 μL内标,平衡20 min后利用HS−SPME法对挥发性物质进行收集,将活化后的萃取头置于距离样品约5 mm,萃取的时间为1 h,萃取温度为25 ℃。萃取完成后,将萃取头插入GC−MS进样口解吸附5 min,用GC−MS对产香真菌GS−1的挥发性物质组分进行定量分析,按Vi=V10×(Ai/A10)公式计算目标代谢物的相对含量。式中 Vi为目标代谢物含量(10−3µL),V10为加入内标的量(10−3µL),Ai为目标代谢物总离子流图峰面积,A10为内标总离子流图峰面积。
1.2.4 产香真菌GS−1挥发性物质化学组分分析 菌株GS−1培养12 d后通过HS−SPME−GC−MS法分析挥发性物质化学组分,菌株培养和挥发性物质测定的方法同1.2.3,GC−MS为7890B/7000D型。
1.2.5 GC−MS分析条件 GC条件:色谱柱为HP−5ms毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度260 ℃;程序升温,初始柱温为60 ℃,保持2 min,以10 ℃/min升温速率升至230 ℃,保持1 min;载气为高纯氦气,流速为 1.0 mL/min;进样量为1.0 μL;不分流模式。MS条件:EI离子源,电子轰击源为70 eV,离子阱温度220 ℃,传输线温度280 ℃,无溶剂延迟,全扫描方式,扫描范围33~350 amu。
2 结果与分析
2.1 产香真菌GS-1抑菌作用的观察
扫描电镜观察,对照组灰葡萄孢菌丝质地均匀、表面光滑、体态饱满、伸展流畅(图1A);产香真菌GS−1挥发性物质处理组菌丝表面出现皱缩、菌丝体畸形、顶端尖细、菌丝变薄等现象(图1B,C)。

图1 扫描电镜观察产香真菌GS-1挥发性物质处理的灰葡萄孢菌丝Fig.1 Observations of B.cinerea hyphae treated with VOCs from aroma-producing fungus GS-1 strain by scanning electron microscope
透射电镜观察,对照组灰葡萄孢菌丝细胞的细胞壁及细胞膜连续且较为完整,细胞质质地较均匀,空洞较少(图2A),经产香真菌GS−1挥发性物质处理后的灰葡萄孢菌丝细胞的细胞质疏散、紊乱,细胞质含量大量减少且出现较多空腔(图2B,C)。

图2 透射电镜观察产香真菌GS-1挥发性物质处理的灰葡萄孢菌丝Fig.2 Observations of B.cinerea hyphae treated with VOCs from aroma-producing fungus GS-1 strain by transmission electron microscope
2.2 产香真菌GS-1挥发性物质释放的时间规律
以正癸烷作为内标物,通过HS−SPME−GC−MS测得产香真菌GS−1挥发性物质释放时间规律曲线图如图3所示。挥发性物质释放量随培养时间的延长总体呈先升高后略降低逐渐趋于平稳的趋势。在第12 d达到最大峰值,日释放量为36.121×10−3μL,之后逐步降低并趋于平稳,从第14~21 d维持在21.792×10−3~25.077×10−3μL。

图3 产香真菌GS-1挥发性物质释放量时间动态变化Fig.3 Temporal dynamics change of releasing amount of VOCs from aroma-producing fungus GS-1
2.3 产香真菌GS-1挥发性物质化学组分分析
产香真菌 GS−1菌株挥发性物质经HS−SPME−GC−MS法吸附收集、分析化学组分,其总离子流图如图4所示。各组分相对含量通过色谱峰面积归一法测定,质谱图经NIST17质谱数据库检索,并与标准图谱核对,结合CAS号分析鉴定各组分。结果显示,从菌株GS−1挥发性物质中分离到34个化学组分,鉴定其中 18个组分,占挥发性物质总量的 72.78%,其中[3S−(3α,3aβ,5α)]−1,2,3,3a,4,5,6,7−八氢−α,α,3,8−四甲基−5−薁甲醇相对含量最高,占挥发性物质总量的 34.222%,其次是表荜澄茄油烯醇和α−广藿香烯,分别占挥发性物质总量10.701%和5.597%等(表1)。18种已鉴定的化合物种,薁类化合物7种,相对含量达49.57%。
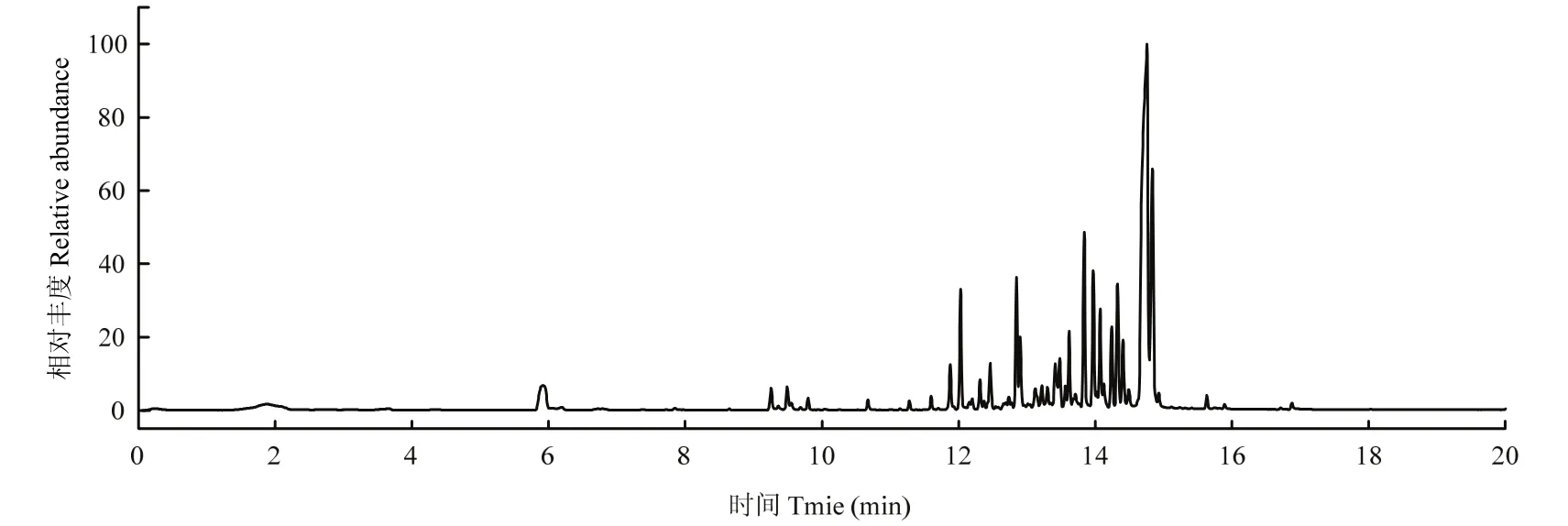
图4 产香真菌GS-1挥发性物质总离子流图Fig.4 Total ion chromatogram of VOCs from aroma-producing fungus GS-1 by GC-MS

表1 产香真菌GS-1挥发性物质组分Table 1 Chemical components of VOCs from aroma-producing fungus GS-1 strain
3 讨论
植物挥发性物质抑菌作用机理主要包括作用于细胞壁、细胞膜、核酸、蛋白质等造成不可逆的损失,作用于能量系统或代谢系统诱导活性氧积累介导细胞凋亡等[17,19]。植物挥发性物质对细胞的破坏会首先作用于细胞膜、破坏通透性,进而侵入细胞内部引起细胞器损伤,从而影响细胞的生理功能[17]。相比植物挥发性物质,微生物挥发性物质抑菌作用机理研究较少,但表现出类似的作用过程。微生物挥发性物质中的部分化合物,如萜烯类化合物,能够破坏细胞膜的完整性和稳定性,增加细胞膜通透性,从而导致细菌和真菌死亡[20,21]。透射电镜观察核盘菌S.sclerotiorum菌丝细胞,发现被根围细菌产生的挥发性物质处理后,细胞膜与细胞壁分离,细胞质中空腔增大,数量增多,细胞质堆积物增多,线粒体数量增加,线粒体的嵴过度增大[22]。植物内生真菌Nodulisporiumsp.和Hypoxylonanthochroum产生的挥发性物质处理尖孢镰刀菌F.oxysporum菌丝后,菌丝呼吸作用受到抑制,细胞膜渗透性增强,同时显微观察到菌丝形态和结构遭到破坏,细胞质中空腔增大,数量增多[23]。利用产香真菌 GS−1与灰葡萄孢对扣试验,通过显微观察菌丝形态及菌丝细胞内部结构,发现菌株 GS−1挥发性物质也主要通过使菌丝畸形、细胞质外渗、细胞质中空腔增多等表现其抑菌作用,而细胞膜系统也可能是其靶标之一。
从菌株GS−1挥发性物质中分离到34个化学组分,本研究鉴定了其中18个组分。现有的质谱数据库中包含真菌产生的化合物较少[7],也即真菌挥发性物质中有较多的新化合物,因此菌株 GS−1挥发性物质中尚有16种化合物未鉴定,包括3种相对含量大于3%的组分。挥发性物质表现出的抑菌效果是由混合物中的多种化学组分协同作用[24],其中主要化学组分一般都具有抑菌活性。在已有较深入研究的麝香霉Muscodorspp.产生的挥发性物质中,很多化合物都具有抑菌活性,如β−石竹烯及其氧化物、3−甲基−1−丁醇乙酯等[24,25]。[3S−(3α,3aβ,5α)]−1,2,3,3a,4,5,6,7−八氢−α,α,3,8−四甲基−5−薁甲醇在真菌挥发性物质中被鉴定出的频率较少,抑菌活性研究鲜有报道。在哈茨木霉Trichodermaharzianum的挥发性物质中鉴定出[3S−(3α,3aβ,5α)]−1,2,3,3a,4,5,6,7−八氢−α,α,3,8−四甲基−5−薁甲醇,但相对含量较少(1.11%)[26]。广藿香烯极性小、类似物多、结构差异小、分离难度大,虽然在真菌挥发性物质中被鉴定出的频率较多,但同分异构体抑菌活性研究受限。在娄地青霉Penicilliumroqueforti的挥发性物质中鉴定出较多的β−广藿香烯、γ−广藿香烯以及同分异构体[27]。在腐皮壳属Diaporthespp.具有抑菌活性的挥发性物质中也鉴定出少量广藿香烯(0.45%)[28]。[3S−(3α,3aβ,5α)]−1,2,3,3a,4,5,6,7−八氢−α,α,3,8−四甲基−5−薁甲醇和α−广藿香烯均为薁类化合物,且在已鉴定的组分中薁类化合物多达7种,相对含量达49.57%,已知薁类化合物都具有较强的消炎、抑菌、抗肿瘤等生物活性[29]。表荜澄茄油烯醇在担子菌Pleurotuscystidiosus、P.eryngii、Piptoporus betulinus、Fomitopsispinicola等中鉴定出的较多[30,31]。作为废弃清酒雪松木桶挥发性物质主要组分,表荜澄茄油烯醇对红色毛癣菌Trichophytonrubrum具有很强的抑菌活性,能够抑制菌丝生长和细胞DNA聚合酶的活性[32]。
微生物挥发性物质的抑菌效果除与其活性物质有关外,也受其挥发性物质总量的影响[10]。微生物挥发性物质的释放是一个动态过程,挥发性物质的成分、种类、含量等因温度、pH、碳源、培养时间等不同而变化[2]。本研究以正癸烷作为内标,利用HS−SPME−GC−MS对产香真菌GS−1挥发性物质定量分析,发现随着时间的推移,挥发性物质总量呈先升高后略降低逐渐趋于平稳的趋势,第12 d达到最大值,这种趋势可能与该菌生长、产孢到其生长衰退的整个过程相对应。在挥发性物质总量达到最大时,可明显观察到大量分生孢子的产生,且在12 d后,由于相当数量的分生孢子存在,其挥发性物质的释放量仍维持在较高水平。菌株GS−1挥发性物质释放量与其生物学特性的关系有待进一步研究,以便优化菌株GS−1挥发性物质产生和收集的方法体系。

