西花蓟马FoccOBP3的分子克隆、序列分析及表达特征
张治科,虎 花,马 荣
(1.宁夏农林科学院植物保护研究所宁夏植物病虫害防治重点实验室,银川 750002;2.宁夏大学农学院,银川 750021;3.中国农业科学院农业资源与农业区划研究所,北京 100081)
长期的生物进化中昆虫形成了高度灵敏、复杂、特有的嗅觉感受系统,使昆虫能够特异性地识别环境中的气味物质,从而进行觅食、趋避、交配等相应的行为反应[1,2]。嗅觉相关蛋白在昆虫特异性识别外界环境信号中发挥着重要作用,气味结合蛋白(odorant binding proteins,OBPs)是昆虫嗅觉系统中发挥重要作用的蛋白之一,主要存在于触角嗅觉感受器胞外空间的淋巴液内,由位于嗅觉感器旁边的支持细胞合成,选择性地结合并运送通过昆虫触角嗅觉感器上的微孔进来的脂溶性气味分子,通过触角感器水溶性淋巴液至嗅觉神经元树突,从而激活树突膜上的嗅觉受体(odorant receptors,ORs)[3,4],引发昆虫嗅觉系统感知外界环境的初期反应[5,6]。昆虫 OBPs通常分为信息素结合蛋白(pheromone binding proteins,PBPs)和普通气味结合蛋白(general odorant binding proteins,GOBPs),能够专一性识别外界中的气味物质,在气味分子和气味受体之间起到桥梁作用,在嗅觉感受系统中发生第一步生化反应[7],大多由135~220个氨基酸组成,是一类分子量约为14~17 kDa、pH 5.0左右的球状蛋白[6]。典型OBPs结构中存在的六个保守的半胱氨酸位点[8]形成蛋白三维结构中成对出现的3个二硫键并对蛋白三维结构起到稳固作用[9]。
西花蓟马Frankliniellaoccidentalis(Pergande),也叫苜蓿蓟马,隶属缨翅目 Thysanoptera锯尾亚目Terebrantia蓟马科Thripidae花蓟马属Frankliniella,最早主要分布在美国西部,严重危害花卉等植物[10],后来随着国际贸易的日益频繁,传播扩散到欧洲、非洲、亚洲、美洲、大洋洲等[11,12],对部分地区农作物造成毁灭性危害,成为世界性农林检疫害虫。我国于 2003年在北京温室的辣椒上首次发现西花蓟马[13],随后在云南[14]、山东[15]、浙江[16]、贵州[17]、新疆[18]、宁夏[19,20]等多个省份陆续报道。西花蓟马属渐变态昆虫,可营有性生殖和孤雌生殖[21],个体微小、繁殖快、多食性、寄主多[22],在我国适生区广泛[23-25]。该虫采用锉吸式口器取食,挫伤植物茎、叶、花和果的组织,甚至造成植株枯死,雌虫还可用产卵器刺破植物表皮,产卵于组织中,严重影响蔬菜、花卉等植物的产量和品质[26],还可传播番茄斑萎病毒[27]、花生环斑病毒[28]等,且易产生抗药性[29],对有机氯、有机磷、拟除虫菊酯、氨基甲酸酯、多杀菌素和阿维菌素[30,31]等产生了一定的抗药性[32,33]。可见,生态环境友好型并能持续有效防控的生物防治措施迫在眉睫。针对西花蓟马种群生物学[34]和生态学特征[35,36]以及防治[37]等方面的研究较多,有关西花蓟马化学生态学研究报道仍较少,主要有丁艳红[38]鉴定了一个化学感受蛋白和一个信息素结合蛋白,确定了其时空表达谱。Zhang等[39]开展了西花蓟马部分嗅觉相关蛋白研究[40-43],鉴定了2个化学感受蛋白基因并测定了其表达谱、结合特性,开展了免疫电镜定位,鉴定了 1个气味结合蛋白基因并测定了其表达谱;Zeng等[44]鉴定了一个化学感受蛋白和一个信息素结合蛋白,明确了这两个基因表达量与性别以及成虫的年龄有关。可见,有关西花蓟马气味结合蛋白的研究相对较少。鉴定西花蓟马 OBP并开展其生理功能研究,有助于揭示西花蓟马寄主定位的分子机制,为进一步开辟防控新途径奠定基础。本文鉴定了西花蓟马OBP基因FoccOBP3,分析其核苷酸和氨基酸序列特征,测定基因表达谱,预测蛋白结构,初步推测该蛋白基因所具有的生理功能,为阐明西花蓟马寄主定位的分子机制提供依据。
1 材料与方法
1.1 供试虫源
西花蓟马由中国农业科学院植物保护研究所蔬菜害虫组提供,在 MLR−351H三洋培养箱中用新鲜豆角饲养,饲养条件为温度(26±1)℃、相对湿度(65±5)%和光周期14L:10D。
1.2 主要仪器
FastPrep−24型样品研磨系统购自MP Biomedicals公司,H6−1微型电泳槽购自上海精益有机玻璃制品仪器厂,Biodoc−It 220型凝胶成像系统购自美国UVP公司,HC−2518R高速冷冻离心机购自安徽中科中佳仪器有限公司,U−3010紫外−可见分光光度计购自Hitachi公司,BioTek酶标仪Instrument ELx800购自北京北方仪涛商贸有限公司,核酸蛋白测定仪NanoDrop 2000(Thermo Scientific,USA)购自美国热科学公司,ABI PRISM 7500 Real−Time PCR System购自Applied Biosystems公司。
1.3 总RNA提取及反转录
将二氧化碳麻醉后的羽化1 d的西花蓟马,在解剖镜下快速切取触角置于浸入液氮中的1.5 mL离心管,研磨后用TRIzol试剂提取RNA,溶于DEPC水中,用1.5%的琼脂糖凝胶检测其完整性,用核酸蛋白测定仪检测RNA的浓度和纯度,以 Oligo (dT)引物合成cDNA第一链。
用于不同发育阶段及不同组织基因表达测定时,取1、2龄若虫,蛹,羽化1、5、10、15 d雌、雄成虫,以及快速切取经二氧化碳麻醉后的羽化1 d的西花蓟马触角、足、头、胸、腹,分别置于浸入液氮中的1.5 mL离心管中,生物学重复3次,RNA提取及cDNA第一链合成同上。
1.4 FoccOBP3全长cDNA序列克隆
生物信息学分析西花蓟马转录组数据以及 NCBI序列比对,获取FoccOBP3基因序列片段。扩增FoccOBP3cDNA序列:以cDNA第一链为模板进行PCR扩增,设计目的基因序列3′ RACE、5′ RACE片段特异性引物(表1),用TaKaRa FullRACE扩增基因3′、5′−末端cDNA序列。反应程序如下:10×Ex Taq Buffer 2.5 μL,cDNA 2 μL,MgCl2(25 mmol/L)2 μL,正反引物各 1 μL,TaKaRa Ex Taq(5 U/μL)0.25 μL,dNTPMix(2.5 mmol/L each)2 μL,ddH2O 14.25 μL。反应条件为 95 ℃预变性 3 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min,4 ℃保存。用1.5%琼脂糖凝胶电泳检测扩增产物,用AxyPrepTMDNA gel extraction kit回收纯化目的条带,与pEASY−T1克隆载体连接并转化到Trans1−T1感受态细胞,经氨苄青霉素培养基筛选,挑选阳性克隆子扩大培养后进行测序。将测序正确结果用DNAMAN 6.0拼接得到基因全长cDNA序列。
1.5 序列分析、蛋白系统进化树构建和结构预测
核苷酸序列的基本物理性状使用Expasy进行预测分析;序列同源相似性利用NCBI的BLASTx程序分析;信号肽利用SignaIP 3.0 Serve预测;蛋白亲脂性用Kyte等的方法分析;蛋白序列的同源相似性采用软件ClustalX 1.83进行比对;蛋白二级和三级结构分别采用Chou & Fasman 和Swiss−PDB Viewer 4.1进行预测;蛋白的系统发育进化树用MEGA 6.0的neighbor−joining经bootstrap 1000次重复抽样分析。
1.6 FoccOBP3的时空表达测定
在保守序列区设计目的基因和内参基因β−actin(GenBank登录号:GQ290644.1)特异引物(表1)。qRT−PCR 反应体系共 20 μL:GoTaq®qPCR Master Mix(2×)10 μL,正反引物各 0.5 μL,cDNA 2 μL,无核酸酶水7 μL。采用两步PCR标准法,扩增程序为95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。PCR产物熔解曲线测定程序为95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s,60 ℃ 15 s。以超纯水作为阴性对照。样品重复3次,生物学重复3次。采用2−ΔΔCt相对定量法进行该基因的时空表达分析。分别以1龄若虫表达量和触角表达量为标准参量,检测其他发育阶段和组织中该基因的表达量。

表1 试验所用的引物Table 1 Primer sequences of this experiment
2 结果与分析
2.1 FoccOBP3序列测定和分析
克隆并鉴定获得一个西花蓟马OBP的全长cDNA序列,命名为FoccOBP3。FoccOBP3基因cDNA序列全长为1226 bp,5′末端非编码区423 bp,读码框全长432 bp,共编码143个氨基酸残基,3′末端非编码区 371 bp,具有真核生物典型的 polyA加尾。氨基酸序列中 6个保守的半胱氨酸位点排列方式为C1−X26−C2−X3−C3−X37−C4−X10−C5−X8−C6,完全符合典型气味结合蛋白所具有的 6 个保守的半胱氨酸位点结构模型:C1−X20−66−C2−X3−C3−X21−43−C4−X8−14−C5−X8−C6(图 1)。氨基酸序列中有 5 个亲脂性区域(图2),其中第62~75位的氨基酸残基形成的C区域最为明显。预测该蛋白分子量约为15.50 kD,等电点为5.24,N−末端包含21个氨基酸组成的信号肽序列。

图1 FoccOBP3核苷酸序列及相应的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence of FoccOBP3
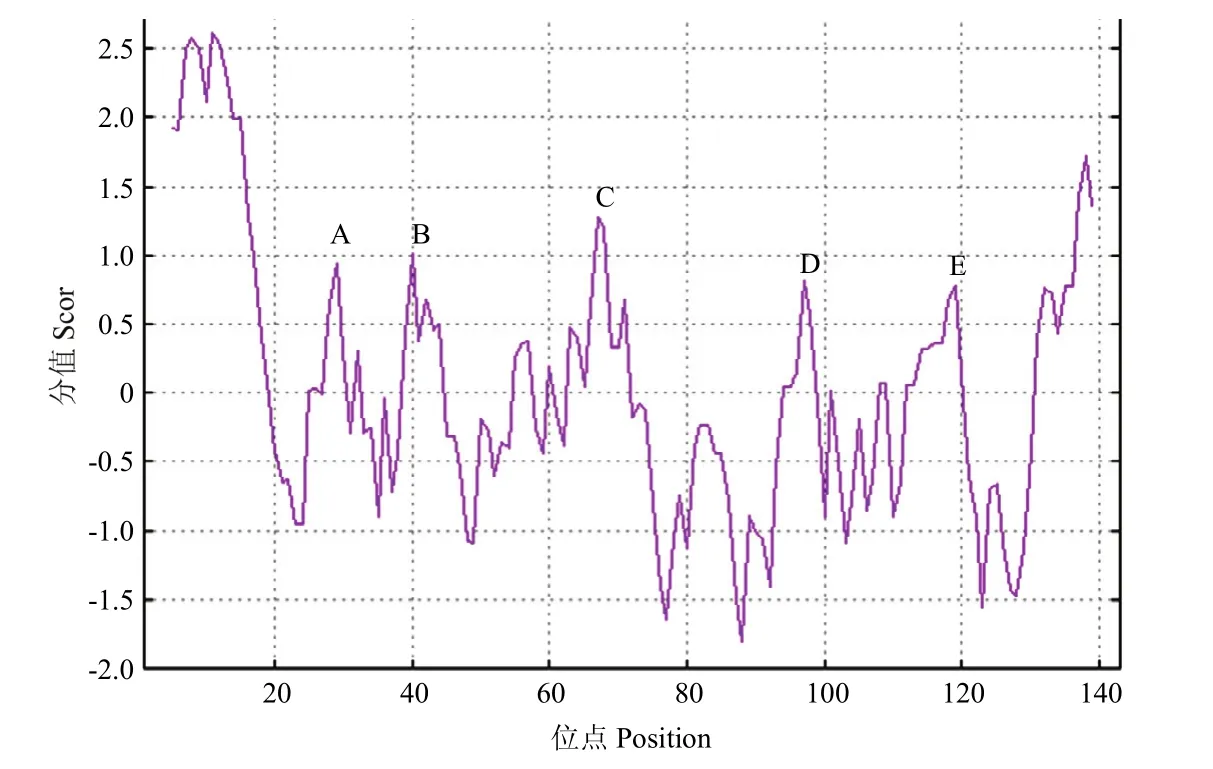
图2 FoccOBP3氨基酸亲脂性分析Fig.2 Predicted hydrophobicity profiles for the deduced amino acid sequences of FoccOBP3
2.2 FoccOBP3氨基酸序列比对
利用BLAST对FoccOBP3气味结合蛋白进行同源相似性搜索,结果前100个序列中,隶属双翅目昆虫的最多,占总量的60%,其次是膜翅目和鞘翅目的,分别占19%和10%,其余为鳞翅目、半翅目、直翅目和同翅目的。而且,FoccOBP3氨基酸序列与这些昆虫的一致性为 21%~36%,其中一致性最高的是横缝茧蜂Diachasmaalloeum的DallGOBP、赤拟谷盗Triboliumcastaneum的TcasPBP和TcasOBP07,其次是豌豆长管蚜Acyrthosiphonpisum的ApisGOBP,相似性为35%,这说明FoccOBP3与这些气味结合蛋白基因有较高的同源一致性。与致倦库蚊Culexquinquefasciatus的CquiOBP(与尖音库蚊Culexpipienspallens的CpalOBP5一致性为34%,与红火蚁Solenopsisinvicta的SinvGOBP和灰地种蝇Deliaplatura的DplaOBP1一致性为33%,表明与这些OBP序列也有较高的同源性。随机选取10个不同目昆虫的OBP 以及FoccOBP3进行多序列比对。结果表明,FoccOBP3与这些基因的一致性虽不高,但6个保守的半胱氨酸位点完全一致,而且第二个保守半胱氨酸位点的前一个氨基酸多为赖氨酸(K)、第五个保守半胱氨酸位点后的第三个氨基酸多为丙氨酸(A)、第六个保守半胱氨酸位点后的第六个氨基酸多为脯氨酸(P),进一步确定克隆所得蛋白基因是OBP基因(图3)。
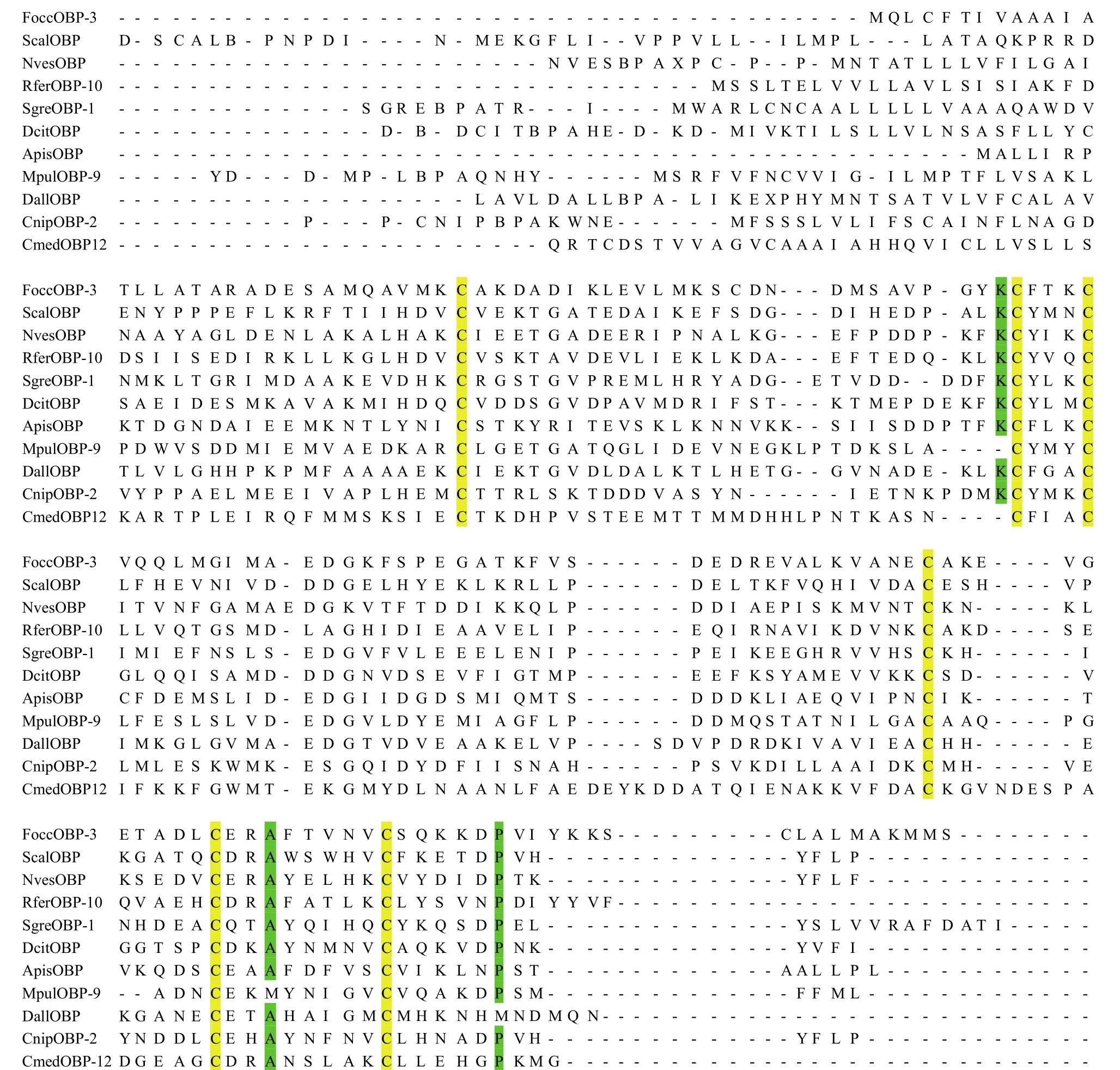
图3 FoccOBP3与其他目昆虫的OBP序列比对Fig.3 Alignment of FoccOBP3 with other order insect OBP
系统发育进化树结果可见,FoccOBP3与31个双翅目、8个膜翅目、2个脉翅目、2个鞘翅目、1个鳞翅目、1个直翅目以及1个同翅目的OBP聚类在一个大分支,其中与鞘翅目埋葬甲科埋葬甲虫Nicrophorusvespilloides的NvesGOBP(XP_017781594.1)聚在最小的一个分支,表明与该基因亲缘关系最近,可能来源于同一个祖先基因。其次是鞘翅目拟步甲科赤拟谷盗Triboliumcastaneum的TcasOBP7(GenBank登录号为EFA04593.1)、同翅目木虱科柑桔木虱Diaphorinacitri的DcitOBP(XP_008470659.1),亲缘关系也较近。FoccOBP3与来自同种的FoccOBP1、FoccOBP2并没有聚类到一个分支,说明这3个蛋白序列的相似性并不是很高。可以看出与所测蛋白相似性较高的序列都为气味结合蛋白,这与我们将所测的西花蓟马序列归为气味结合蛋白家族相一致(图4)。

图4 基于N-J法的FoccOBP3推测蛋白进化树Fig.4 FocOBP3 speculated protein phylogenetic tree based on N-J method
2.3 FoccOBP3蛋白结构预测
在FoccOBP3氨基酸组成中,丙氨酸含量最多,其次是赖氨酸、缬氨酸、天冬氨酸、谷氨酸、亮氨酸和甲硫氨酸,占总量的50%以上。
由二级结构预测结果可见,FoccOBP3蛋白含有组成α−螺旋的氨基酸残基127个,占整体氨基酸88.8%,形成β−折叠的氨基酸残基58个,占40.5%,形成β−转角的氨基酸残基有15个,占10.5%。由此可见,FoccOBP3是以α−螺旋为主,其次是β−折叠,转角含量较少(图5)。

图5 预测的FoccOBP3二级结构Fig.5 Predicted secondary structure of FoccOBP3
采用与 FoccOBP3一致性最高的冈比亚按蚊 AgamOBP7(登录号 3R1O_A)序列为模板,构建了FoccOBP3的三维结构。可以看出,该蛋白骨架是由 6 个α−螺旋和连接这些螺旋的回折构成。通过对该三维结构的动态化观察发现其中5个α−螺旋形成一个结合口袋,主要是由蛋白分子内部的疏水性和外部的亲水性氨基酸残基组成,另外一个α−螺旋处于结合口袋的顶部(图6)。
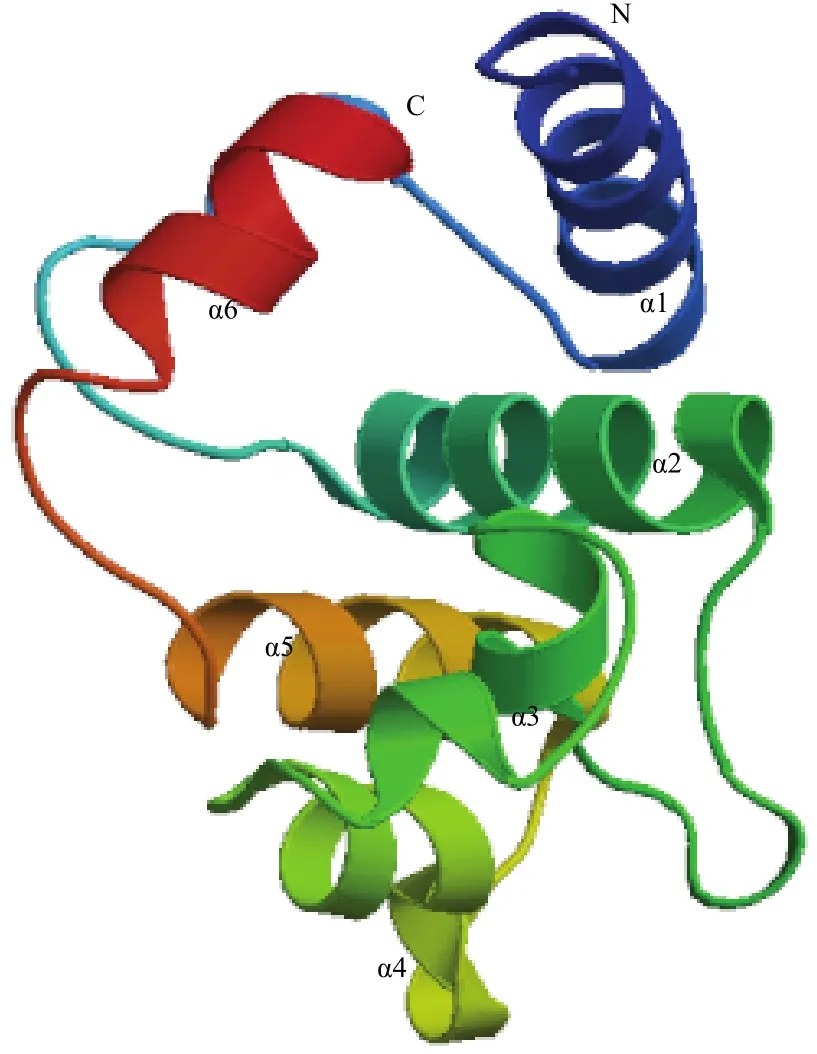
图6 预测的FoccOBP3三级结构Fig.6 Predicted three-dimensional model of FoccOBP3
2.4 FoccOBP3表达特征分析
测定了FoccOBP3基因在西花蓟马不同发育阶段中的表达差异。结果可见,1龄若虫时基因的相对表达量最高,显著高于其他发育阶段(P<0.05),其次是羽化5 d雌虫的,相对表达量为标准参量的0.12倍,2龄若虫和羽化1 d雌虫的相对表达量均为标准参量的0.09倍,羽化15 d雌虫的相对表达量为标准参量的0.05倍,其余各个发育阶段的表达量均较低,为标准参量的0.02~0.03倍。在雌、雄成虫中的表达量亦有差异,除了羽化10 d的,羽化1、5、15 d雌虫的表达量均比同发育阶段雄虫的高,尤其羽化5 d的雌虫中表达量为雄虫中的4.3倍之多(图7)。
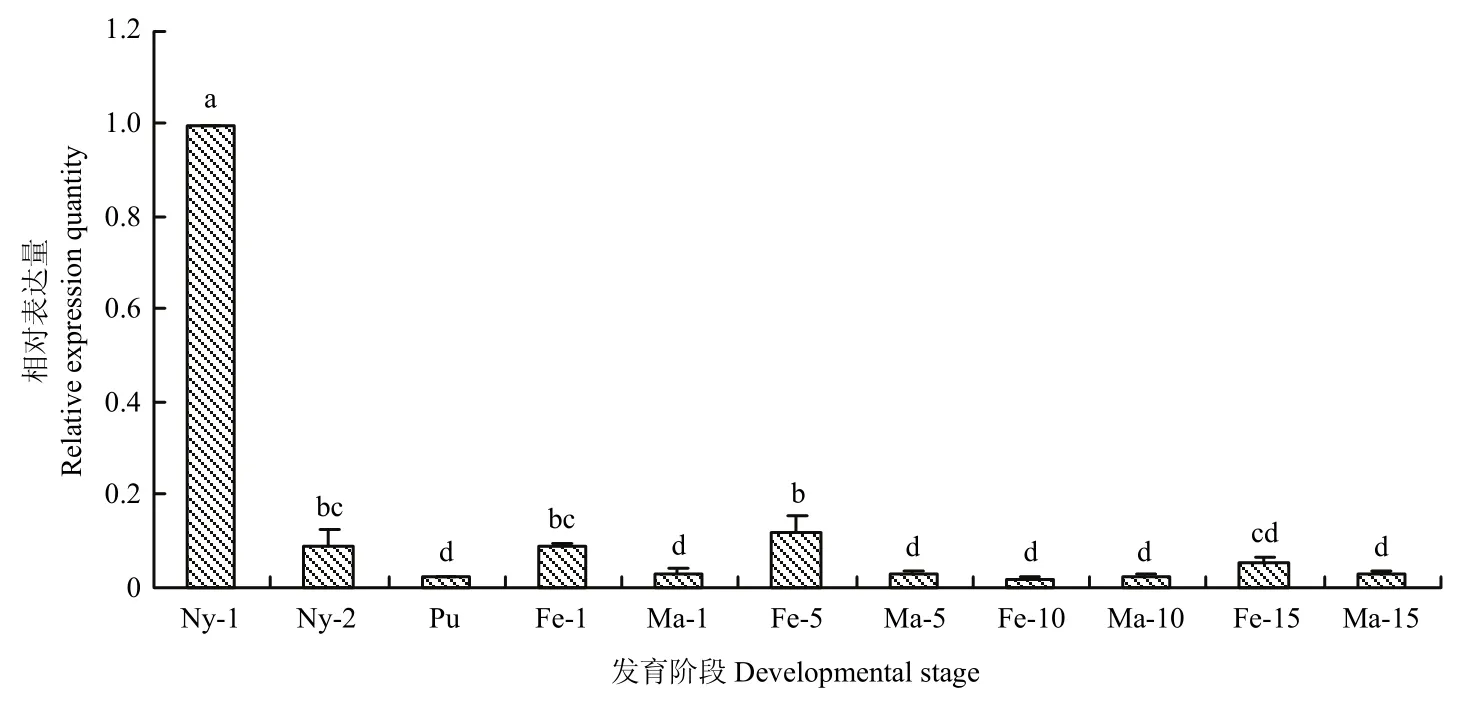
图7 FoccOBP3在西花蓟马不同发育阶段的相对表达量Fig.7 The relative expression level of FoccOBP3 in F.occidentalis different developmental stages
FoccOBP3在成虫的不同组织中表达量也不同。触角中该基因的表达量最高,极显著高于其他组织(P<0.01),其次是头部,其相对表达量为标准参量的0.74倍,极显著高于胸、腹和足中的表达量(P<0.01);腹、足中的基因表达较低,胸部的基因表达量最低,仅为标准参量的0.01倍(图8)。
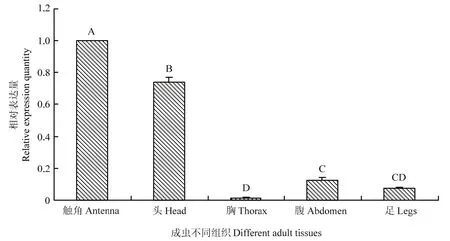
图8 FoccOBP3在西花蓟马初羽化成虫不同组织中的相对表达量Fig.8 The relative expression level of FoccOBP3 in different F.occidentalis adult tissues
3 讨论
随着分子生物学相关技术的迅速发展,隶属鳞翅目[45]、双翅目[46]、鞘翅目[47]、膜翅目[48]等越来越多的昆虫OBP陆续被鉴定出来,仅在中华按蚊Anophelessinensis中鉴定了64个OBPs[49],在家蚕Bombyxmori中鉴定了四十多个OBPs[50],但报道的缨翅目昆虫的OBPs较少。本研究克隆并鉴定一西花蓟马气味结合蛋白基因FoccOBP3,符合典型OBPs的结构特点[51]。OBPs蛋白序列间的相似性差异较大,有些序列间相似性可达90%以上,有些不足10%。有文献报道[42],与西花蓟马气味结合蛋白基因FoccOBP1同源相似性最高的序列为37%,而且是半翅目苜蓿盲蝽Adelphocorislineolatus的AlinOBP5、绿盲蝽Apolyguslucorum的AlucOBP8和牧草盲蝽Lyguslineolaris的LlinOBP2。本研究FoccOBP3经同源相似性比较,与其序列相似性最高的 OBP仅为 36%,而且是膜翅目横缝茧蜂的 DallGOBP、鞘翅目赤拟谷盗的 TcasPBP和TcasOBP07,并不是缨翅目昆虫的。经系统发育进化树分析,FoccOBP3与 31个双翅目、8个膜翅目、2个脉翅目、2个鞘翅目、1个鳞翅目、1个直翅目以及1个同翅目的OBPs聚类在一个大分支,其中与鞘翅目埋葬甲虫的NvesGOBP聚在最小的一个分支,亲缘关系相比最近,可能来源于同一个祖先基因。况且,FoccOBP3并没有与来自同种的FoccOBP1和FoccOBP2聚在同一个分支,有趣的是FoccOBP1 与FoccOBP2也位于不同的分支。可见,OBPs蛋白序列相似性差异较大,有些序列相似性较高,能达到90%以上,即便来自不同种的昆虫;而有些序列相似性却很低,会低于10%,即便来自同一种昆虫。
采用X射线衍射、核磁共振技术以及同源模建等技术研究昆虫OBPs的三维结构,能够更加直观的分析OBPs的具体结构特征,对深入研究其功能发挥举足轻重的作用。家蚕BombyxmoriLinnaeus的BmorPBP是第一个成功解析的昆虫OBP三维结构[52]。昆虫OBPs的6个α−螺旋结构形成的三维结合腔,通常认为可能是与外界气味物质结合的部位,而且气味物质进出结合腔会与触角感器淋巴液的pH值[53]、气味分子的构象[54]、蛋白结合腔开口附近的亲水性氨基酸残基[55]等一些因子密切相关。本研究采用与FoccOBP3序列一致性最高的冈比亚按蚊AgamOBP7的序列为模板,成功构建了FoccOBP3的三维结构,该蛋白骨架是由6个α−螺旋和连接这些螺旋的回折构成,通过对该三维结构的动态化观察发现,其中5个α−螺旋形成一个结合口袋,主要是由蛋白分子内部的疏水性和外部的亲水性氨基酸残基组成,另外一个α−螺旋处于结合口袋的顶部,为进一步明确该蛋白基因的具体功能奠定了基础。
昆虫OBPs分布多样,有的主要分布于触角中,如亚洲玉米螟Ostriniafurnacalis的OfurPBP3[56]、棉铃虫Helicoverpaarmigera的 HarmPBPs[57]、小地老虎Agrotisipsilon的 AipsPBPl−3[58]、光肩星天牛Anoplophoraglabripennis的AglaOPB12[59]、铜绿丽金龟AnomalacorpulentaMotschulsky的AcorOBP1[60]、甘薯蚁象Cylasformicarius的CforOBP8[61]、中红侧沟茧蜂Microplitismediator的MmedOBP18[62]等,其中中红侧沟茧蜂的MmedOBP18 主要表达在触角锥形感器Ⅰ内的淋巴液中[62]。有些OBPs也在昆虫其他组织中表达,如埃及伊蚊Aedesaegypti的AaegOBP在精囊、喙、气门中表达[63]、梨小食心虫Grapholitamolesta的 GmolOBP3 在腹部高表达[64]、小菜蛾Plutellaxylostella的 PxylOBP2在足中高表达[65]、棉铃虫的HarmOBP16在雌成虫翅中高表达[66]、异色瓢虫Harmoniaaxyridis的HaxyOBP1在雄虫头部表达量最高[67]、异色瓢虫的HaxyOBP6在雄成虫头部和雌成虫翅中高表达[67]等。本研究发现FoccOBP3在西花蓟马成虫触角中表达丰度最高,其次是头部,其他组织中较低,推测该基因可能在西花蓟马识别外界挥发性化合物中发挥重要作用。
OBPs在昆虫不同发育阶段中的表达有差异,如异色瓢虫的HaxyOBP6在成虫期的表达量明显高于幼虫阶段[67]、铜绿丽金龟的AcorOBP1在卵、1龄幼虫和成虫等特定发育时期表达[60]、大螟Sesamiainferens的SinfGOBP1和SinfGOBP2在雌虫中的表达量随日龄增加而上升[68]、苜蓿盲蝽Adelphocorislineolatus的Alin−OBP1在5龄若虫和成虫阶段高表达[69]、甜菜夜蛾SpodopteraexiguaHübner的SexiOBP13仅在幼虫期表达[70]等。本研究发现FoccOBP3主要在西花蓟马1龄若虫期表达,显著高于其他发育阶段,该结果与铜绿丽金龟的AcorOBP1[60]、甜菜夜蛾的SexiOBP13等气味结合蛋白基因的表达结果相似[70],由于西花蓟马1龄若虫期短,大多属于初孵若虫,急需取食补充营养,另外,前面也已阐述在触角中表达量高,由于普通OBPs主要感受外界植物挥发性化学物质等普通环境信号气味物质[8],且主要分布于锥型感器中[71],本试验室前期研究发现西花蓟马触角上分布多种锥形感器。因此,推测该基因在1龄若虫的寄主定位、觅食等方面可能发挥重要作用。有些 OBPs的表达还与昆虫雌雄性有关,如小菜蛾Plutellaxylostella的PxylOBP31主要在雄蛾中表达[72]、异色瓢虫的HaxyOBP1和HaxyOBP6主要在雄性成虫中高表达[67]。本研究发现FoccOBP3在西花蓟马雌性成虫中的表达量通常比同期发育阶段的雄性成虫的高,推测该基因有可能参与西花蓟马性信息素的合成、交尾、产卵等生殖方面的行为活动。
本研究新克隆并鉴定获得了西花蓟马一气味结合蛋白基因FoccOBP3,明确了该基因核苷酸、氨基酸序列特征。FoccOBP3蛋白骨架是由6个α−螺旋和连接这些螺旋的回折构成。FoccOBP3在西花蓟马1龄若虫中的表达量最高,在相同发育阶段的雌、雄成虫中表达量有差异,且在触角中的表达量最高。推测该基因可能在西花蓟马识别外界挥发性化合物、寄主定位、觅食等方面发挥重要作用,还有可能参与西花蓟马性信息素的合成、交尾、产卵等生殖方面的行为活动,为进一步阐明西花蓟马与寄主间的化学通讯机制提供依据。

