双重实时荧光PCR 法鉴别酸枣仁和理枣仁
杨 宝,郭 星,郑 巍,朱殿龙,裴社强,邓自新,张 烨,李 静
(1.太原市食品药品检验所,山西太原 030006;2.山西省食品药品检验所,山西太原 030006;3.大连市检验检测认证技术服务中心,辽宁大连 116021;4.山西省食品检验技术研究院,山西太原 030012)
0 引言
酸枣仁为鼠李科植物酸枣Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chou 的干燥成熟种子[1]。在我国主要产地为山西、河北、辽宁、内蒙古、陕西、山东。酸枣仁具有养心补肝、宁心安神、敛汗、生津的药效[2]。酸枣仁无毒副作用,是我国35 种贵重中药材之一,也是最早进入药食同源品种目录的中药材之一[3]。近年来,随着酸枣仁野生资源的减少,需求量增加,价格上涨,市场上出现以滇刺枣(Ziziphus mauritiana Lam.)、枳椇子(Hoveni adulcis Thunb.)、兵豆(Lens culinaris Medic.)、紫荆(Cercis chinensis Bge.)的种子掺杂掺伪的现象[4]。其中,理枣仁与酸枣仁性状极为相似,炒制和染色后更加难以区分,但价格仅为酸枣仁1/4,与酸枣仁性状极为相似,理枣仁成为酸枣仁最常见的伪品。其余3 个品种伪品由于性状上差异较大,极少作为掺伪品种。理枣仁为云南省中药饮片标准品种,国内其他省份没有明确规定禁止使用,各省市场均有流通,但无论从传统功效、化学成分、药理作用上2 种中药材均存在差异[5],混用误用都不利于药效的发挥。因此,建立更加快速、可靠、操作简单的酸枣仁鉴别方法对于保护中药材种植户权益、保障酸枣仁药材的质量及用药安全具有重要意义。
目前,对于酸枣仁的鉴别研究多采用药材性状[6]、显微特征[7]、薄层色谱[8]、电泳[9-10]、紫外光谱[11-12]、扫描电镜[13]等传统鉴别方法。近年来,分子生物学检测技术从基因水平对酸枣仁及其伪品进行鉴定,与常规检测方法相比,其具有特异性强、灵敏度高、有效降低污染率、连续快速、操作简单易于掌握等特点,已报道的有DNA 条形码[14-16]、普通PCR 检测技术[17]实时多重实时荧光PCR 技术在酸枣仁及其常见伪品理枣仁真伪鉴定方面尚无相关报道。李桂林等人[17]开发的PCR 检测方法,仅能鉴别出是否是酸枣仁正品,不能在同一反应体系同时鉴别酸枣仁及其伪品理枣仁。实时荧光PCR 检测技术操作简便,无需电泳即可自动化获得检测结果,并进行快速定性定量分析[18-20]。而多重实时荧光PCR 通过检测不同的荧光信号还可以在一次反应中同时检测多种靶点,实现快速高通量的检测[21-23]。
拟采用基于Taqman 多重实时荧光PCR 方法对中药材酸枣仁中掺伪成分进行鉴别和检测,针对酸枣仁及其常见掺伪成分理枣仁,设计不同荧光标记特异性探针,建立主成分酸枣仁及常见掺伪成分理枣仁的双重实时荧光PCR 检测方法,形成高灵敏度、高特异性和高通量的酸枣仁及其制品掺伪成分理枣仁的快速检测技术。弥补市场对于酸枣仁中药材检测技术的缺口和需求,为市场、生产企业和监管部门提供精准、快速、高效率、高通量的基因组学检测方法。
1 材料与方法
1.1 材料
共收集酸枣仁样品14 份,理枣仁样品10 份,枳椇子、紫荆子、兵豆各1 份,样品产地及来源于河北安国、安徽亳州、广西玉林、大连市检验检测认证技术服务中心、太原市药店和饮片生产企业等地,由大连市检验检测认证技术服务中心朱殿龙副主任药师鉴定。
样品信息见表1。
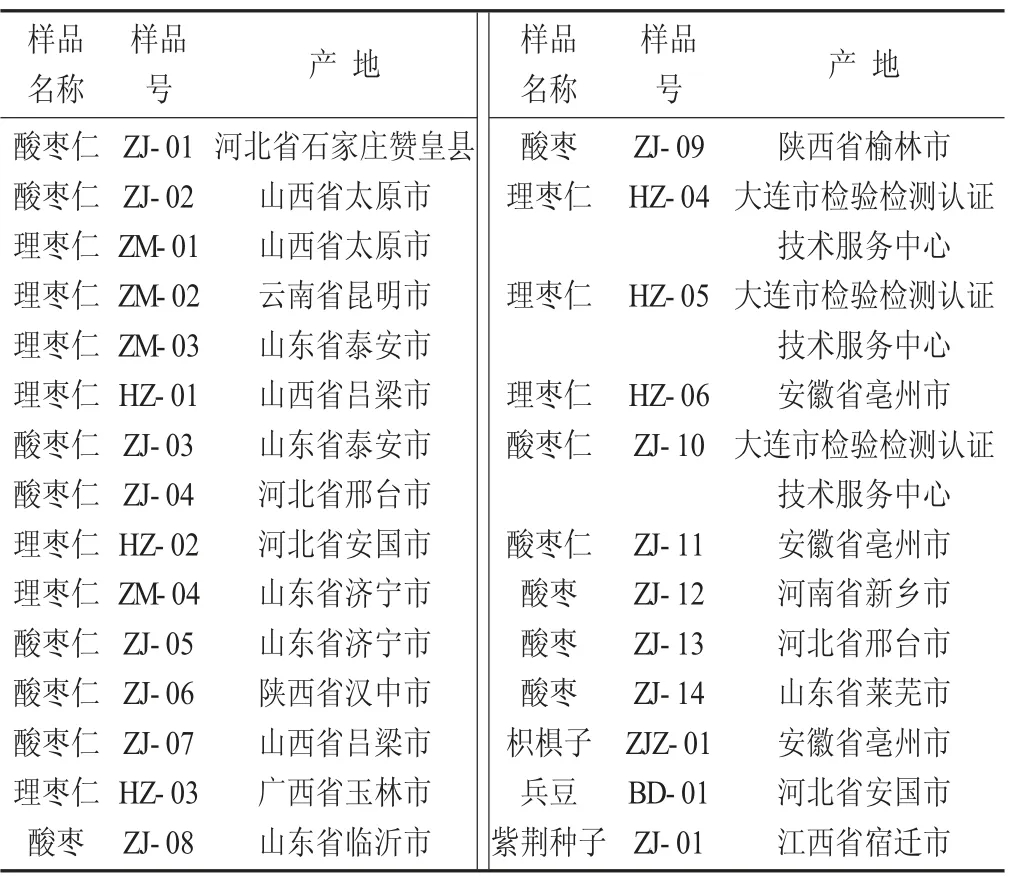
表1 样品信息
1.2 试剂与设备
香港力康Neofuge 13R 高速冷冻离心机;Eppendorf 微量核酸分析仪;美国热电ABI7500fast 荧光定量PCR 仪;BIO-RAD C1000 TOUCH 梯度PCR仪;Power Pac Basic 电泳仪;美国伯乐凝胶成像系统;植物基因组DNA 提取试剂盒(TIANGEN,Cat#305);上海生工生物公司合成的引物、探针;TaqManTMMultiplex Master Mix(ABI,NO.4461881)。
1.3 试验方法
1.3.1 样品DNA 提取
为了避免污染,样品用75%酒精棉球将表面擦拭干净、晾干,用球磨仪粉碎成细粉状,称取20 mg置于灭菌的2 mL 离心管中。采用TIANGEN 提取试剂盒提取样本DNA,用核酸分析仪测定DNA 的纯度及质量浓度,将OD260/OD280 在1.7~1.9,且质量浓度达到10~100 ng/μL 的DNA 溶液作为模板DNA,-20 ℃下保存备用。
1.3.2 ITS2 引物PCR 扩增检测测序
将样品DNA 用ITS2 通用引物进行PCR 扩增,反应体系20 μL(见表2)。PCR 反应条件:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,40 个循环,72 ℃延伸5 min,12 ℃下保存。进行琼脂糖凝胶检测,观察是否能够产生扩增条带,将扩增成功的样品进行测序。
反应体系配制见表2。

表2 反应体系配制
1.3.3 引物的设计与扩增
引物的设计:通过检索NCBI 的数据库和查阅文献后获得酸枣仁、理枣仁及其他常见近源物种序列结合1.3.2 测序结果,使用NCBI 的Primer-Blast,用Snap gene 软件比对,设计出能够用于酸枣仁及其伪品真伪鉴别的实时荧光PCR 检测引物和探针,探针分别使用不同的荧光标记,由上海生工生物公司合成。
酸枣仁及理枣仁正向引物:5'-GCCGCAGCAA TCGGTGG-3';
酸枣仁反向引物:5'-TATTTCGGCCAGCCGCGG-3';
理枣仁反向引物:5'-CGTTTCGGCCAGCCGCGA-3';
酸枣仁探针:5'FAM-ACCTCGACCTCGAGGCGAAGAG-3'BHQ1;
理枣仁探针:5'-VIC-AACCTCCGCCTCGGAAGG G-3'BHQ1。
反应体系配制见表3。

表3 反应体系配制
反应条件为:50 ℃2 min;95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,40 个循环。
1.3.4 特异性试验
将1.3.1 中提取的酸枣仁样品、理枣仁样品及其他样品的DNA 作为模板。按照上述反应体系和条件进行扩增,以水作为空白对照,验证引物和探针对酸枣仁、理枣仁样品扩增的特异性。
1.3.5 样品覆盖度试验
将14 批酸枣仁DNA、10 批理枣仁DNA 为模板,按照1.3.3 进行扩增,以水作为空白对照,进行覆盖度试验。
1.3.6 灵敏度试验
酸枣仁DNA 模板和理枣仁DNA 模板各取50 ng,分别10 倍递减稀释,至10-4,每个梯度做5 个平行试验,按照1.3.3 中反应体系和条件扩增,测试双重实时荧光PCR 方法的绝对灵敏度。
1.3.7 混合样本检测
中国药典2020 年版四部规定,药屑及杂质通常不得超过3%[24],在酸枣仁DNA 模板中分别掺入50%,20%,10%,5%,3%,1%的理枣仁DNA 模板,对上述样品充分混匀,混合样品的DNA 质量浓度在10~40 ng/μL,每个样品做2 个平行,检测样品是否掺入了伪品理枣仁,验证检测方法是否能够应用于样品掺入伪品的检测。
2 结果与分析
2.1 特异性试验
酸枣仁特异性扩增图谱见图1。
由图1 可知,非酸枣仁类样品无明显的FAM 荧光对数扩增曲线,Ct 值均大于40;酸枣仁样品有FAM荧光信号检出,且出现典型的扩增曲线,Ct 值小于35。

图1 酸枣仁特异性扩增图谱
理枣仁特异性扩增图谱见图2。
由图2 可知,非理枣仁类样品无明显的VIC 荧光对数扩增曲线,Ct 值均大于40;理枣仁样品有VIC 荧光信号检出,且出现典型的扩增曲线,Ct 值小于35。
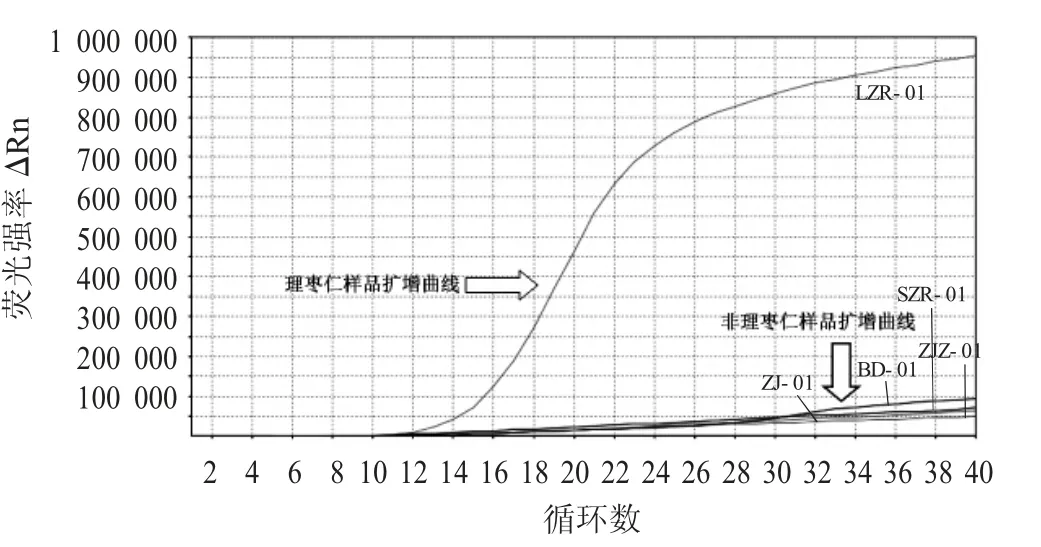
图2 理枣仁特异性扩增图谱
以酸枣仁及其伪品理枣仁为研究对象,设计和筛选了2 种中药材特异性引物探针,扩增结果显示只有对应靶标物种产生荧光对数扩增曲线,扩增Ct值在12~14,与非靶标物种之间未产生扩增反应,说明筛选的引物探针特异性较好。
2.2 样品覆盖度试验
酸枣仁样品扩增图谱见图3,理枣仁样品扩增图谱见图4。

图3 酸枣仁样品扩增图谱
由图3 和图4 可知,经实时荧光PCR 扩增,14酸枣仁样品和10 批理枣仁样品在40 个循环中均相应的荧光对数扩增曲线,酸枣仁样品扩增Ct 值在12~24,理枣仁样品Ct 值扩增Ct 值在10~22 均小于40。双重实时荧光PCR 检测方法可以有效检测出相应靶标物荧光信号,该方法适用于市场上酸枣仁及其伪品理枣仁的鉴别。
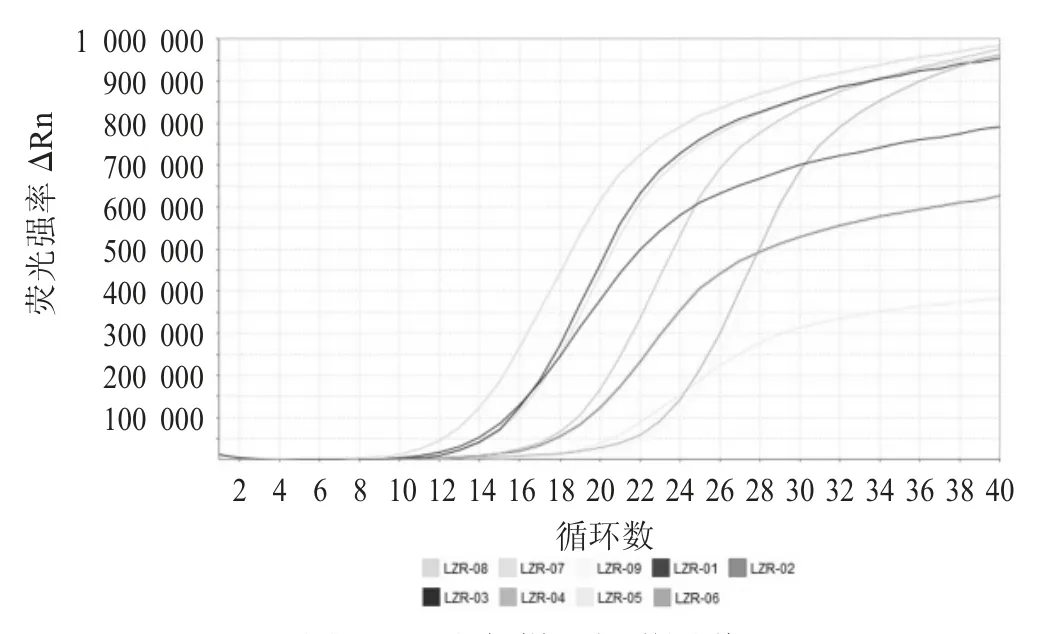
图4 理枣仁样品扩增图谱
2.3 绝对灵敏度试验
酸枣仁样品灵敏度扩增图谱见图5,酸枣仁样品灵敏度扩增标准曲线见图6。

图5 酸枣仁样品灵敏度扩增图谱
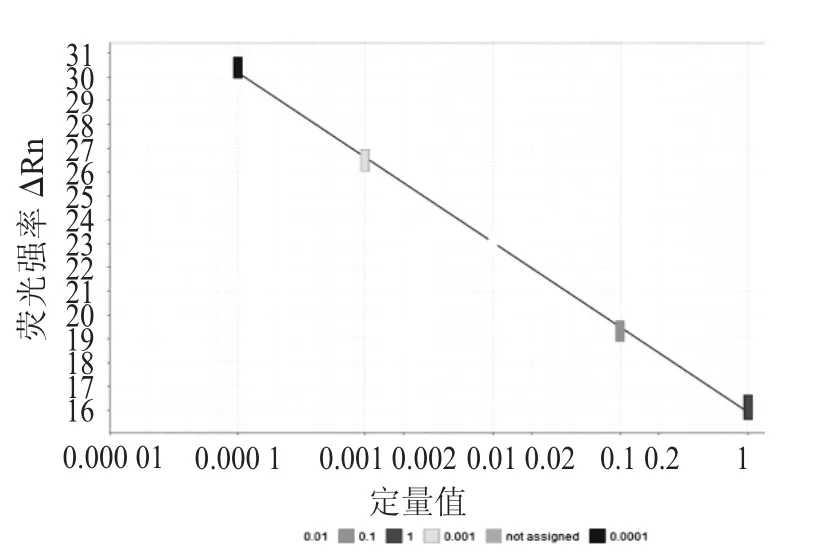
图6 酸枣仁样品灵敏度扩增标准曲线
由图5 可知,酸枣仁样品在稀释度10-4~100时,Ct 值均<35,有明显的对数扩增曲线,扩增结果具有良好的重复性,相对标准偏差RSD 均<3.5%。以稀释度量值对Ct 值作图。由图6 可知,线性相关系数R2=0.997,线性方程为Y=-3.564X+15.94,线性范围为5 pg~50 ng,即5~50 ng/反应,该方法具有良好的线性相关度。该方法灵敏度高达5 pg/反应。
理枣仁样品灵敏度扩增图谱见图7,理枣仁样品灵敏度扩增标准曲线见图8。

图7 理枣仁样品灵敏度扩增图谱

图8 理枣仁样品灵敏度扩增标准曲线
由图7 可知,理枣仁样品在稀释度10-4~100时,Ct 值均<35,有明显的对数扩增曲线,扩增结果具有良好的重复性,相对标准偏差RSD 均<3.5%。以稀释度量值对Ct 值作图。由图8 可知,线性相关系数R2=0.992,线性方程为Y=-3.321X+17.005,线性范围为5 pg~50 ng,即5~50 ng/反应,该方法具有良好的线性相关度,灵敏度高达5 pg/反应。
2.4 伪品理枣仁实际检出限
为了进一步分析双重实时荧光PCR 反应体系对酸枣仁掺入伪品理枣仁检测的实际灵敏度,结合市售样品实际掺伪情况,在酸枣仁DNA 模板中分别掺入50%,20%,10%,5%,3%,1%(W/W)的伪品DNA 模板,双重实时荧光PCR 检测结果显示,样品中同时存在酸枣仁和理枣仁2 种亲源关系相近的物种DNA,混合体系出现了交叉反应。由图9 可知,伪品理枣仁样品的最低检出限可达3%(W/W),检测Ct 值在24 左右,可以满足药典规定杂质含量检测需求。因此,确定该方法可用于实际中药材酸枣仁样品中理枣仁掺伪检测。
理枣仁掺伪检测结果见图9。

图9 理枣仁掺伪检测结果
3 讨论
近年来,由于酸枣仁中药材野生资源有限,存在着伪品和混淆品现象,在染色和炒制后,更加不易区分。传统鉴别方法往往是通过外观性状,如眼观、手摸、鼻闻、口尝等,必要时借助显微观察和薄层鉴别,这种鉴别方式对检验人员的专业素质要求较高,而且存在主观差别,不适用于快速、准确、广泛地推广。理化检测方法专属性不强、操作繁琐、耗时长、检测分析成本较高。2020 年版中国药典收录了PCR-RFLP 方法鉴别川贝母、霍山石斛,PCR方法鉴别乌梢蛇和蕲蛇及金钱白花蛇,也首次制定了聚合酶链式反应的指导原则,随着中药材制假售假的手段不断提高,分子生物学检测方法必将成为重要的检测手段。
ITS 作为真核生物核糖体DNA 的非编码区,承受的选择压力较小,物种间差异较大,遗传信息较丰富,片段长度适宜,有利于找到特异性的靶标片段,所以ITS 分子标记被广泛应用于中药材的鉴定中。通过试验证实该方法特异性好、能够同时检测正伪品成分、灵敏度高,检测核酸含量可达pg 级。研究同时发现,酸枣仁与理枣仁在ITS2 片段上同源性达到了94%以上,差异位点少,设计引物探针难度大,两物种上游引物采用两物种共有引物序列,在探针上游很难找到差异位点,伪品理枣仁实际检出限试验结果显示,两物种混合样品实时荧光PCR扩增出现了交叉反应,扩增反应被抑制,但实际检出限仍然能达到3%,能够满足中国药典掺入杂质检测要求。
4 结论
基于ITS 分子标记,分别设计了特异性鉴别酸枣仁和理枣仁的引物和TaqMan 探针,在40 个循环内酸枣仁和理枣仁样品均有相应的荧光对数扩增曲线,其他物种样品无荧光对数扩增曲线,利用多重多色实时荧光PCR 技术,一管反应同时鉴别酸枣仁、伪品理枣仁,大大提高了检测效率和实用性;经实际市售酸枣仁和理枣仁样品的检测验证了其可行性和适用性;整个试验2~3 h,用时较短、灵敏度较高、整个过程闭管操作,降低了出现假阳性的概率,同时也避免了有毒有害物质对环境和操作员的伤害;试验结果由仪器判读,更加准确,减小了检验人员判读时的主观误差。该方法操作简单可快速掌握,检测结果与性状鉴定结果完全一致,在酸枣仁生产加工质量监控及监管部门监管中具有很高的应用价值。

