载脂蛋白E基因多态性对慢性肾脏病的诊断价值*
李 全,沈建江,杨 琳,李鹏飞
南京中医药大学附属医院/江苏省中医院检验科,江苏南京 210029
慢性肾脏病(CKD)在全球已成为一个严重威胁人类健康的问题,在我国CKD患病率高达10.8%[1]。CKD发病率与肾衰竭早期观察到的肾小球滤过率(eGFR)下降程度有关[2]。有研究表明,CKD患者的载脂蛋白E(ApoE)基因型对脂蛋白水平和分布的调控受到多种因素的干扰[3]。ApoE常见3种等位基因(ε2、ε3、ε4)共有6种组合形式(ε2/ε2、ε2/ε3、ε2/ε4、ε3/ε3、ε3/ε4和ε4/ε4)[4],根据文献[5]将其分为3种基因型,包括E2、E3和E4型。
现有研究结果显示,由于ApoE异构体结构的差异,它们对脂蛋白具有不同的结合能力及结合偏好,因此会对脂蛋白代谢产生各种影响[6]。ApoE的基因多态性会对脂蛋白水平产生影响并对CKD的辅助诊断和临床分期具有临床意义[7]。本研究以本院收治的CKD患者作为研究对象,采用PCR芯片杂交法对ApoE基因进行分型,评估ApoE基因多态性及ApoE水平在CKD辅助诊断及临床分期中的应用价值,现报道如下。
1 资料与方法
1.1一般资料 选取2019年1—6月就诊于本院肾内科的122例CKD患者纳入CKD组,其中男68例,女54例;年龄22~76岁,平均(52.5±13.4)岁;根据改善全球肾脏病预后组织(KDIGO)对CKD的分期标准,122例CKD患者中CKD3期43例,CKD4期41例,CKD5期38例;所有检测病例原发病均为慢性肾小球肾炎。CKD组病例纳入标准:CKD病史超过1年,年龄超过18岁,能及时随访。选取同期本院36例健康体检者作为健康对照组,其中男19例,女17例;年龄23~77岁,平均(43.3±9.5)岁。健康对照组与CKD组的性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究通过本院伦理委员会审批,所有研究对象均签署知情同意书。
1.2仪器与试剂 美国贝克曼AU5800全自动生化分析仪(Beckman公司)。ABI7500全自动PCR分析仪(Beckman公司);血清ApoE测定使用四川迈克检验试剂盒(批号:20189);质控使用伯乐质控品(批号:24560);ApoE基因检测试剂盒采购于珠海赛乐奇公司(批号:2021903)。
1.3方法
1.3.1标本采集与处理 所有研究对象均空腹采集静脉血,分离胶促凝管采集血液5 mL,3 500 r/min离心5 min分离血清,检测ApoE水平,同时采集2 mL EDTA-K2抗凝血检测ApoE基因型。
1.3.2ApoE基因型检测 本研究ApoE基因型采用PCR芯片杂交法进行检测,提取DNA,50 ℃ 2 min;95 ℃变性15 min;94℃ 30 s,65 ℃ 45 s,45个循环。然后将PCR扩增产物在99 ℃加热裂解5 min,迅速冰浴5 min。取20 μL上述产物至100 μL杂交液中,混匀后加入基因芯片孔中。将基因芯片置于杂交仪上55 ℃杂交60 min,室温放置5 min。再将芯片放入50 ℃预热的洗涤液A中浸泡2 min,然后将芯片取出离心,甩干芯片表面的水渍。最后用BW反应液100 μL加在芯片表面,35 ℃反应15 min后,将芯片洗涤4次,然后将显色液滴加在芯片表面,35 ℃避光孵育10 min,最后冲洗芯片2次后晾干读片。
1.3.3eGFR检测 应用AU5800全自动生化分析仪测定血清肌酐水平,根据相关公式计算得到eGFR。
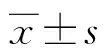
2 结 果
2.1ApoE各基因型在CKD组及健康对照组中的分布差异 本研究共检测122例CKD患者及36例健康体检者的ApoE基因型,122例CKD患者中E2、E3和E4基因型分别占20.5%(25/122)、65.6%(80/122)和13.9%(17/122),其中CKD3期、4期和5期患者E2基因型占比分别为23.3%(10/43)、19.5%(8/41)和18.4%(7/38),E3基因型分别为60.5%(26/43)、68.3%(28/41)和68.4%(26/38),E4基因型分别为16.3%(7/43)、12.2%(5/41)和13.2%(5/38)。36例健康体检者E2、E3和E4基因型分别占22.2%(8/36)、36.1%(13/36)和41.7%(15/36)。ApoE各基因型在CKD组和健康对照组中的分布差异有统计学意义(χ2=14.695,P<0.05),E3基因型在CKD组中所占比例明显高于健康对照组(P<0.05)。CKD组3、4、5期患者的ApoE各基因型分别与健康对照者比较,差异有统计学意义(χ2=12.876、12.236、11.845,P<0.05)。
2.2不同基因型患者的ApoE水平在各CKD分期中比较 本次共检测122例CKD患者血清ApoE水平,经单因素方差分析发现E3基因型患者血清ApoE水平在CKD各期中差异有统计学意义(P<0.05),其水平随着病情进展呈逐渐升高趋势,而在E2及E4基因型患者中未发现ApoE水平有升高或下降趋势。见表1。
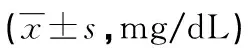
表1 不同基因型患者的ApoE水平在各CKD分期中比较
2.3ApoE水平与eGFR的相关性分析 在不同基因型组间比较发现,E3基因型患者中ApoE水平与eGFR呈负相关(r=-0.35,P<0.05)。见图1。
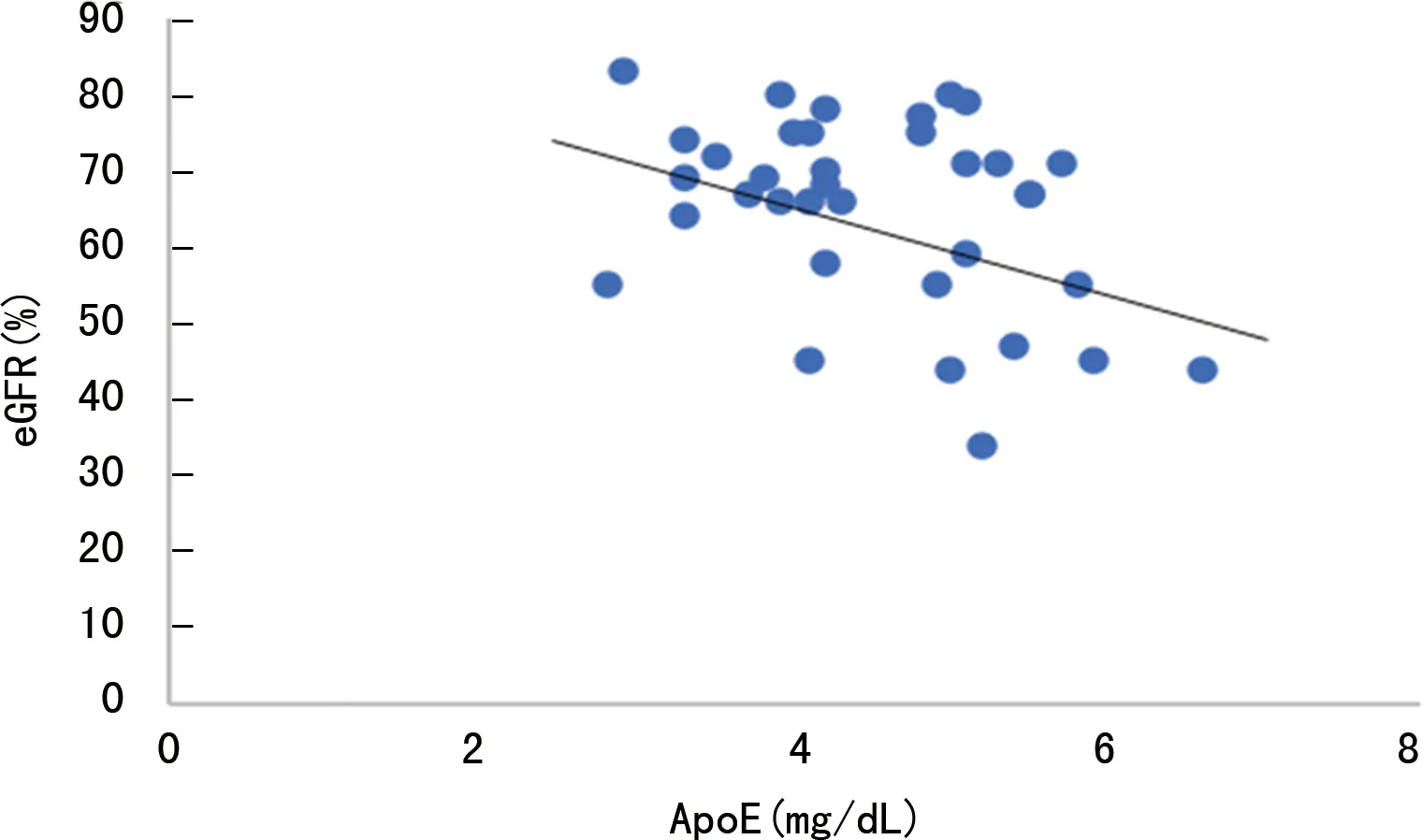
图1 E3基因型患者ApoE水平与eGFR的相关性
3 讨 论
CKD是一种慢性进展性肾脏疾病,除肾脏移植外,暂无有效的治愈方法[8]。在CKD患者病情进展过程中只能靠透析以维持生命,患者晚期的各种并发症也严重影响其生存质量[9]。因此,实现早期对CKD患者的病情评估及诊断有着重要意义。
ApoE是一种参与脂质代谢和运输的糖蛋白[10],而CKD患者常常会出现各类血脂代谢问题[11],本研究针对ApoE基因多态性及水平在CKD各期患者中的变化特点,从而探讨其在CKD辅助诊断及临床分期中的应用价值。本研究共检测122例CKD患者,其中E2、E3和E4基因型分别占20.5%(25/122)、65.6%(80/122)和13.9%(17/122),在所有CKD患者中E3基因型占比高达65.6%,明显高于健康对照组,差异有统计学意义(P<0.05),本研究结果与之前的一项研究结果一致[12]。此外,本研究结果表明,在E3基因型患者中,血清ApoE水平随着CKD病情的进展而出现逐渐升高的趋势,差异有统计学意义(P<0.05)。可能原因是对于E3基因型的CKD患者,ApoE水平对疾病的发生、发展起促进作用,随着疾病的进展而逐渐升高,是一种非保护性因子[13-14]。在E2及E4基因型患者中血清ApoE水平未发现相关的变化趋势[15]。后期将继续对E3基因型患者ApoE对疾病的影响机制进行进一步研究。
同时,本研究还发现CKD患者肾脏的滤过屏障损伤,肾小球滤过功能受损导致eGFR降低,这一结果与国内外诸多报道相符[16-17]。本研究还增加eGFR与ApoE基因型的相关性分析,研究发现在E3基因型患者中ApoE水平与eGFR呈负相关[18]。出现这一情况进一步说明E3基因型患者的ApoE可能参与肾脏损伤过程,ApoE可能是一种非保护性因素,这与文献[19]报道高ApoE水平是一种非保护机制相一致。
综上所述,CKD E3基因型患者ApoE水平与CKD病情进展有一定的相关性,在E3基因型患者中,ApoE水平越高越不利于保护肾脏。

