MTHFR、GSTP1和GSTM1基因多态性与Ⅲ期结肠癌术后辅助化疗敏感性及疗效的关系研究*
赵 帅,魏从真,金素丽,孙静娜,郭 英,刘佳佳△
河北医科大学第一医院:1.检验中心;2.肿瘤科,河北石家庄 050031
化疗是结肠癌的重要治疗手段,以奥沙利铂为基础的XELOX化疗方案在结肠癌的化疗,尤其是术后化疗中占据着重要地位[1]。既往研究表明,单核苷酸多态性是影响机体药物代谢酶活性和DNA修复酶活性的重要因素,不仅影响化疗药物的体内代谢,同时还影响个体化疗效果[2-3]。亚甲基四氢叶酸还原酶(MTHFR)是氟尿嘧啶类药物在体内代谢的关键酶,谷胱甘肽S转移酶P1(GSTP1)和谷胱甘肽S转移酶M1(GSTM1)都是Ⅱ相毒物代谢酶GST家族的重要成员,参与机体DNA修复及毒物代谢,在多种肿瘤的遗传易感性及化疗敏感性中多有报道[4-5]。本文主要探讨Ⅲ期结肠癌患者外周血MTHFR、GSTP1和GSTM1基因单核苷酸多态性与患者术后辅助化疗敏感性及临床疗效的相关性,以期为临床提供参考。
1 资料与方法
1.1一般资料 选取2015年8月至2016年7月于本院就诊行结肠癌切除的Ⅲ期结肠癌患者65例作为研究对象,患者年龄24~73岁,平均(56.32±4.21)岁。纳入标准:(1)经病理检查确诊为Ⅲ期结肠癌;(2)入组前未行放化疗干预或局部治疗;(3)患者初始体力状况评价ECOG评分≤2分;(4)无心、肝、肺、肾等重要脏器功能损害;(5)未合并其他恶性肿瘤。排除标准:(1)妊娠、哺乳期女性或近期有生育计划者;(2)对氟尿嘧啶过敏或代谢障碍者;(3)对铂类衍生物过敏或代谢障碍者;(4)长期接受全身类固醇激素治疗者;(5)合并肠梗阻或肠不完全梗阻者;(6)合并严重心血管疾病、呼吸道疾病或其他消化道疾病者;(7)合并未控制的严重感染者。本研究经本院伦理委员会批准,所有患者均签署知情同意书,并在入组后接受结肠癌术后XELOX方案辅助化疗。患者一般资料见表1。
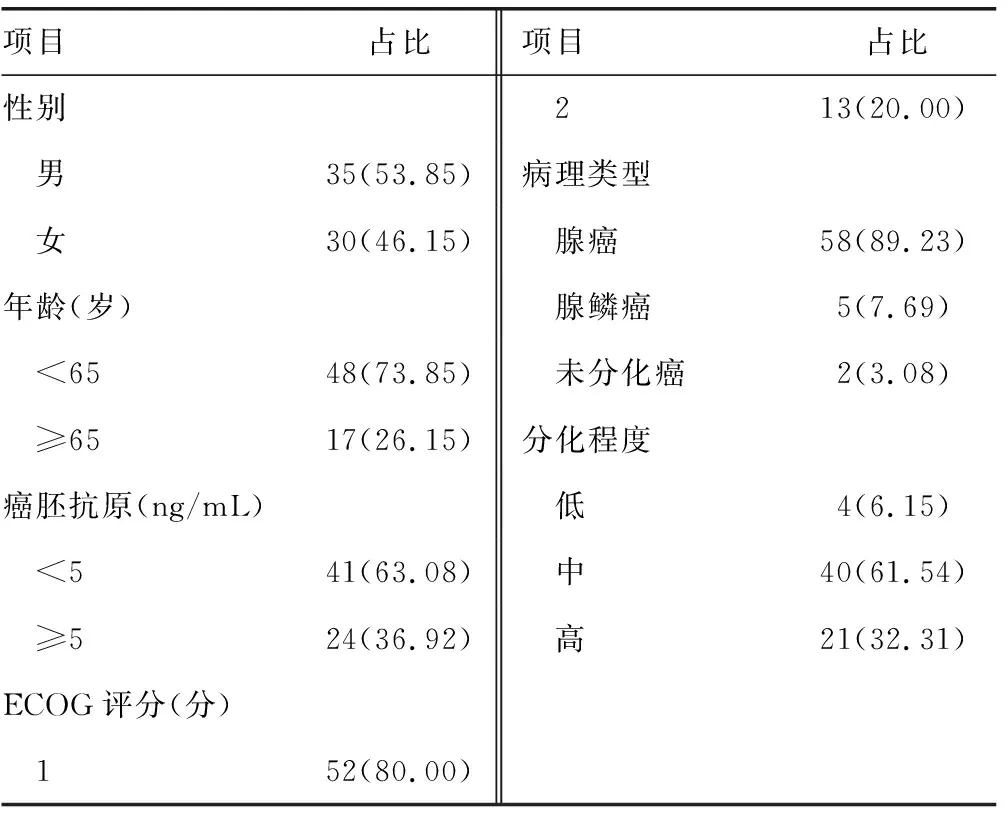
表1 65例Ⅲ期结肠癌患者一般资料[n(%)]
1.2方法
1.2.1化疗方案 所有患者均采用XELOX方案进行术后辅助化疗[6]。奥沙利铂130 mg/m2第1天静脉滴注;卡培他滨850 mg/m2第1~14天口服,2次/天,3周为1个周期。根据患者实际情况,给予术后辅助化疗6~8个周期的干预,最少接受6个周期术后辅助化疗。出现不能耐受的不良反应应立即终止治疗,同时根据患者血液检测结果及时进行药物剂量的调整。
1.2.2基因分型检测 所有患者均在化疗前取空腹静脉血2 mL,乙二胺四乙酸(EDTA)抗凝,室温静置30 min,-80 ℃保存。采用TIANamp Genomic DNA Kit全血基因组DNA提取试剂盒,参照使用说明进行全血基因组DNA提取。采用紫外分光光度(A260/A280)确定DNA纯度。采用PCR对MTHFR-rs1801131、GSTP1-rs1695、GSTM1基因位点进行扩增,按照生产厂家提供的操作手册,依次进行:(1)95 ℃,10 min使酶活化;(2)95 ℃,15 s使DNA变性;(3)60 ℃,60 s使引物和探针退火及延伸,共55个循环。扩增后产物使用ABI3370XL DNA测序仪通过 Sanger法对MTHFR-rs1801131、GSTP1-rs1695、GSTM1基因位点进行等位基因分析,蓝色和红色为两种不同的纯合子,绿色为杂合子,黑色为阴性对照。结果的判读采用双盲法,分别由两位实验人员同时进行,对基因型不一致的标本重新进行检测,对因质量或者其他问题不能分型者,予以剔除。
1.3化疗敏感性评价 化疗敏感性评价采用实体肿瘤的疗效评价标准1.1(RECIST1.1)版[7],分为完全缓解(CR)、部分缓解(PR)、疾病进展(PD)和疾病稳定(SD),以CR+PR记为化疗敏感,以PD+SD记为化疗不敏感。
1.4临床疗效评价 回顾性分析患者的随访资料,以无病生存时间作为临床疗效评估的主要指标,无病生存时间指手术当日至肿瘤复发、转移或因肿瘤死亡的时间,5年随访期尚未复发或非肿瘤引起的死亡病例作为截尾数据处理。以总生存期为临床疗效评估的次要指标,总生存期以病理检查确诊为Ⅲ期结肠癌至肿瘤引起的死亡或随访期满的时间。
1.5统计学处理 所有数据资料采用SPSS19.0统计软件进行处理、分析,计数资料以例数或百分率表示,采用χ2检验和Fisher确切概率法分析不同单核苷酸多态性与患者一般资料的关系,采用Kaplan-Meier法计算生存率。以P<0.05为差异有统计学意义。
2 结 果
2.1基因多态性分布情况 65例Ⅲ期结肠癌术后辅助化疗患者的MTHFR-rs1801131、GSTP1-rs1695、GSTM1基因型位点分布频率均符合Hardy-Weinberg平衡定律(P>0.05)。其中MTHFR-rs1801131基因型分布频率为AA型占81.54%(53/65),AC型占12.31%(8/65),CC型占6.15%(4/65);GSTP1-rs1695基因型分布频率为AA型占64.62%(42/65),AG型占27.69%(18/65),GC型占7.69%(5/65);GSTM1基因型分布频率为GSTM1基因缺失型占52.31%(34/65),GSTM1基因未缺失型占47.69%(31/65)。
2.2基因型与化疗敏感性的关系 化疗敏感性数据分析结果显示,携带MTHFR-rs1801131 AA、AC/CC基因型Ⅲ期结肠癌患者的化疗敏感率分别为22.64%、33.33%,与AA基因型患者化疗敏感率比较,携带C等位基因患者的化疗敏感率差异无统计学意义(P>0.05)。携带GSTP1-rs1695 AA、AG/GG基因型Ⅲ期结肠癌患者的化疗敏感率分别为16.77%、43.48%,与AA基因型患者化疗敏感率比较,携带G等位基因患者的化疗敏感率明显较高(P<0.05),其中携带G等位基因腺癌患者的化疗敏感率明显高于腺鳞癌和未分化癌患者,差异有统计学意义(P<0.05)。GSTM1基因缺失型、GSTM1基因未缺失型Ⅲ期结肠癌患者的化疗敏感率分别为14.71%、45.16%,与GSTM1基因缺失型患者化疗敏感率比较,GSTM1基因未缺失型患者的化疗敏感率明显较高(P<0.05)。其中GSTM1基因未缺失型的腺癌患者化疗敏感率也明显高于腺鳞癌和未分化癌患者,组间差异有统计学意义(P<0.05)。见表2。
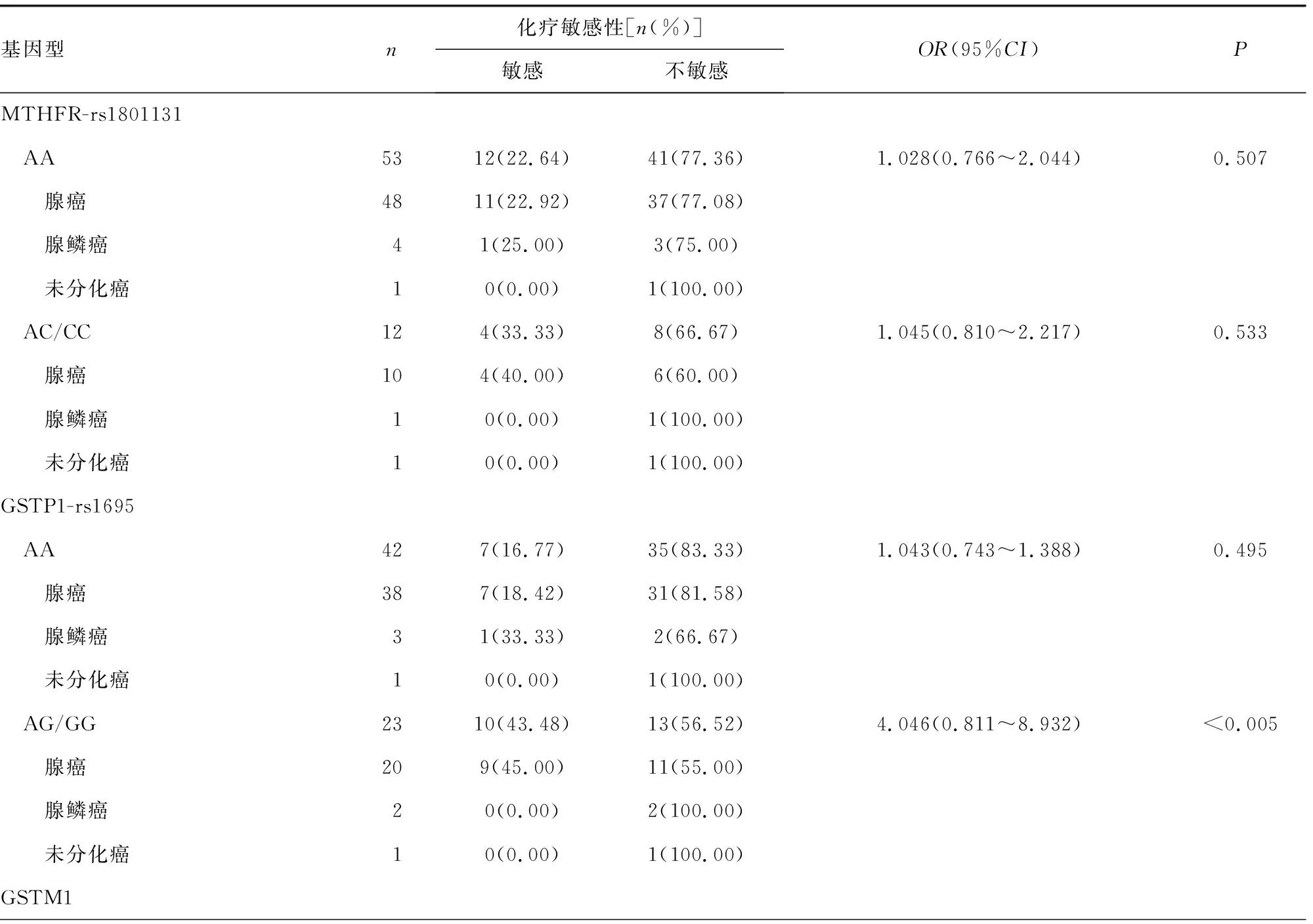
表2 基因型与化疗敏感性的关系
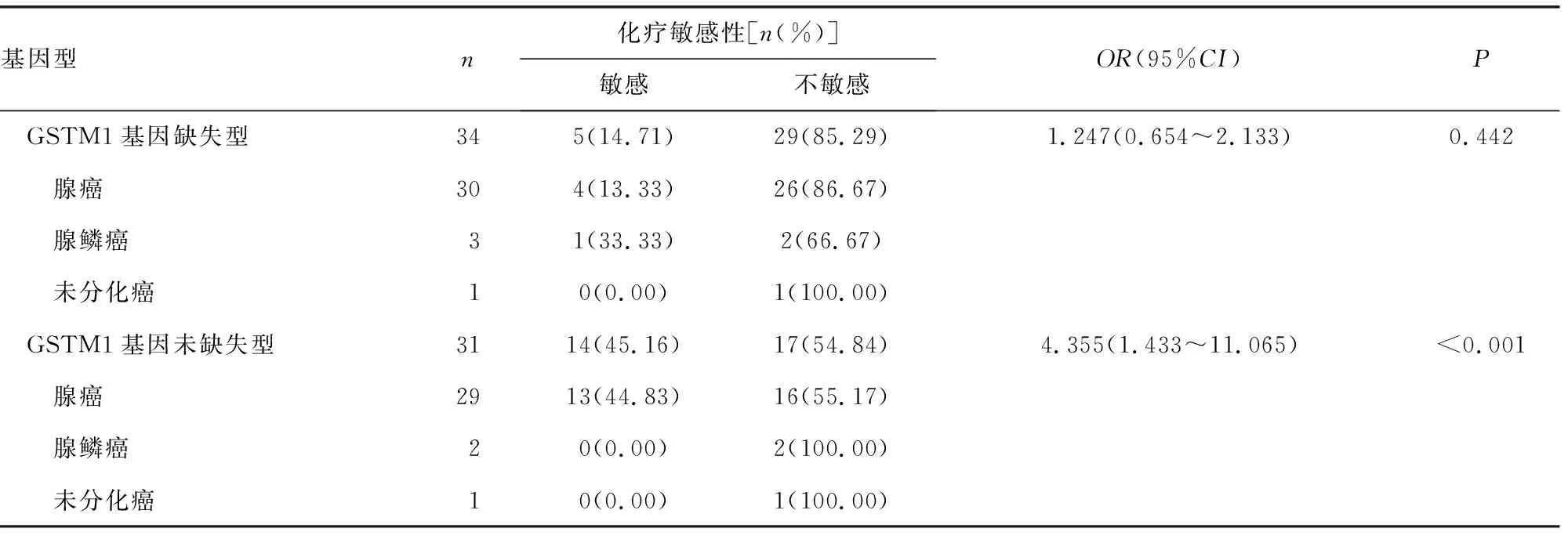
续表2 基因型与化疗敏感性的关系
2.3基因型与化疗疗效的关系 化疗临床疗效结果显示,携带MTHFR-rs1801131 AA、AC/CC基因型Ⅲ期结肠癌患者的中位无病生存时间分别为25.4、6.4个月,中位总生存期分别为45.2、14.4个月,与AA基因型患者中位无病生存时间和中位总生存期比较,携带C等位基因患者的中位无病生存时间和中位总生存期明显较短(P<0.05)。携带GSTP1-rs1695 AA、AG/GG基因型Ⅲ期结肠癌患者的中位无病生存时间分别为25.2、15.2个月,中位总生存期分别为38.6、30.2个月,与AA基因型患者中位无病生存时间和中位总生存期比较,携带G等位基因患者的中位无病生存时间和中位总生存期差异无统计学意义(P>0.05)。GSTM1基因缺失型、GSTM1基因未缺失型Ⅲ期结肠癌患者的中位无病生存时间分别为25.8、14.6个月,中位总生存期分别为37.5、33.6个月,组间中位无病生存时间和中位总生存期比较,差异无统计学意义(P>0.05)。不同病理类型结肠癌患者中位无病生存时间和中位总生存期比较,差异无统计学意义(P>0.05)。见表3。
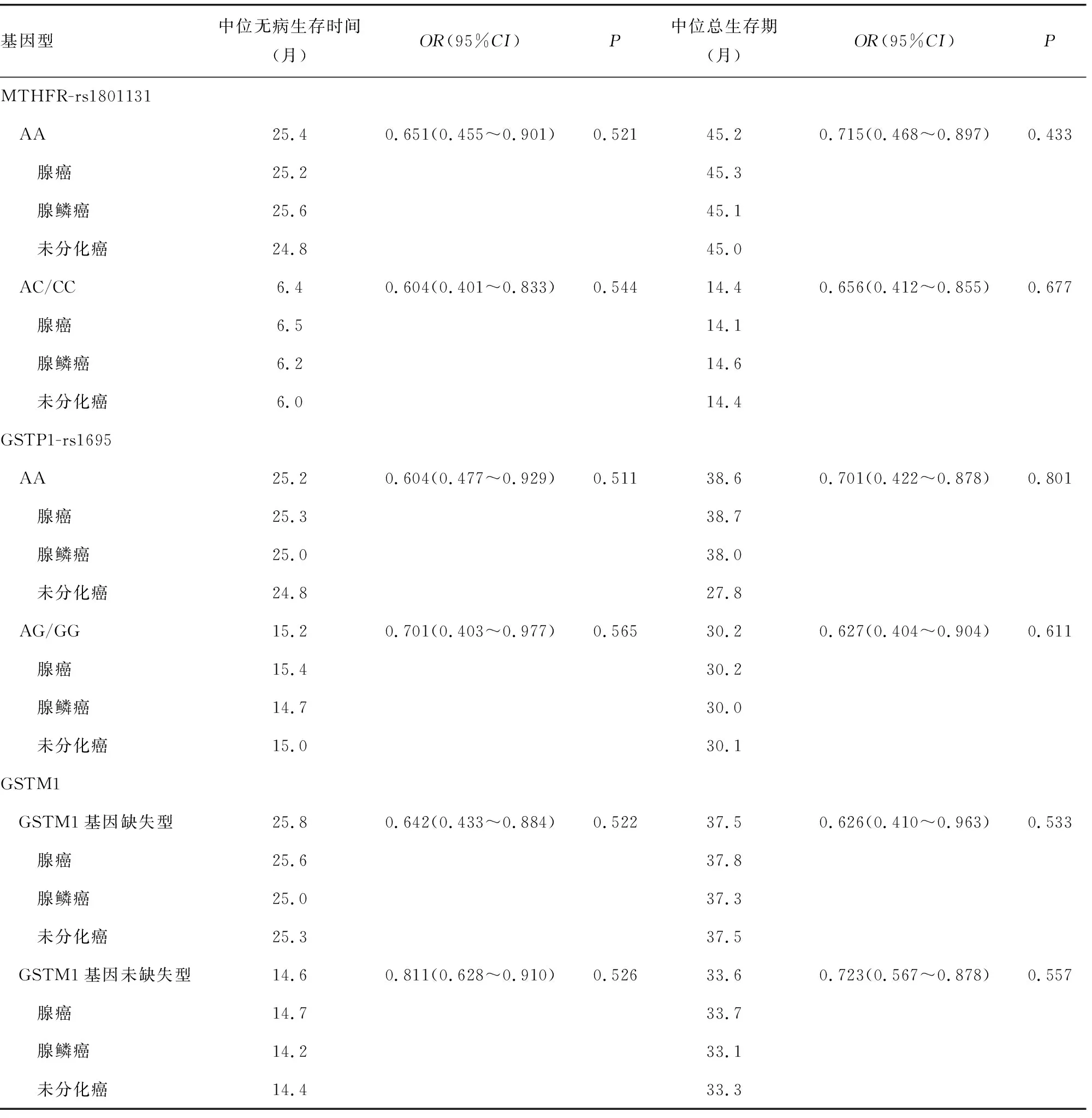
表3 基因型与化疗疗效的关系
3 讨 论
结肠癌发病率位于我国消化道肿瘤发病率的第2位,仅次于胃癌,其在所有肿瘤中的发病率和病死率也居高不下,是全球发病率较高的恶性肿瘤[8]。单纯手术切除治疗结肠癌的疗效及预后不甚理想,有超过半数患者术后会不同程度复发。因此,目前结肠癌的临床治疗仍提倡以手术为主的综合治疗,术后化疗是结肠癌,尤其是Ⅲ期及以上结肠癌治疗的重要方法。全身辅助化疗的主要目的是在结肠癌术后进一步清除体内的微转移病灶,降低肿瘤复发率,延长患者的生存时间,提高治愈率[9]。尽管术后辅助化疗能在一定程度上为结肠癌患者的治疗提供帮助,但由于个体差异,部分患者对化疗药物存在耐药表现,仍会导致辅助化疗的失败。因此,对化疗药物耐药的分子生物机制进行研究,寻找新的靶点,增强人体对化疗药物的敏感性显得尤为重要。随着药物基因组学的不断发展,人们对药物代谢相关酶基因多态性在用药指导中作用的认识也不断深入,并提出在大多数情况下对药物起清除作用的代谢酶及转运体遗传性的差异,可能是导致肿瘤患者对抗癌药物的疗效出现个体差异的原因。基于此,笔者推测药物代谢酶及药物转运蛋白基因的多态性可能会影响肿瘤患者化疗的敏感性和临床疗效。
5-氟尿嘧啶(5-FU)是治疗恶性肿瘤最常用的化疗药物之一,在体内可经酶促反应转化为活性代谢产物5-氟尿嘧啶脱氧核苷,并在5,10-亚甲基四氢叶酸的作用下,与胸苷酸合酶结合,形成影响胸苷酸合酶和5-氟尿嘧啶脱氧核苷作用的复合物,发挥抑制DNA合成和细胞生长的作用,并可最终影响癌细胞的活性,是众多化疗方案中的最基础药物[10]。MTHFR是5-FU在机体内代谢的关键作用酶之一,MTHFR-rs1801133是其最常见的基因突变位点,被认为与MTHFR的活性密切相关,可直接影响机体叶酸的积聚,从而影响5-FU的利用率[11]。有研究发现,MTHFR-rs1801133基因突变是结直肠癌切除术后辅助化疗预后差的独立预测因素,与化疗疗效息息相关[12]。谷胱甘肽S转移酶属二相代谢酶,参与机体非常重要的细胞防御反应,作为谷胱甘肽S转移酶家族的重要成员,GSTP1和GSTM1均参与包括铂类药物在内的多种化疗药物的毒物代谢反应[13]。GSTP1在体内主要发挥DNA修复和化疗药物毒物代谢调节的作用,当GSTP1中A突变为G时,可引起密码子编码异亮氨酸的改变,从而影响对DNA损伤的修复效率,并引起铂类化疗药物代谢率降低等一系列改变[14-15]。因此,有学者认为,GSTP1的野生型突变与消化道、血液系统、神经系统不良反应等化疗不良反应相关。GSTM1是体内谷胱甘肽转移酶的亚型之一,主要在化疗药物的解毒及调节能力上发挥作用,主要有GST1a、GST1b、GSTMl 3个等位基因,与机体的肿瘤易感性增加具有明显关系。近年来,不断有学者报道,携带GSTM1缺失基因型个体的结肠癌患病率增加,但也有部分研究持对立观点[16-17]。本研究主要选择MTHFR、GSTP1和GSTM1基因这3个在文献报道中存在争议的指标进行基因多态性分析,以Ⅲ期结肠癌患者为观察对象,主要关注Ⅲ期结肠癌患者术后辅助化疗敏感性及疗效与MTHFR、GSTP1和GSTM1基因单核苷酸多态性的关系。
笔者选取了2015年8月至2016年7月于本院行结肠癌切除术并在术后接受XELOX方案化疗的Ⅲ期结肠癌患者65例作为临床研究对象,对所有患者进行放疗前血样采集,发现65例患者的MTHFR-rs1801131、GSTP1-rs1695、GSTM1基因型位点分布频率均符合Hardy-Weinberg平衡定律,提示数据具有良好的群体代表性。研究结果显示,MTHFR-rs1801131基因型分布频率为AA 81.54%,AC 12.31%,CC 6.15%;GSTP1-rs1695基因型分布频率为AA 64.62%,AG 27.69%,GC 7.69%;GSTM1基因型分布频率为GSTM1基因缺失型 52.31%,GSTM1基因未缺失型47.69%。在完成基因型分布频率检测的基础上,本研究进行了随访资料的回顾性分析,以及不同基因型分布频率与患者化疗敏感性和化疗疗效的关系分析。结果显示,携带MTHFR-rs1801131 AA基因型Ⅲ期结肠癌患者的化疗敏感率与携带AC/CC基因型患者比较,差异无统计学意义(P>0.05);但携带GSTP1-rs1695 AA基因型患者的化疗敏感率则明显低于携带AG/GG基因型患者(P<0.05),GSTM1基因缺失型患者化疗敏感率也明显低于GSTM1基因未缺失型患者(P<0.05)。这提示MTHFR-rs1801131基因多态性与Ⅲ期结肠癌患者的化疗敏感率无关(P>0.05),GSTP1-rs1695携带G等位基因及GSTM1基因未缺失型患者的化疗敏感率更高(P<0.05)。进一步分析患者的病理类型发现,携带G等位基因的腺癌患者或GSTM1基因未缺失型腺癌患者的化疗敏感率明显高于腺鳞癌和未分化癌患者(P<0.05)。
本研究中的临床疗效分析结果发现,携带MTHFR-rs1801131 AA基因型患者的中位无病生存时间和中位总生存期明显优于携带C等位基因患者(P<0.05),而携带GSTP1-rs1695 AA、AG/GG基因型Ⅲ期结肠癌患者的中位无病生存时间和中位总生存期比较,差异无统计学意义(P>0.05);GSTM1基因缺失型与GSTM1基因未缺失型Ⅲ期结肠癌患者的中位无病生存时间和中位总生存期比较,差异无统计学意义(P>0.05)。这提示MTHFR-rs1801131 基因型突变与化疗疗效具有相关关系,但GSTP1-rs1695与GSTM1基因突变则不影响患者的化疗效果。
综上所述,MTHFR-rs1801131基因突变可影响Ⅲ期结肠癌患者术后辅助化疗的疗效,携带C等位基因患者的中位无病生存时间和中位总生存期明显较短;GSTP1-rs1695和GSTM1基因型突变则与Ⅲ期结肠癌患者术后辅助化疗敏感性有关,GSTP1-rs1695携带G等位基因及GSTM1基因未缺失型患者的化疗敏感率明显较高。

