HPLC-多波长切换法同时测定经典名方三化汤中12种成分的含量
薛晴 丛竹凤 向泽栋 柏道鸣 代龙 高鹏

中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2021)14-1709-06
DOI 10.6039/j.issn.1001-0408.2021.14.08
摘 要 目的:建立同时测定经典名方三化汤中柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚等12种成分含量的方法。方法:采用高效液相色谱(HPLC)-多波长切换法。色谱柱为COSMOSIL C18,流动相为乙腈-0.1%磷酸溶液(梯度洗脱),流速为1.0 mL/min,检测波长分别为280 nm(柚皮苷、橙皮苷、新橙皮苷)、254 nm(芦荟大黄素、大黄酸、大黄酚、大黄素甲醚)、310 nm(羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚),柱温为30 ℃,进样量为10 μL。结果:12种成分的分离度均较良好,阴性对照无干扰。柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚分别在55.4~5 540、3.8~380、45.6~4 560、1.2~120、2.1~210、2.2~220、2~200、2.4~240、0.8~80、1.2~120、1.7~170、1.1~110 μg/mL质量浓度范围内与其峰面积的线性关系良好(R 2≥0.999 6);检测限分别为0.064、0.024、0.053、0.018、0.020、0.041、0.050、0.091、0.030、0.180、0.028、0.083 μg/mL,定量限分别为0.213、0.075、0.174、0.060、0.063、0.138、0.166、0.323、0.130、0.600、0.094、0.275 μg/mL;精密度、稳定性(24 h)和重复性试验的RSD均小于2%(n=6);平均加样回收率分别为99.54%、99.69%、100.01%、99.93%、100.36%、99.65%、100.03%、100.47%、99.97%、100.68%、99.90%、100.17%,RSD均小于2%(n=6)。结论:本研究所建立的HPLC-多波长切换法操作简便、专属性强、稳定性好,可用于三化汤中柚皮苷、橙皮苷、新橙皮苷等12种成分含量的同时测定。
关键词 三化汤;经典名方;含量测定;高效液相色谱法;多波长切换
Simultaneous Determination of 12 Components in the Classical Formula Sanhua Tang by HPLC-multi- wavelength Switching Technology
XUE Qing1,CONG Zhufeng2,XIANG Zedong1,BAI Daoming3,DAI Long4,GAO Peng1(1. College of Pharmacy, Shandong University of TCM, Jinan 250355, China; 2. Shandong Provincial Institute of Cancer Prevention and Treatment, Jinan 250117, China; 3. Shandong Yuze Institute of Pharmaceutical and Health Industry Technology, Shandong Dezhou 251200, China; 4. School of Pharmacy, Binzhou Medical College, Shandong Yantai 264003, China)
ABSTRACT OBJECTIVE: To establish a method for simultaneous determination of 12 components including naringin, hesperidin, neohesperidin, aloe emodin, rhein, notopterol, emodin, honokiol, isoimperatorin, magnolol, chrysophanol and physcion in classical formula Sanhua tang. METHODS: HPLC-multi-wavelength switching technology was adopted. The determination was performed on COSMOSIL C18 with mobile phase consisted of acetonitrile-0.1% phosphoric acid (gradient elution) at the flow rate of 1.0 mL/min. The detection wavelength was 280 nm (naringin, hesperidin, neohesperidin), 254 nm (aloe emodin, rhein, chrysophanol, emodin methyl ether), 310 nm (notopterol, emodin, honokiol, isoimperatorin, magnolol). The column temperature was set at 30 ℃, and the sample size was 10 μL. RESULTS: A total of 12 components were well separated without negative interference. The linear range of naringin, hesperidin, neohesperidin, aloe emodin, rhein, notopterol, emodin, honokiol, isoimperatorin, magnolol, chrysophanol and physcion were 55.4-5 540, 3.8-380, 45.6-4 560, 1.2-120, 2.1-210, 2.2-220, 2-200, 2.4-240, 0.8-80, 1.2-120, 1.7-170, 1.1-110 μg/mL (R 2≥0.999 6), respectively. The detection limits were 0.064, 0.024, 0.053, 0.018, 0.020, 0.041, 0.050, 0.091, 0.030, 0.180, 0.028 and 0.083 μg/mL, respectively. The limits of quantitation were 0.213, 0.075, 0.174, 0.060, 0.063, 0.138, 0.166, 0.323, 0.130, 0.600, 0.094 and 0.275 μg/mL, respec- tively. RSDs of precision, stability (24 h) and repeatability tests were all lower than 2% (n=6). Average recoveries were 99.54%, 99.69%, 100.01%, 99.93%, 100.36%, 99.65%, 100.03%, 100.47%, 99.97%, 100.68%, 99.90%, 100.17% (all RSDs were lower than 2%, n=6), respectively. CONCLUSIONS: Established HPLC-multi-wavelength switching technology is simple, specific and stable, which could be used for the simultaneous determination of 12 components in Sanhua tang as naringin, hesperidin, neohesperidin.
KEYWORDS Sanhua tang; Classic formula; Content determination; HPLC; Multi-wavelength switching
经典名方三化汤出自《素问病机气宜保命集》,现为国家公布的《古代经典名方目录(第一批)》的第55首[1]。三化汤由大黄、枳实、厚朴、羌活等4味中药材组成,是治疗中风的经典方剂,具有通腑泄浊、升清降浊、调畅气机的作用,可有效改善缺血性脑水肿和脑血屏障通透性,多用于缺血性脑卒中的临床治疗[2-3]。该方中大黄具有泻下攻积、逐瘀通经、利湿退黄等功效[4],其有效成分主要为蒽醌类物质,其中的芦荟大黄素、大黄酸、大黄酚、大黄素、大黄素甲醚等成分可保护缺氧缺血性脑损伤大鼠的神经元,且可有效改善脑血管疾病患者的症状[5-6]。枳实可以破气消积、化痰除痞[7],其中的柚皮苷、橙皮苷、新橙皮苷等成分具有保护神经、抗氧化、抗凋亡等作用,可显著改善脑血流、保护脑组织[8-10]。厚朴可以理气消胀、燥湿平喘,其主要活性成分为厚朴酚、和厚朴酚[11-12]。羌活可祛风胜湿、止痛,具有抗血栓形成、增加脑血流量、改善脑血液循环的作用[13-14],2020年版《中国药典》(一部)(后文简写为“药典”)规定羌活醇及异欧前胡素为其含量测定成分[15]。该方使用羌活以化风、厚朴和大黄以化滞、枳实以化痰,诸药合用,上能宣通脑之玄府,下能开通肠胃玄府,使全身津液畅通、气血调和[16]。目前,对三化汤成分分析的研究较少,多数为方中单味药的成分研究,不能反映三化汤的整体成分信息,亦无法为制剂质量提供控制与评价依据。鉴于此,本研究拟通过建立高效液相色谱(HPLC)-多波长切换法来同时测定三化汤中柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚等12种有效成分的含量,从而系统、整体地为三化汤的质量评价提供依据,同时也为经典名方中药复方制剂的进一步开发提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有e2695型 HPLC仪(美国Waters公司)、KQ-500DV型数控超声波清洗器(昆山市超声仪器有限公司)、ME104E型万分之一分析天平(梅特勒-托利多国际有限公司)、TB18A1型砂锅(浙江苏泊尔股份有限公司)、H22-X3型电陶炉(九阳股份有限公司)、FD-1A-50型冷冻干燥机(北京博医康实验仪器有限公司)、RE 5298A型旋转蒸发仪(上海亚荣生化仪器厂)、DP25型隔膜泵(北京莱伯泰科仪器股份有限公司)等。
1.2 主要药品与试剂
大黄(批号分别为200605、200613、200803)、厚朴(批号分别为200409、200413、200507)、枳实(批号分别为200708、200719、200724)、羌活(批号分别为200505、200606、200513)药材均购自安徽亳州思远药业销售有限公司,经原济南市药品检验所主任药师宋希贵鉴定分别为蓼科植物药用大黄Rheum officinale Baill.的干燥根和根茎、木兰科植物厚朴Magnolia officinalis Rehd. et Wils.的干燥干皮、芸香科植物酸橙Citrus aurantium L.的干燥幼果、伞形科植物羌活Notopterygium incisum Ting ex H. T. Chang 的干燥根茎和根,其质量均符合药典要求[15]。按照三化汤制法中“右剉如麻豆大”的要求[1],将以上药材粉碎,使之过4目但不过10目筛,制得相应药材粗粉,备用[17]。
橙皮苷对照品(批号K09S11L123847,纯度≥98%)、和厚朴酚对照品(批号T28O6B5419,纯度≥98%)、厚朴酚对照品(批号Y27J10C91584,纯度≥98%)均购自上海源叶生物科技有限公司;柚皮苷对照品(批号110722-201815,纯度≥91.7%)、新橙皮苷对照品(批号111857-201804,纯度≥99.4%)、芦荟大黄素对照品(批号110795-202011,纯度≥97.5%)、大黄酸对照品(批号110757-201607,纯度≥99.3%)、羌活醇对照品(批号111820-201705,纯度≥99.9%)、大黄素对照品(批号110756-201913,纯度≥96.0%)、异欧前胡素对照品(批号110827-201812,纯度≥99.6%)、大黄酚对照品(批号110796-201621,纯度≥99.2%)、大黄素甲醚对照品(批号110758-201616,纯度≥99.0%)均购自中国食品药品检定研究院;乙腈、磷酸为色谱纯,其余试剂均为分析纯,水为纯净水。
2 方法与结果
2.1 色谱条件
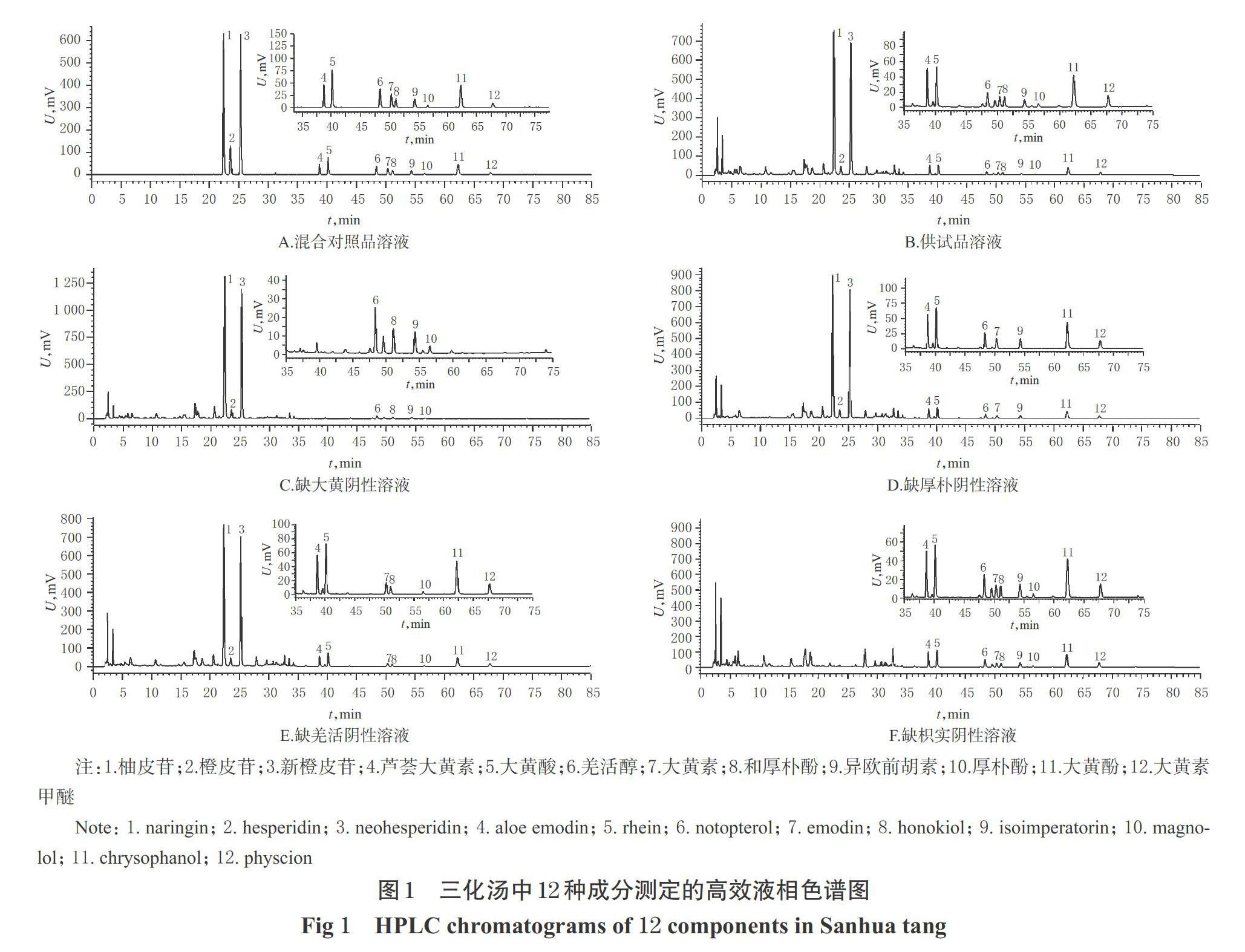
以COSMOSIL C18(250 mm×4.6 mm,5 μm)为色谱柱;以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~5 min,15%A;5~25 min,15%A→25%A;25~30 min,25%A→45%A;30~40 min,45%A→50%A;40~65 min,50%A→70%A;65~75 min,70%A→90%A;75~80 min,90%A→15%A;80~85 min,15%A);檢测波长在0~35 min为280 nm(柚皮苷、橙皮苷、新橙皮苷),35~45 min为254 nm(芦荟大黄素、大黄酸),45~58 min为310 nm(羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚),58~85 min为254 nm(大黄酚、大黄素甲醚);流速为1.0 mL/min;柱温为30 ℃;进样量为10 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取各对照品适量,置于同一10 mL量瓶中,加甲醇溶解并稀释至刻度,混匀,制成每1 mL分别含柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚5.54、0.38、4.56、0.12、0.21、0.22、0.20、0.24、0.08、0.12、0.17、0.11 mg的混合对照品溶液。
2.2.2 三化汤供试品溶液 分别称取大黄、厚朴、枳实、羌活药材粗粉各31 g,采用传统砂锅加水600 mL浸泡30 min,武火煮沸后再以文火熬至约300 mL,滤过,收集续滤液。滤液经浓缩、冷冻干燥后,制得三化汤供试品粉末。精密称取该粉末0.25 g,置于50 mL锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声(功率250 W,频率40 kHz)处理30 min,放冷,再次称定质量,用70%甲醇补足减失的质量,摇匀。以0.45 μm微孔滤膜滤过,取续滤液,即得三化汤供试品溶液。
2.2.3 缺味三化汤阴性溶液 按照“2.2.2”项下制备方法,分别制备不含大黄、不含厚朴、不含枳实、不含羌活的缺味三化汤阴性溶液。
2.3 专属性考察
分别取“2.2.1”项下的混合对照品溶液、供试品溶液(编号210128,大黄批号为200613、厚朴批号为200413、枳实批号为200719、羌活批号为200606,下同)、各缺味三化汤阴性溶液,分别按照“2.1”项下色谱条件进样分析,记录色谱图。结果显示,供试品溶液与混合对照品溶液在相同的保留时间处有相同的色谱峰,阴性溶液对测定无干扰;以12种成分计的理论板数均大于5 000;待测成分色谱峰峰形较好,且与相邻色谱峰的分离度均大于1.5,说明该方法专属性良好。三化汤中12种成分测定的HPLC图见图1(图中,各小图为局部放大图)。
2.4 线性关系考察
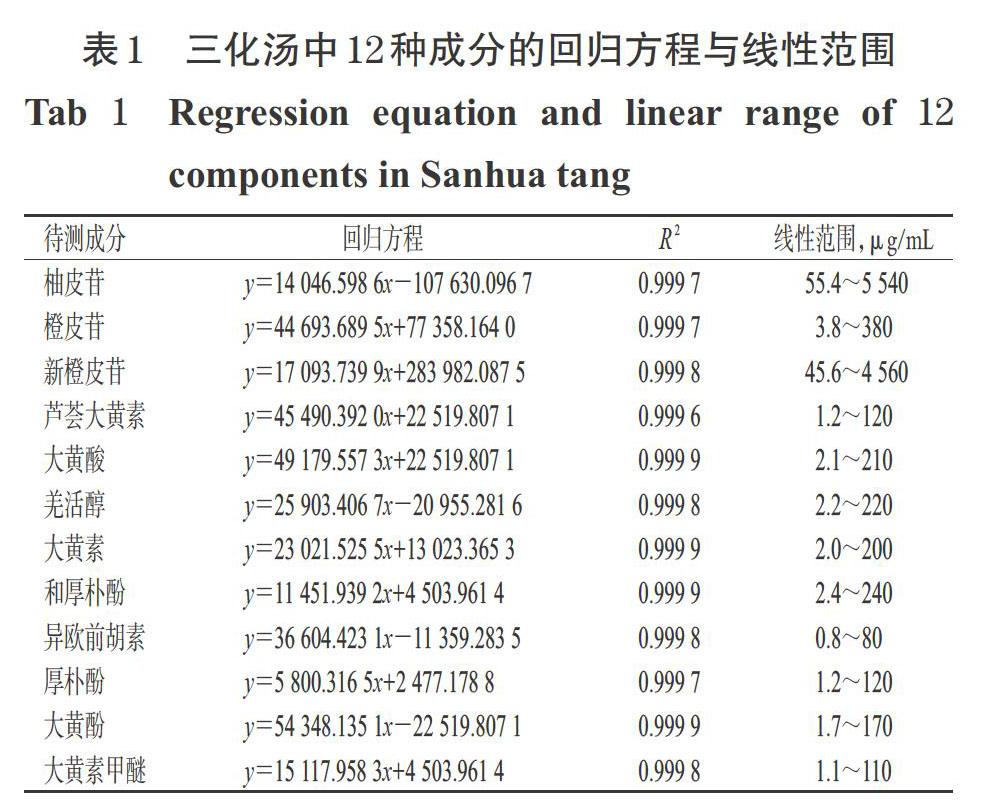
取“2.2.1”项下混合对照品溶液,用甲醇分别稀释0、5、10、50、100倍后,分别按照“2.1”项下色谱条件进样测定,记录峰面积。以各待测成分质量浓度为横坐标(x,μg/mL)、相应峰面积为纵坐标(y)进行线性回归。结果,各待测成分在其各自质量浓度范围内与其峰面积的线性关系均良好(R 2≥0.999 6),详见表1。
2.5 定量限与检测限考察
取“2.2.1”项下混合对照品溶液,用甲醇逐级稀释,然后按“2.1”项下色谱条件进样测定,记录峰面积,以信噪比3 ∶ 1和10 ∶ 1分别确定检测限和定量限。结果,柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚的检测限分别为0.064、0.024、0.053、0.018、0.020、0.041、0.050、0.091、0.030、0.180、0.028、0.083 μg/mL,定量限分别为0.213、0.075、0.174、0.060、0.063、0.138、0.166、0.323、0.130、0.600、0.094、0.275 μg/mL。
2.6 精密度试验
取“2.2.1”项下混合对照品溶液,用甲醇稀释10倍后(每1 mL分别含柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚对照品0.554、0.038、0.456、0.012、0.021、0.022、0.020、0.024、0.008、0.012、0.017、0.011 mg),按照“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚峰面积的RSD分别为1.12%、0.83%、0.46%、0.79%、0.51%、1.09%、0.63%、0.26%、0.74%、1.17%、0.59%、0.71%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.2.2”项下三化汤供试品溶液适量,分别于室温下放置1、2、4、8、12、24 h时按照“2.1”项下色谱条件进样测定,记录峰面积。结果,柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚峰面积的RSD分别为0.65%、0.89%、0.57%、0.26%、1.10%、0.55%、0.21%、0.47%、0.95%、1.02%、0.51%、1.38%(n=6),表明该供试品溶液在室温下放置24 h内稳定性良好。
2.8 重复性试验
分别称取大黄(批号200613)、厚朴(批号200413)、枳实(批号200719)、羌活(批号200606)粗粉各31 g,先按“2.2.2”项下方法制备供试品粉末。精密称取同一批三化汤供试品粉末6份,每份0.25 g,分别按照“2.2.2”项下方法制成供试品溶液,然后按照“2.1”项下色谱条件进样测定,记录峰面积并采用外标法计算出各成分的含量。结果,柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚的平均含量分别为68.73、1.51、51.77、1.33、1.47、1.13、0.96、1.82、0.43、1.19、1.59、1.99 mg/g,RSD分别为1.13%、1.05%、0.53%、0.94%、0.27%、0.86%、0.58%、0.91%、0.45%、0.31%、0.64%、0.98%(n=6),表明该方法重復性良好。
2.9 加样回收率试验
精密称取6份已知含量的同一批三化汤药材粗粉(编号210128),每份约0.125 0 g。分别按与已知量1 ∶ 1(m/m)的比例加入各对照品溶液(取各对照品适量,分别以甲醇为溶剂制备),按照“2.2.2”项下方法处理,然后按照“2.1”项下色谱条件进样测定,记录峰面积,采用外标法计算各成分的含量及加样回收率。结果,柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚的平均加样回收率分别为99.54%、99.69%、100.01%、99.93%、100.36%、99.65%、100.03%、100.47%、99.97%、100.68%、99.90%、100.17%,RSD均小于2%(n=6),表明该方法准确度较好,详见表2。
2.10 样品含量测定
取3批各药材粗粉,分别按照“2.2.2”项下方法制备的三化汤供试品溶液[编号分别为210127(大黄批号为200605、厚朴批号为200409、枳实批号为200708、羌活批号为200505)、210128、210129(大黄批号为200803、厚朴批号为200507、枳实批号为200724、羌活批号为200513)]后,然后按照“2.1”项下色谱条件进样测定,记录峰面积,采用外标法计算样品中各成分的含量,每个样品平行操作3次。结果,3批三化汤供试品溶液中柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚的平均含量分别为68.88、1.51、51.76、1.38、1.61、1.21、0.95、1.74、0.47、1.19、1.56、2.10 mg/g,详见表3。
3 讨论
3.1 三化汤药效成分的选择
药典规定枳实的定量指标为辛弗林[15],但由于辛弗林为生物碱类成分,极性强,在液相中的保留时间极短,对流动相及色谱柱的要求较高[18-19],因此本研究在参考文献[20-21]的基础上,改选柚皮苷、橙皮苷、新橙皮苷作为枳实的定量指标。同时,结合药典中厚朴、羌活、大黄药材项下定量指标的要求[15],最终选择柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚共12种成分作为本研究含量测定的指标成分。此外,有研究显示,以上各成分均可有效保护缺氧缺血性脑损伤大鼠的神经元、增加脑血流量、改善脑血液循环[5-6],与三化汤临床用于治疗缺血性脑卒的作用一致。
3.2 色谱条件的选择
本研究采用HPLC-多波长切换法测定经典名方三化汤中12种成分的含量,前期考察了不同的流动相体系(乙腈-水、甲醇-水、乙腈-0.1%磷酸溶液、甲醇-0.1%磷酸溶液)、磷酸溶液浓度(0.05%、0.1%)、柱温(25、30、35 ℃)等对色谱峰的影响。结果显示,当流动相体系为乙腈-0.1%磷酸溶液(梯度洗脱)、柱温为30 ℃、流速为1 mL/min时所得色谱图的基线平稳,色谱峰的分离效果较好。同时,根据药典中大黄、厚朴、羌活、枳实药材含量测定项下要求[15],发现本研究中12种成分的检测波长有较大差异,因此本研究选择采用多波长切换技术整合不同保留时间内最佳色谱信息,根据药典要求及前期预实验结果最终确定了“2.1”项下的色谱条件。
3.3 三化汤样品提取方法的选择
本研究前期考察了不同体积分数提取溶剂(甲醇、80%甲醇、70%甲醇)与提取时间(15、30、45、60 min)对经典名方三化汤中有效成分提取效率的影响。结果发现,当使用70%甲醇进行提取时,样品的溶解度和提取效率均较高;且提取30、45、60 min時的提取效率差异较小,但均优于提取15 min。因此,本研究最终决定采用70%甲醇为溶剂超声提取30 min作为三化汤样品的提取方法。
3.4 含量测定结果分析
本研究同时测定了三化汤中12种成分的含量。结果发现,3批三化汤供试品溶液中12种成分的平均含量从高到低依次为柚皮苷、新橙皮苷、大黄素甲醚、和厚朴酚、大黄酸、大黄酚、橙皮苷、芦荟大黄素、羌活醇、厚朴酚、大黄素、异欧前胡素,其中柚皮苷、新橙皮苷含量远远高于其他成分,但各成分3批样品间含量差异不大,表明含量测定方法准确,提取方法稳定、可行。
综上所述,本研究以古籍文献为基础,以现代应用为出发点,建立了HPLC-多波长切换法同时测定三化汤中柚皮苷、橙皮苷、新橙皮苷、芦荟大黄素、大黄酸、羌活醇、大黄素、和厚朴酚、异欧前胡素、厚朴酚、大黄酚、大黄素甲醚等12种成分的含量,该方法操作简便、专属性强、稳定性好,可为经典名方三化汤的质量评价与控制提供参考。
参考文献
[ 1 ] 国家中医药管理局.国家中医药管理局关于发布《古代经典名方目录(第一批)》的通知[EB/OL].(2018-04-13)
[2021-04-02]. http://kjs.satcm.gov.cn/zhengcewenjian/2018-
04-16/7107.html.
[ 2 ] YAN H Z,MIAO W,LIN S,et al. Rapid characterization of the chemical constituents of Sanhua decoction by UHPLC coupled with fourier transform ion cyclotron resonance mass spectrometry[J]. RSC Advances,2020,10(44):26109-26119.
[ 3 ] 樊凯芳,唐迎雪,赵建平.三化汤开通玄府治疗急性中风病[J].新中医,2012,44(2):5-6.
[ 4 ] 张桥,陈艳琰,乐世俊,等.大黄炮制的历史沿革及对化学成分、传统药理作用影响的研究进展[J].中国中药杂志,2021,46(3):539-551.
[ 5 ] YU Y,LIU H,YANG D,et al. Aloe-emodin attenuates myocardial infarction and apoptosis via up-regulating miR-133 expression[J]. Pharmacol Res,2019,146:104315.
[ 6 ] 于潇,王贵阳,侯宇东,等.中药抗脑缺血再灌注损伤的作用及其机制的研究进展[J].中草药,2021,52(5):1471- 1484.
[ 7 ] 于同月,张斌,韦宇,等.枳实的临床应用及其量效关系[J].吉林中医药,2021,41(1):103-106.
[ 8 ] 张巧莲,范宏光,李平,等.柚皮苷对脑梗死保护作用的研究进展[J].现代药物与临床,2021,36(3):633-636.
[ 9 ] WANG J,YUAN Y,ZHANG P,et al. Neohesperidinprevents Aβ25-35-induced apoptosis in primary cultured hippocampal neurons by blocking the S-nitrosylation of protein-disulphideisomerase[J]. Neurochem Res,2018,43(9):1736-1744.
[10] HAJIALYANI M,HOSEIN FARZAEI M,ECHEVERR?A J,et al. Hesperidin as a neuroprotectiveagent:a review of animal and clinical evidence[J]. Molecules,2019,24(3):648.
[11] 谭珍媛,邓家刚,张彤,等.中药厚朴现代药理研究进展[J].中国实验方剂学杂志,2020,26(22):228-234.
[12] LIU X,CHEN X,ZHU Y,et al. Effect of magnolol on cerebral injury and blood brain barrier dysfunction induced by ischemia-reperfusion in vivo and in vitro[J]. Metab Brain Dis,2017,32(4):1109-1118.
[13] 李芸达,颜祖弟,黄涛,等.羌活不同提取物对小鼠脑缺血缺氧的保护作用[J].中國医院药学杂志,2015,35(4):296-299.
[14] WU X W,ZHANG Y B,ZHANG L Y,et al. Simultaneous quantification of 33 active components in Notopterygii Rhizoma et Radix using ultra high performance liquid chromatography with tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2018,1092:244-251.
[15] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:24-25,190-192,258,263.
[16] 骆龙吉.增补内经拾遗方论[M].唐文吉,唐文奇,译.北京:学苑出版社,2011:7.
[17] 焦其树,郝丽霞,吴治丽,等.经典名方中煮散和散剂粒度探讨[J].中国实验方剂学杂志,2021,27(1):1-6.
[18] 承晨,李莉. HPLC法同时测定代代花中柚皮苷、橙皮苷、新橙皮苷和辛弗林的含量[J].药学与临床研究,2020,28(4):263-265,269.
[19] 崔文金,焦梦姣,邓哲,等.黄连饮片标准汤剂的制备及质量标准分析[J].中国实验方剂学杂志,2017,23(19):40- 45.
[20] 张晓娟,赵良友,李建华,等.中药枳实的研究概况[J].中医药学报,2021,49(1):94-100.
[21] 戚华文,徐鑫,温柔,等.基于化学模式识别技术的枳实HPLC定量指纹图谱研究[J].分析测试学报,2021,40(1):72-78.
(收稿日期:2021-04-13 修回日期:2021-06-10)
(编辑:林 静)

