再次服用阿比特龙治疗转移性前列腺癌的价值
王慧,赵善坤,刘世雄,李欣
前列腺癌是欧美国家男性最常见的恶性肿瘤,我国前列腺癌的发病率逐年升高,一半以上的新诊断患者已发生远处转移[1],5年相对生存率仅为30%[2]。转移性激素敏感性前列腺癌(metastatic hormone sensitive prostate cancer,mHSPC)进展后将转变为转移性去势抵抗性前列腺癌(metastatic castration—resistant prostate cancer,mCRPC), 治 疗 手 段 有限,如不接受治疗,患者中位生存期仅为12.3个月[3]。因此,如何延长转移性前列腺癌(metastatic prostate cancer,mPC)患者的治疗反应期,成为提高肿瘤特异性生存期(cancer specific survival,CSS)的关键问题。新型抗雄药物阿比特龙(AA)投入中国市场时间较短,多数患者只有单次用药经验,目前尚无关于其重复用药是否有效的研究。本研究通过跟踪两例mPC患者的综合诊疗过程,总结出两次服用AA的疗效,现报道如下。
1 患者资料
(1)患者1:男性,初诊年龄69岁,身高170 cm,体质量70 kg,WHO体力状态评分为0分。既往无高血压、糖尿病、手术及创伤史,18年前有肺结核病史,已治愈。
治疗前评估:2016年11月,患者因“排尿不畅6个月”初次就诊。初查前列腺特异性抗原(prostate-specific antigen,PSA,参考值<4 μg/L)为42.50 μg/L,直肠指诊前列腺Ⅱ度增大,质地不硬,未触及结节,无压痛,与直肠无粘连。腹部B超未见脏器转移灶,胸部X线检查未见异常。磁共振成像(MRI):前列腺中央带见多发增生结节,部分突入膀胱,耻骨联合右侧面见异常结节,直径约1.2 cm,盆腔内未见肿大淋巴结,经直肠前列腺穿刺活检共8针,阳性8针,病理报告为Gleason 4+4,正电子发射计算机断层显像(PET-CT)提示右侧骶髂骨有转移灶。临床分期为T2cN0M1。
基础治疗:2016年12月开始接受持续雄激素剥夺治疗(androgen deprivation therapy,ADT):皮下注射醋酸戈舍瑞林(商品名:诺雷德,阿斯利康制药有限公司),3.6 mg/次,1次/月,每3~6个月监测PSA与睾酮浓度,并保持睾酮浓度始终处于去势水平(<50 μg/L);唑来磷酸 (商品名:艾朗,江苏恒瑞医药股份有限公司),4 mg/次,1次/月。
抗雄治疗:2016年12月—2017年7月接受比卡鲁胺(商品名:康士得,阿斯利康制药有限公司)治疗,50 mg/次,1次/d,共8个月。PSA最低降至0.59 μg/L,治疗结束时升至15.80 μg/L,骨扫描提示右耻骨、骶髂关节等处转移。
化疗:2017年7月—2018年4月接受多西他赛(商品名:艾素,江苏恒瑞医药股份有限公司)联合泼尼松(docetaxel plus prednisone,DP)的化疗方案,具体给药方法为:多西他赛 75 mg/m2静脉滴注,1 次 /3 周 + 泼尼松片 5 mg,1 次 /12 h,10个疗程,共9个月。PSA持续降低,至结束时为4.50 μg/L。
首次AA治疗(商品名:泽柯,西安杨森制药有限公司):具体方法为,AA联合泼尼松(abiraterone acetate plus prednisone,AAP),AA 1.0 g空腹口服,1次 /d+ 泼尼松片5 mg,1 次 /12 h。2018 年 5 月 PSA 升至 15.80 μg/L, 开 始接受首次AAP治疗,至2019年1月治疗结束时PSA升高至40.70 μg/L,共8个月。MRI提示骨盆诸骨骨转移,骨扫描提示骨盆诸骨骨转移较前进展。
间歇期治疗:2019年2月接受骨盆区姑息性放疗,总剂量40 Gy/20F。2019年3—9月,完全药物撤退,PSA持续升高至186.70 μg/L。骨扫描提示多发性骨转移,病灶较前增加。
再次AA治疗:2019年10月—2020年3月再次AAP治疗,共5个月。PSA最低降至89.78 μg/L,至治疗结束时PSA升至164.00 μg/L,共5个月。骨扫描提示骨盆外转移灶增多,但骨盆灶较前改善,见图1。
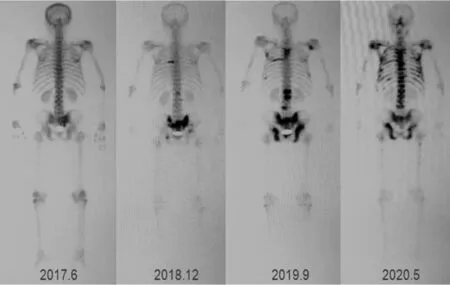
图1 患者1在各治疗阶段的骨扫描图Figure 1 Bone scan of patient 1 at each stage of treatment
(2)患者2:男性,初诊年龄63岁,身高168 cm,体质量69 kg,WHO体力状态评分为0分。既往有高血压病史,无糖尿病、手术及创伤史。
治疗前评估:2014年1月,患者因“排尿不畅4个月”初次就诊。初查PSA为258.00 μg/L,直肠指诊前列腺Ⅱ度增大,质地坚硬,不活动,无压痛,右侧结节灶一处约1.5 cm;腹部B超未见内脏转移灶,胸部CT未见异常。前列腺MRI:前列腺右侧叶外周带信号异常,结节突破包膜,盆区淋巴结及其他部位未见异常转移信号。经直肠前列腺穿刺活检共10针,阳性8针,病理报告为Gleason4+4;骨扫描:骨盆区多发转移灶。据此临床分期为T3aN0M1。
基础治疗:2014年2月开始接受持续ADT治疗及唑来磷酸治疗,具体给药及PSA与睾酮的监测方法同患者1。
首次AA治疗:2014年2月—2015年6月接受首次AAP治疗,共17个月,PSA最低为0.37 μg/L,治疗结束时PSA升高至9.31 μg/L。骨扫描检查显示骨盆区转移灶缩小。
间歇期治疗:2015年6月—2016年6月更换为比卡鲁胺(具体给药方法同患者1),PSA无下降趋势,并持续升高至160.00 μg/L,骨扫描检查显示骨盆区转移灶扩大,共12个月。2016年6月—2017年1月接受DP化疗(具体给药方法同患者1),共7个月,PSA持续降低,至结束时为1.16 μg/L,骨扫描检查显示骨盆区转移灶再次缩小,3个月后PSA升高至6.03 μg/L。2017年4月,接受腹腔镜下根治性前列腺切除术,术后病理报告:前列腺结节累及前列腺包膜外脂肪;双侧精囊、输精管、尿道切缘、双侧盆腔淋巴结均为阴性;Gleason4+5。术后6周PSA持续升高至18.25 μg/L,术后4个月(2017年8月)PSA升高至336.00 μg/L,复查前列腺MRI未见前列腺区复发结节,骨扫描提示骨盆区病灶较前有进展,未发现骨盆外其他部位转移灶。
再次AA治疗:2017年9月—2019年2月再次AAP治疗,共17个月。PSA最低降至0.85 μg/L,至结束时PSA升至36.36 μg/L。复查骨扫描提示骨盆区病灶较2017年8月范围缩小,其余部位未见转移灶。
2 疗效总结与对比
两例患者初诊时均为mPC;均存活并随访至2020年8月;均以相同方法接受了包括持续ADT、唑来磷酸、AAP、DP等在内的综合治疗;均接受了包括两次AA治疗的“三明治”方案;均以相同方法监测PSA及睾酮浓度;化疗及再次AAP治疗均为mCRPC期;均在转变治疗方案时进行影像学进展评估。二者诊疗的不同处有:首次AAP治疗时机不同:患者1为mCRPC期,患者2为mHSPC期;序贯治疗顺序不同;患者对DP与AAP反应程度不同:无论DP还是AAP,患者2的PSA最低点更低;患者总体获益不同:药物治疗反应期,患者1为30个月,患者2为41个月;患者1随访至2020年3月时为存活状态,CSS>40个月,患者2随访至209年2月时为存活状态,CSS>62个月。两例患者在随访期的治疗总结与PSA变化趋势图分别见图2~3。
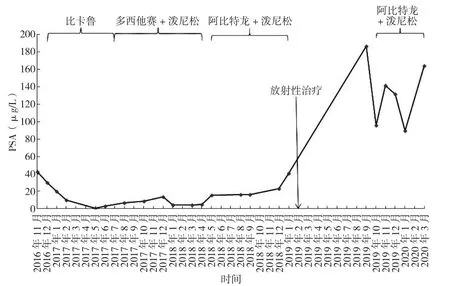
图2 患者1在随访期的治疗总结及PSA变化趋势图Figure 2 Treatment summary and PSA change trend of patient 1 during the follow-up period
3 讨论
前列腺癌是欧美国家男性最常见的恶性肿瘤,预计2016年北美地区前列腺癌新发病例约180 890例,占所有男性新发实体肿瘤总数的21%,死亡率仅次于肺癌[4]。美国的前列腺癌患者中,临床局限性病例占81%,淋巴结转移病例占12%,远处转移病例仅占4%[5]。我国的前列腺癌的发病率也逐年升高。
据估计,2015年我国前列腺癌新发病例有60 300例,死亡病例约26 600例[2]。但我国大多数前列腺癌患者在初诊时就已经出现转移,在北京、上海和广州进行的一项研究结果显示,国内新诊断的前列腺癌患者中,54%的患者在诊断时已发生远处转移(包括骨和腹部器官转移)[1]。发生远处转移的患者,5年相对生存率从未转移患者的80%降至30%[2],无进展生存时间是未转移患者的一半[6]。疾病进展一旦由mHSPC进入 mCRPC阶段,预后一般较差。因此,如何最大限度延长这些患者对抗雄药物的治疗反应期,就成为提高CSS的关键问题。
mPC的治疗包括原发灶局部治疗、转移灶局部治疗以及全身系统性治疗。其中,系统治疗是包括多种药物或方法的综合干预,包括药物或手术性ADT、抗雄治疗、根治性前列腺切除术、放疗、化疗、靶向治疗等。ADT是mPC治疗的基础方法,能够在短期内迅速降低前列腺癌患者体内雄激素水平,但平均应答时间只能维持14~20个月,最终仍然会由mHSPC发展成为恶性度更高的mCRPC[7]。ADT治疗后肿瘤组织内仍然存在较高浓度的雄激素(包括睾酮、脱氢异雄酮、二氢睾酮和雄甾烯二酮),会继续刺激前列腺癌细胞的生长[8]。当疾病发展进入mCRPC阶段后,原有抗雄药物不再有效,需要不断地更换新型药物。
英国科学家在20世纪90年代早期开发了能够全面抑制体内雄激素生成的药物——AA。这是一种口服的高亲和力、高选择性CYP17抑制剂,可不可逆地抑制雄性激素合成途径的细胞色素P450 17A1(CYP17A1),而后者在肾上腺、睾丸和前列腺合成雄激素的过程中起着关键作用[9]。最近5年在mHSPC治疗研究方面取得了重大突破,2015年以前mHSPC的治疗方案是单纯的内分泌治疗,2015年CHAARTED研究表明mHSPC患者可以早期使用ADT+化疗(多西他赛)方案,而抗雄药物的更换,甚至是抗雄药物撤退也仅是为了延缓患者进入化疗的时间或延长化疗药物治疗周期[10]。随后,2016年STAMPEDE研究[11]和2017年LATTITUDE研究[12]又提出mHSPC患者可以早期使用AA,2018版EAU[13]和AUA[14]指南将AA和多西他赛均推荐为mHSPC治疗的一线方案。但是COU-AA-302分层研究[15]显示,相对于单纯泼尼松片治疗,AAP治疗无化疗史mCRPC患者的中位生存期获益 11.8个月(53.6 个月 vs 41.8个月),COU-AA-301 研究[16]则显示APP治疗有化疗史mCRPC患者的中位生存期获益4.6个月(15.8个月vs 11.2个月),以上研究均提示早期首选AA将比多西他赛具有更大的优势。原因在于,新型抗雄药物与化疗药物之间存在交叉耐药性[17]。传统的二线药物主要以雄激素信号通路为靶点,以酮康唑为例:其在结构或功能上与AA高度相似,理论上两种药物之间一定存在交叉耐药性。在mCRPC阶段首先尝试使用传统二线抗雄药物可能会影响新型抗雄药物的疗效。同时,上述的这些传统药物仅能在有限的时间内控制肿瘤,患者无法治愈[18-19]。基于上述研究,可以合理解释本文患者在治疗过程中的一些现象:如患者2经AA治疗后,再服用比卡鲁胺无效,对序贯使用的多西他赛疗效也影响不大;但是,患者1先经比卡鲁胺与多西他赛治疗后,AA的治疗反应期明显缩短。同时也应该看到,虽然自2018年起AA已正式进入我国mCRPC治疗的医保用药目录,但受制于经济发展水平和用药条件的限制,我国大多数的初诊mPC患者仍然无法承担在早期的mHSPC期就开始服用AA的费用。二线抗雄药物虽无涉及生存资料的试验证据,但相关研究仍证实其能在一定程度上延缓患者接受化疗的时间,并改善患者的生活质量[20]。对无力承担新型抗雄药物治疗费用的患者,比卡鲁胺和多西他赛仍然是这些患者首选的一线治疗药物。
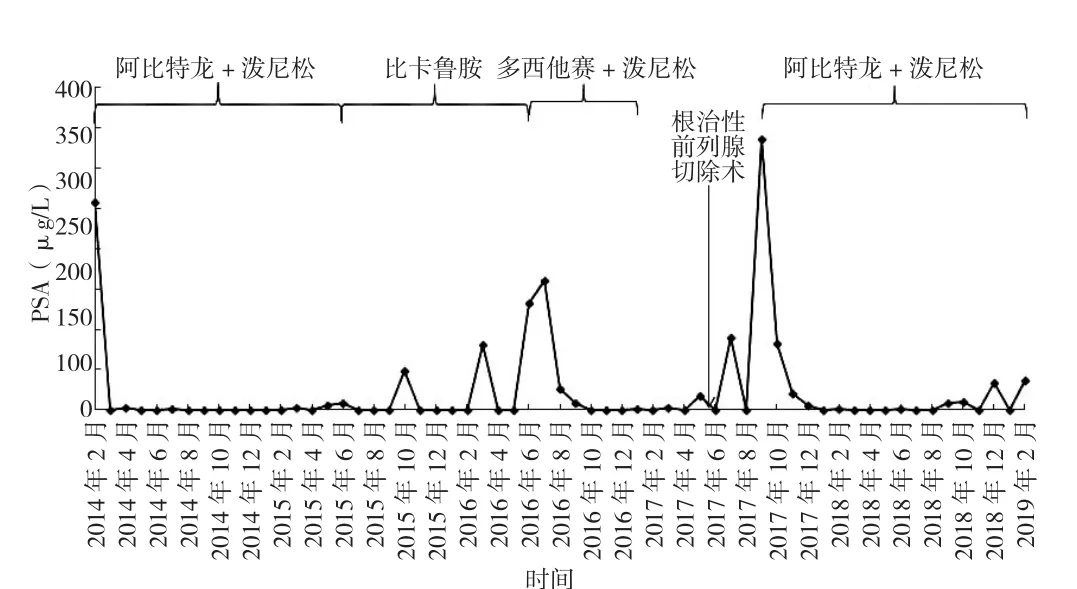
图3 患者2在随访期的治疗总结及PSA变化趋势图Figure 3 Treatment summary and PSA change trend of patient 2 during the follow-up period
然而,上述的一系列重要研究均只聚焦于AA的单次抗雄疗效,而没有意识到再次服用AA的治疗价值。在本研究中发现,在一定条件下再次服用AA治疗仍然有效,从而形成“三明治”方案。推测这一现象的可能原因是:随着肿瘤细胞对AA耐药的比例逐渐升高,由mHSPC阶段逐渐进展到mCRPC阶段。停用首次AA后,仍然有一定比例的敏感细胞继续扩增,或者是已经耐药的肿瘤细胞重拾敏感性,导致间隔一定时期再次使用AA治疗仍然有效。但值得强调的是,基于上述多种药物间交叉耐药的原理,理论上并不是任何患者在任何时机使用“三明治”方案均有效,也不太可能存在三次以上有效用药的“超级汉堡”。前述关于AA的几项经典研究[9-14],主要针对起始用药条件,而没有提出停药标准。从对比本文两例患者不同序贯方案取得的疗效不同来看,在首次AA治疗出现PSA升高后即应早期停药(而不应持续至出现影像学进展),可能更有利于延长第二次服用AA治疗的药物治疗反应期。本文两例观察对象虽均为肿瘤负荷较高的mPC患者,但序贯方案不同,疗效差异也较明显。与晚期(mCRPC)方案相比,早期(mHSPC)方案不仅能使患者在首次服用AA治疗时的反应性更好(17个月 vs 8个月),还可以使再次用药的治疗反应期更长(17个月 vs 5个月),最终形成能使mPC患者明显获益的 “三明治”方案,药物治疗反应期(41个月vs 30 个月)及最终的CSS(>62 个月 vs >40个月)均明显延长。
综上所述,通过回顾分析、对比本文两例mPC患者的诊疗过程提示,AA的抗雄“三明治”方案可作为延长mPC患者总体药物治疗反应期和CSS的新策略;并且,与在mCRPC期实施“三明治”治疗的晚期方案相比,在mHSPC期的早期用药方案可使现有的mPC序贯治疗得到进一步优化。
但是mPC患者的预后影响因素较多:如发病年龄、肿瘤负荷、基因突变等,治疗又常包括ADT、抗雄、手术、放疗、化疗等方法,不同患者采取不同的联合或序贯方案治疗时,疗效评估将是一项十分浩繁且久远的任务,目前难以对每种治疗方法的疗效进行绝对客观的评估,而仅能通过个案报道与经验总结,对重复服用AA的规律进行管窥。另外,再次服用AA的观察样本太少、临床资料不完整、并且缺乏药物敏感性基因检测支持等,均需要在后续的研究中充实和完善,并进行持续探讨。
作者贡献:王慧进行研究设计与实施、撰写论文并对文章负责;赵善坤、刘世雄收集资料;赵善坤整理资料;刘世雄实施手术;李欣进行质量控制及审校。
本文无利益冲突。
(本文作者访谈内容,请扫描下方二维码查看)


