高密度脂蛋白胆固醇预测肝硬化患者预后研究
虞晨燕 高静雯 殷民月 吴爱荣 朱锦舟 刘晓琳
肝硬化及其相关的慢性肝脏疾病目前已经成为全球日益严重的公共健康问题[1-2]。由于肝脏在脂质的合成、转运及代谢过程中发挥着重要作用,故肝硬化患者常伴有血脂水平异常[3-4]。研究表明,肝硬化与高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平的改变密切相关[5-6]。同时,血脂水平的降低会进一步促进肝脏疾病的恶化[7]。此外,HDL-C水平的降低也与非胆汁淤积性肝硬化患者的死亡或需要肝脏移植相关[8]。本研究分析肝硬化患者的HDL-C水平,并探讨其在肝硬化患者预后中的评估作用。
资料与方法
一、研究对象
收集苏州大学附属第一医院2017年1月至2020年12月就诊的684例肝硬化患者信息资料。入选标准:肝硬化诊断基于肝脏组织学或影像学(CT)结果。排除标准:存在实体器官移植者、肝细胞癌者胆汁淤积性肝硬化[9]。
二、研究方法
收集患者入院第一天的各项检查数据及临床情况,包括年龄、性别等一般基本资料,以及HDL-C等相关指标水平。根据上述指标计算终末期肝病模型(model for end-stage liver disease,MELD)分值[10]、终末期肝病联合钠离子模型(MELD combined with serum sodium concentration,MELD-Na)分值[11]、白蛋白-胆红素(albumin-bilirubin,ALBI)分值[12]。计算公式如下:MELD=3.78×ln[总胆红素(mg/dL)]+11.2×ln(INR)+9.6×ln[肌酐(mg/dL)]+6.4×(0:酒精性和胆汁淤积性肝硬化;1:病毒性和其他原因肝硬化);MELD-Na=MELD-Na-[0.025×MELD×(140-Na)]+140;ALBI=-0.085×白蛋白(g/L)+0.66×log[总胆红素(mg/dL)]。比较死亡患者与存活患者的一般资料及各项指标。
三、统计学方法
采用SPSS23.0统计软件分析。利用Kolmogorov-Smirnov检验方法对连续变量分布进行正态性检验。呈偏态分布的计量资料以M(P25,P75)表示,组间比较采用曼-惠特尼U检验,计数资料以例数和百分数表示,组间比较采用χ2检验。采用单因素二元logistic回归分析评估与肝硬化预后相关的因素,并将单因素分析中差异有统计学意义的指标进行多因素logistic回归分析。分别绘制HDL-C、MELD评分、MELD-Na评分、ALBI评分、HDL-C联合MELD评分的受试者工作特征(receiver operating characteristic curve, ROC)曲线,计算受试者工作特征曲线下面积(area under the receiver opreating characteristic curve, AUROC)。此外绘制校准曲线验证其准确度效力。P<0.05为差异有统计学意义。
结 果
一、纳入患者基本特征
684例肝硬化患者中,病毒性肝硬化304例,酒精性肝硬化57例,血吸虫性肝硬化129例,其他类型肝硬化194例。在院期间死亡94例,存活590例,死亡组患者年龄大于存活组,两组均以男性居多。死亡组患者的HDL-C水平低于存活组,而死亡组患者的MELD评分、MELD-Na评分、ALBI评分高于存活组,且差异均有统计学意义(均P<0.01)。
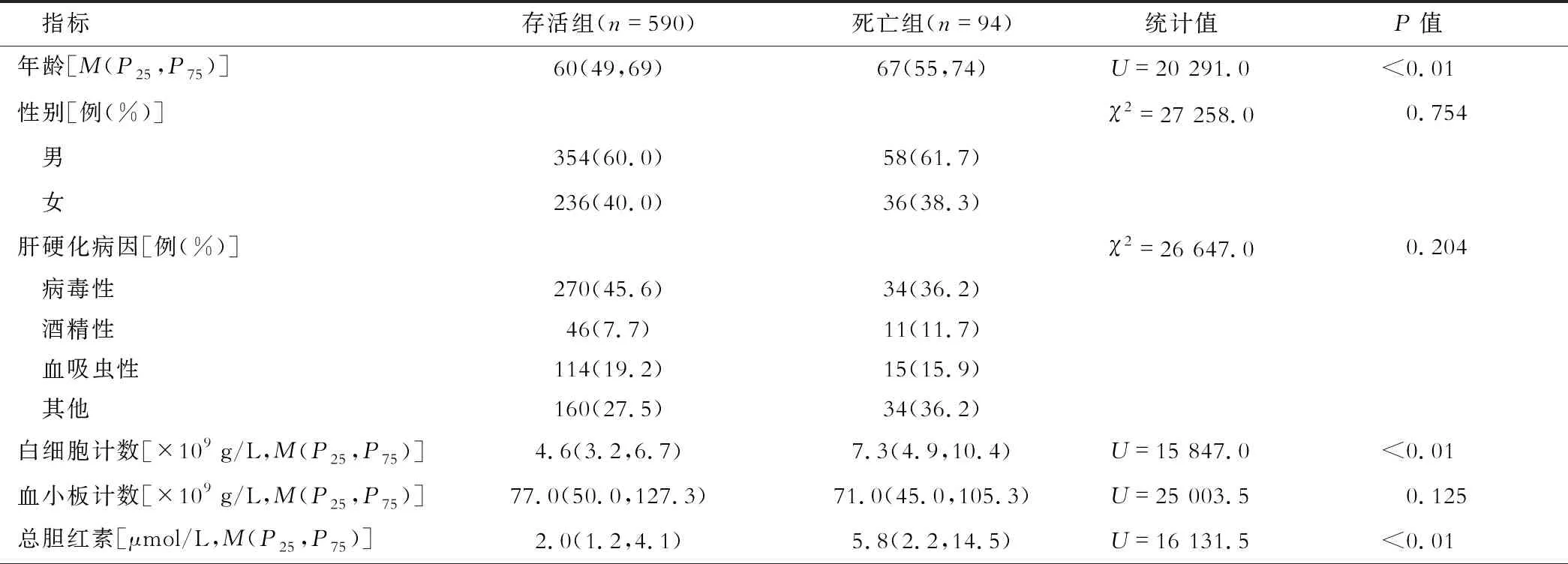
表1 存活组与死亡组患者各项指标比较
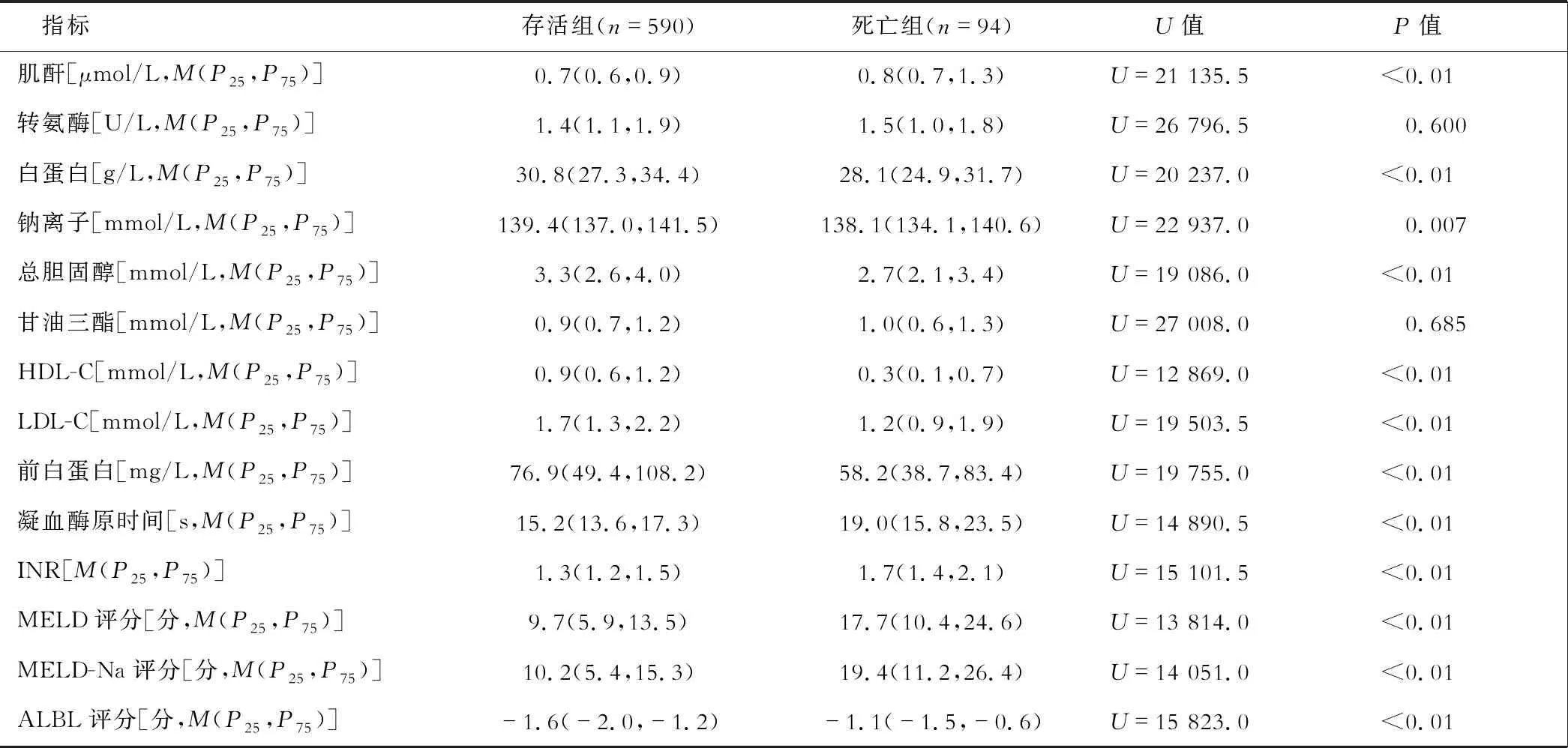
续表1
二、单因素及多因素分析
纳入的各项基本指标采用单因素分析,结果显示年龄、白细胞计数、肌酐、白蛋白、总胆固醇、HDL-C、LDL-C等因素均与肝硬化患者预后相关(P<0.01)。多因素logistic回归分析结果提示,年龄、白细胞计数、肌酐水平的升高是肝硬化预后不良的危险因素,而HDL-C水平的降低也提示肝硬化患者预后相对较差。见表2。
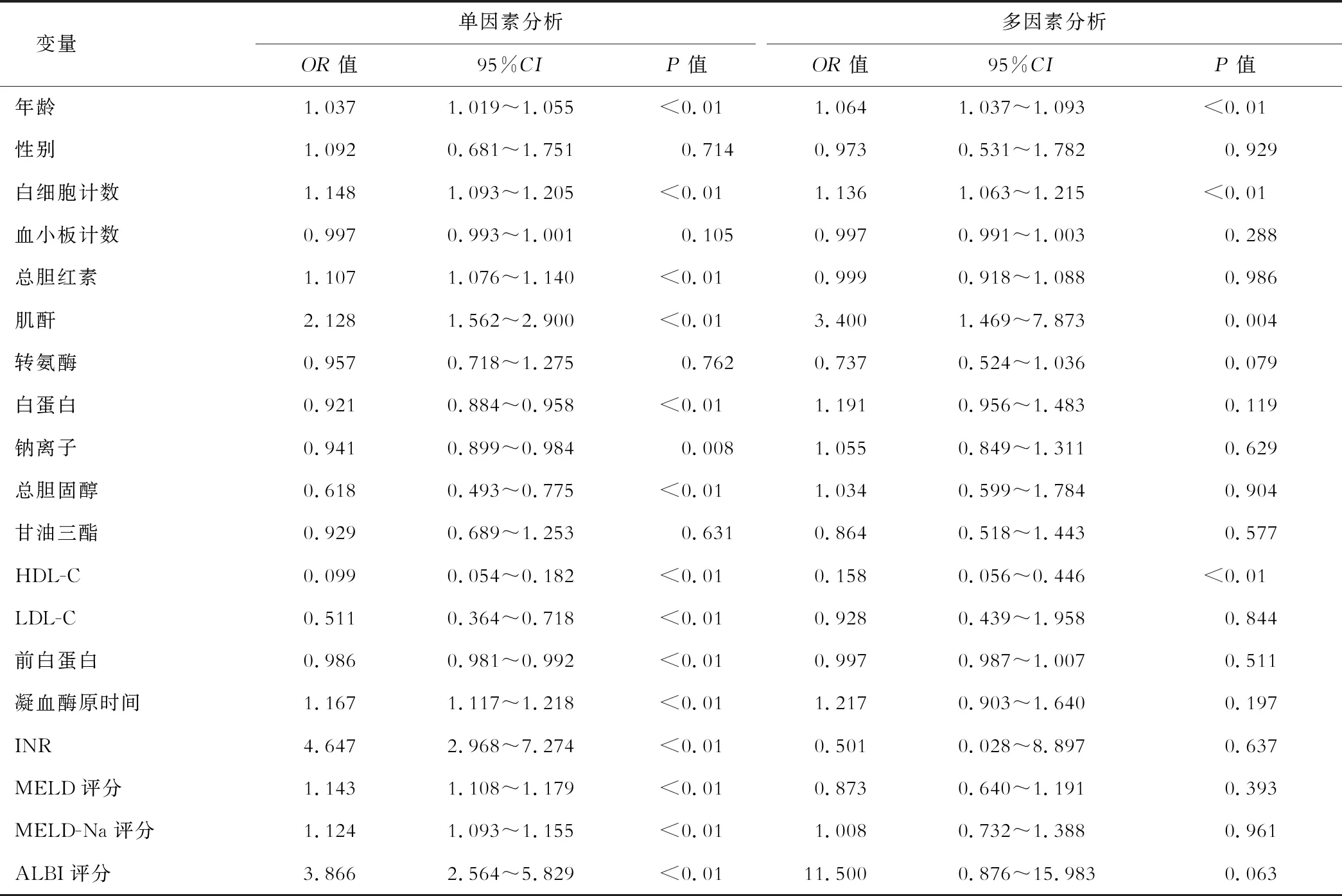
表2 各指标单因素及多因素分析
三、AUROC预测肝硬化患者预后
HDL-C、MELD评分、MELD-Na评分、ALBI评分、HDL-C联合MELD评分对肝硬化患者预后的判断能力如表3所示,结果表明,上述指标均能较好地预测肝硬化患者的预后且HDL-C联合MELD评分的预测能力最佳。此外,校准曲线提示HDL-C预测肝硬化患者预后准确度良好(见图1)。
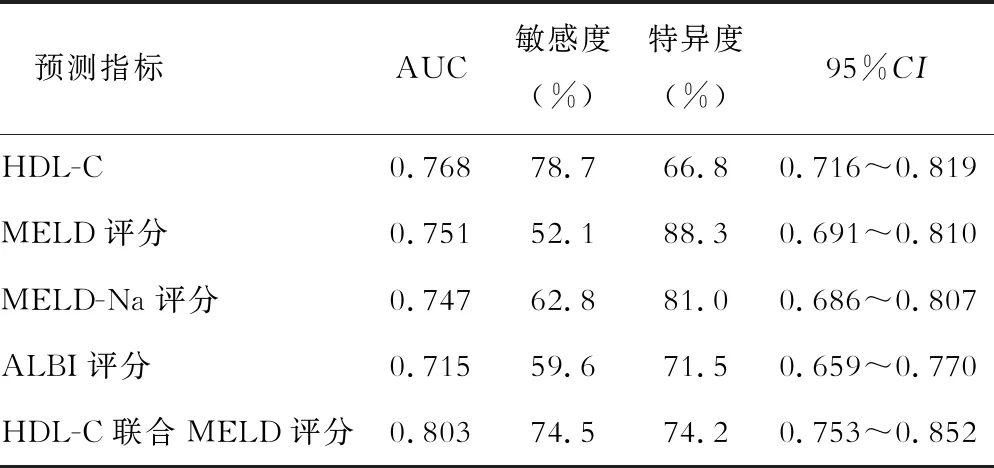
表3 HDL-C和各评分模型对肝硬化患者预后的判断能力
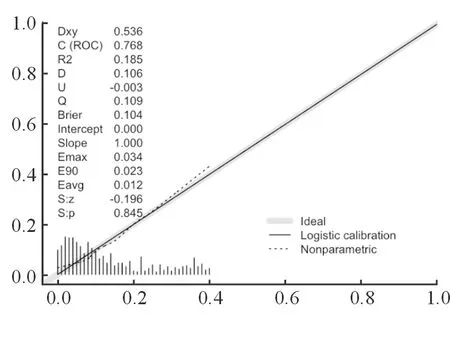
图1 校准曲线验证HDL-C判断死亡事件的准确度
讨 论
本研究结果显示,HDL-C是非胆汁淤积性肝硬化患者预后的强有力的预测因子,其预测肝硬化患者预后的价值与MELD评分、MELD-Na评分及ALBI评分相似;此外,白细胞计数和肌酐水平增高是肝硬化患者预后不良的危险因素,这可能与部分失代偿期肝硬化患者会并发自发性腹膜炎、肾功能受损相关。
MELD评分最初用于预测接受经颈静脉肝内门静脉分流术的患者的病死率,其计算公式中包括血清肌酐水平、总胆红素水平以及INR[10]。由于低钠血症是肝硬化患者预后的独立危险因素,为了提高MELD评分模型对肝硬化患者预后的预测能力,加入了钠离子浓度,形成MELD-Na评分[13, 14]。ALBI评分是由Johnson等[12]提出的一个评估肝癌患者预后的新型评分模型,包括白蛋白和总胆红素两个指标。
肝脏是合成、分泌和代谢脂质的主要器官,故肝细胞受损必然会导致血脂水平的改变,其机制可能与血浆脂蛋白紊乱,直接刺激肝星形细胞导致细胞外基质聚积有关[15]。Feher等[16]发现肝硬化患者HDL-C及前白蛋白水平降低。Breier等[17]指出终末期肝病患者的HDL-C及极低密度脂蛋白胆固醇水平下降。目前关于肝硬化患者HDL-C水平降低的机制尚未明确,可能与HDL-C能通过清除细胞中的胆固醇及其他脂类来调节细胞膜胆固醇水平,从而减少炎症因子受体信号传导相关[18]。有研究指出HDL-C可促进巨噬细胞中胆固醇的外流,从而阻止促炎细胞因子的脂质分泌[19]。也有研究发现,HDL-C水平与白细胞计数、CRP、IL-6、IL-8和TNF-α存在负相关,且继发感染的肝硬化患者的HDL-C水平明显降低,低水平的HDL-C会进一步促进肝衰竭的发生[20]。此外,在慢性肝功能衰竭的患者中,HDL-C的功能下降会促使慢加急性肝功能衰竭的发生,添加HDL-C可减轻细菌脂多糖诱导的炎症反应,恢复其肝脏功能[21]。本研究也证明了HDL-C能较为准确反映肝硬化患者肝功能的恶化程度,对非胆汁淤积性肝硬化患者预后有较高的敏感度和特异度,将HDL-C与MELD评分结合可进一步提高其预测价值。

