基于蛋白质组学的肝纤维化大鼠血清对肝星状细胞的作用靶点及信号通路研究
黎敏航 蔡碧莲 蒋云霞 罗伟生
肝硬化是临床各种慢性肝病发展的结果,调查结果显示,中国有约700万人罹患肝硬化,每年有46万肝癌新发病例[1]。肝纤维化是肝硬化的前兆,肝脏受到损伤后,肝星状细胞(liver stellate cells,HSC)被激活并增殖,转化为肌成纤维细胞,分泌细胞外基质(ECM)成分,HSC激活是肝纤维化过程中的关键事件[2-4]。探索HSC的激活机制对肝纤维化的临床与基础研究有积极意义。
材料与方法
一、仪器与试剂
大鼠肝星状细胞HSC-T6购自中国科学院昆明动物研究所细胞库、雄性SD大鼠购自湖南斯莱克景达实验动物有限公司、MTT试剂盒购自北京索莱宝科技有限公司、BCA蛋白浓度测定盒购自北京碧云天生物技术公司、高效液相色谱仪UltiMate 3000 UHPLC、串联质谱仪Q-Exactive HF由赛默飞世尔科技有限公司提供。
二、血清制备
雄性清洁级SD大鼠30只,体质量为(200±10)g,适应性喂养3 d后,随机分为实验组和正常组,其中正常组10只,实验组20只。实验组每周2次四氯化碳皮下注射诱导肝纤维化,共10周,病理检查确认大鼠肝纤维化模型造型成功后,在无菌状态下采集血清。正常组在相同条件下饲养相同天数,在无菌状态下采集血清。
三、细胞培养以及血清干预
HSC-T6放置在含10%胎牛血清的DMEM培养液中,37 ℃、体积分数为0.05的CO2条件下培养,待贴壁率为95%时,胰酶消化传代,每3~4天进行一次。取对数成长期的第4代,MTT法测定2组血清对相应组别的HSC的最大无毒浓度(TC0),作为细胞干预的诱导剂量。以实验组血清TC0浓度干预实验组HSC,先使用实验组血清预诱导液(20%实验组血清TC0的DMEM),24 h后弃去,加入完全的实验组诱导液(100%实验组血清TC0的DMEM)。正常组HSC使用正常组血清干预,操作过程同实验组。将以上各组放入培养箱24 h后,弃去培养液,用DMEM培养基洗涤2次,按照上述培养条件继续培养,每3天交换1次。诱导分化14 d后,分别取出各组HSC,提取全部蛋白质。
四、样品制备及检测
使用PBS洗净多余培养后,加入适量Cocktail,放置在冰上5 min,加10 mmol/L DTT,用超声波进行细胞碎裂后,以25 000×g离心15 min,取上清; 再加同浓度的DTT,56 ℃水浴1 h; 加浓度为55 mmol/L的IAM,暗室放置45 min,在25 000×g离心15 min后取上清即为蛋白质,BCA法测蛋白浓度。用酶分解蛋白质后,将所有样品各取10 g混合,混合液用高pH反相柱分离成10个组分。将收集到的溶液干燥后,再次溶解在0.1%甲酸中 ,进行液相色谱分离,分离后的肽段通过nanoESI源离子化后进入到串联质谱仪Q-Exactive HF进行DDA(data-dependent acquisition)模式检测,获得下机的DDA数据后,使用MaxQuant整合Andromeda引擎完成鉴定,接着使用Spectronaut对该结果进行谱图库构建。随后再进行DIA(data-independent acquisition)模式下的检测。
五、数据分析
采用Spectronaut和MSstats软件完成对肽段与蛋白质的定量工作,提取离子对峰面积后,对样品进行系统内误差校正,根据设定的正常组与线性混合效应模型来计算蛋白质之间是否有显著差异。采用Fold change >= 2 和<0.05 两个条件作为蛋白质显著性差异的筛选标准。在Uniprot(https://www.uniprot.org/uploadlists/)网站中使用基因本体(gene ontology,GO)数据库、京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)数据库对差异蛋白进行分析,将分析所得的差异蛋白信息输入到string数据库(https://string-db.org)查询蛋白质相互作用(protein-protein interaction,PPI)。
结 果
一、CCl4诱导大鼠肝纤维化
实验组大鼠肝组织Masson染色结果显示,汇管区周围可见明显纤维化,纤维间隔形成,包绕小叶,表明CCl4诱导大鼠肝纤维化造模成功(图1)。
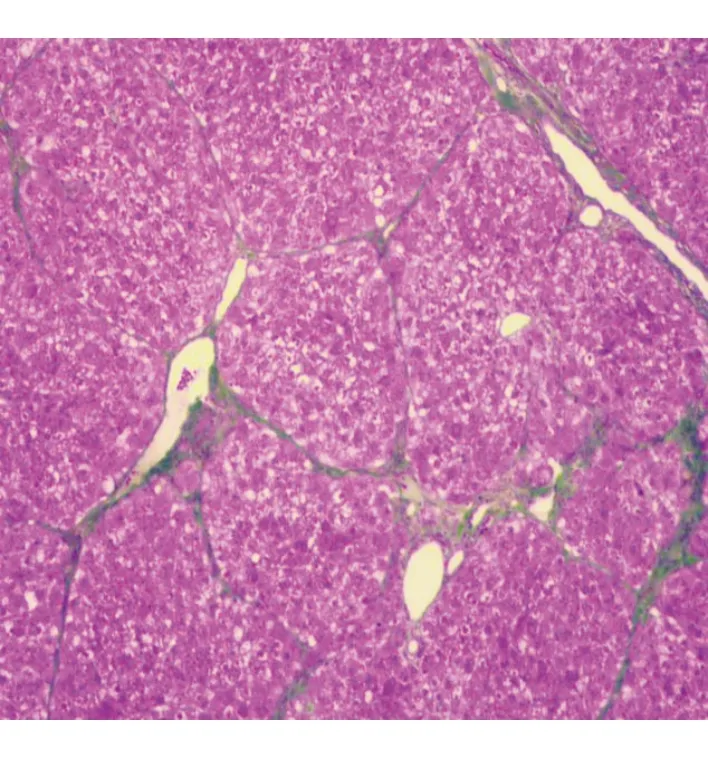
图1 实验组大鼠肝脏组织光学显微镜下表现(Masson染色×40)
二、MTT法测定两组大鼠血清TC0结果
不同浓度大鼠血清的实验组分别干预24 h后,MTT测定各组细胞的增殖情况,发现实验组大鼠血清的TC0浓度为0.19%,正常组大鼠血清的TC0浓度为3.12%。后续实验以各组最大无毒液浓度为诱导剂量,见表1。
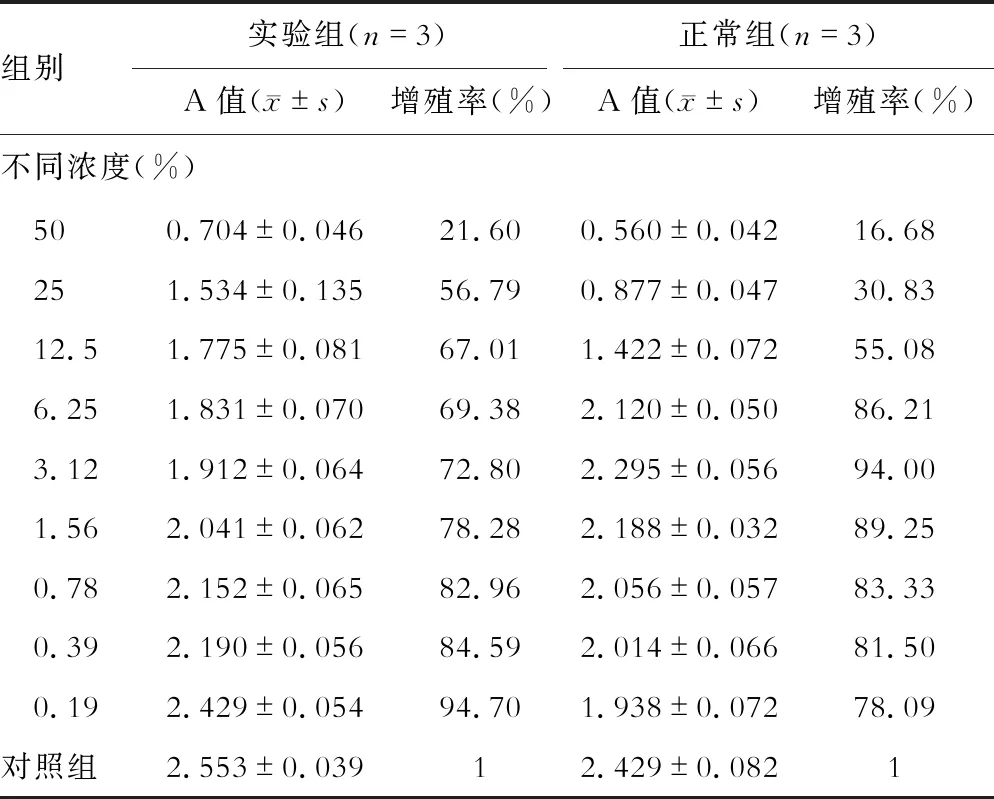
表1 实验组、正常组血清对HSC-T6细胞增殖的影响
三、样品蛋白质信息
一共鉴定出5984种蛋白质,显著表达差异蛋白质有221种,其中显著上调表达的蛋白质162种,显著下调表达的蛋白质59种。将所有蛋白质变化倍数以2为底,取对数并绘制火山图,见图2。显著上调与显著下调蛋白中差异最明显的10种蛋白质(除外未明确蛋白质)见表2。
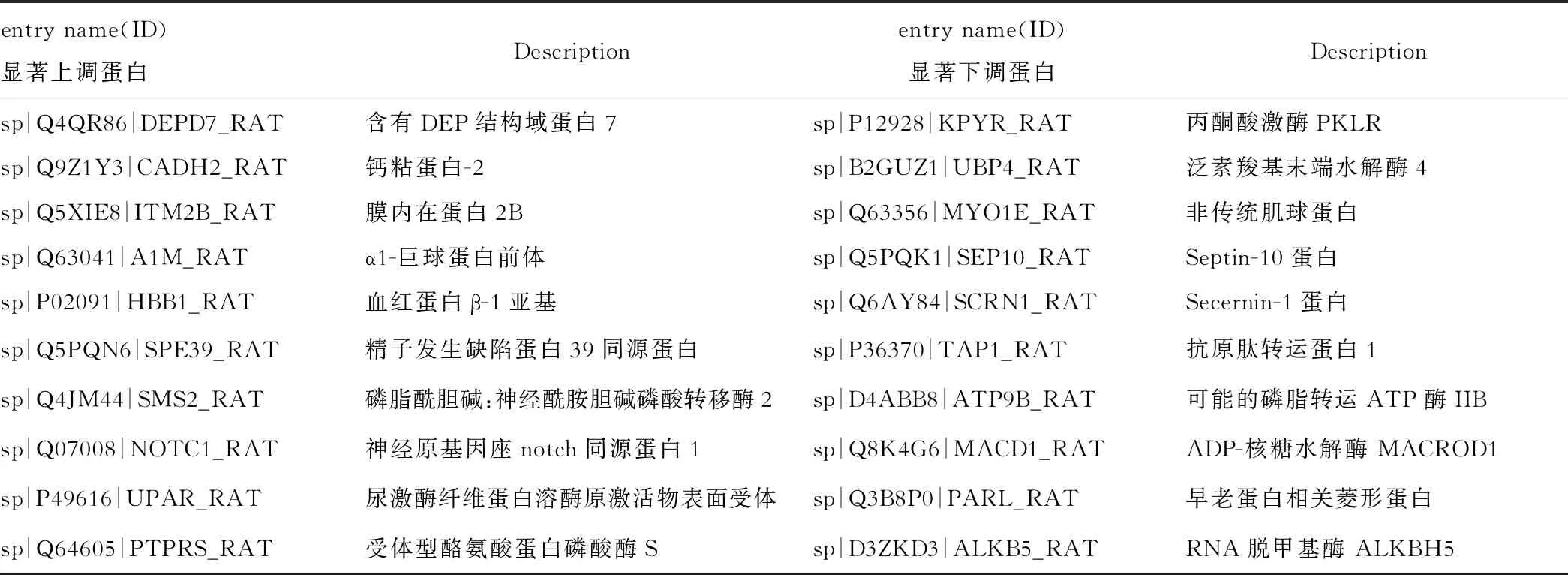
表2 差异表达最明显的10种蛋白质(上调表达+下调表达)
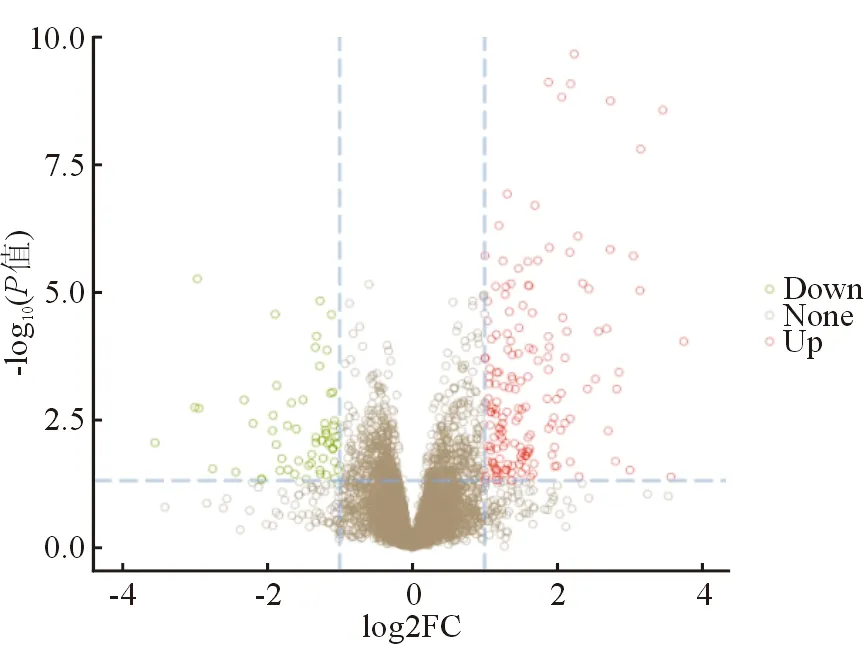
图2 差异蛋白火山图
四、GO注释以及GO富集分析
通过对差异蛋白进行GO分析,发现它们主要执行整合、催化活性和细胞功能调节等分子功能,细胞组件主要存在于细胞器与膜上,主要参与细胞过程、代谢过程、生物调节等26种生物过程。见图3。
五、差异蛋白通路富集分析
将得到的数据进行KEGG分析,发现差异蛋白涉及的通路共有44个,对这些通路进一步的富集分析,发现其中有22个通路存在显著富集的情况,部分通路包括蛋白质的情况为:类固醇生物合成6种,细胞粘附分子5种,细胞外基质受体相互作用5种,胆固醇代谢4种,Notch信号通路4种。见图4。
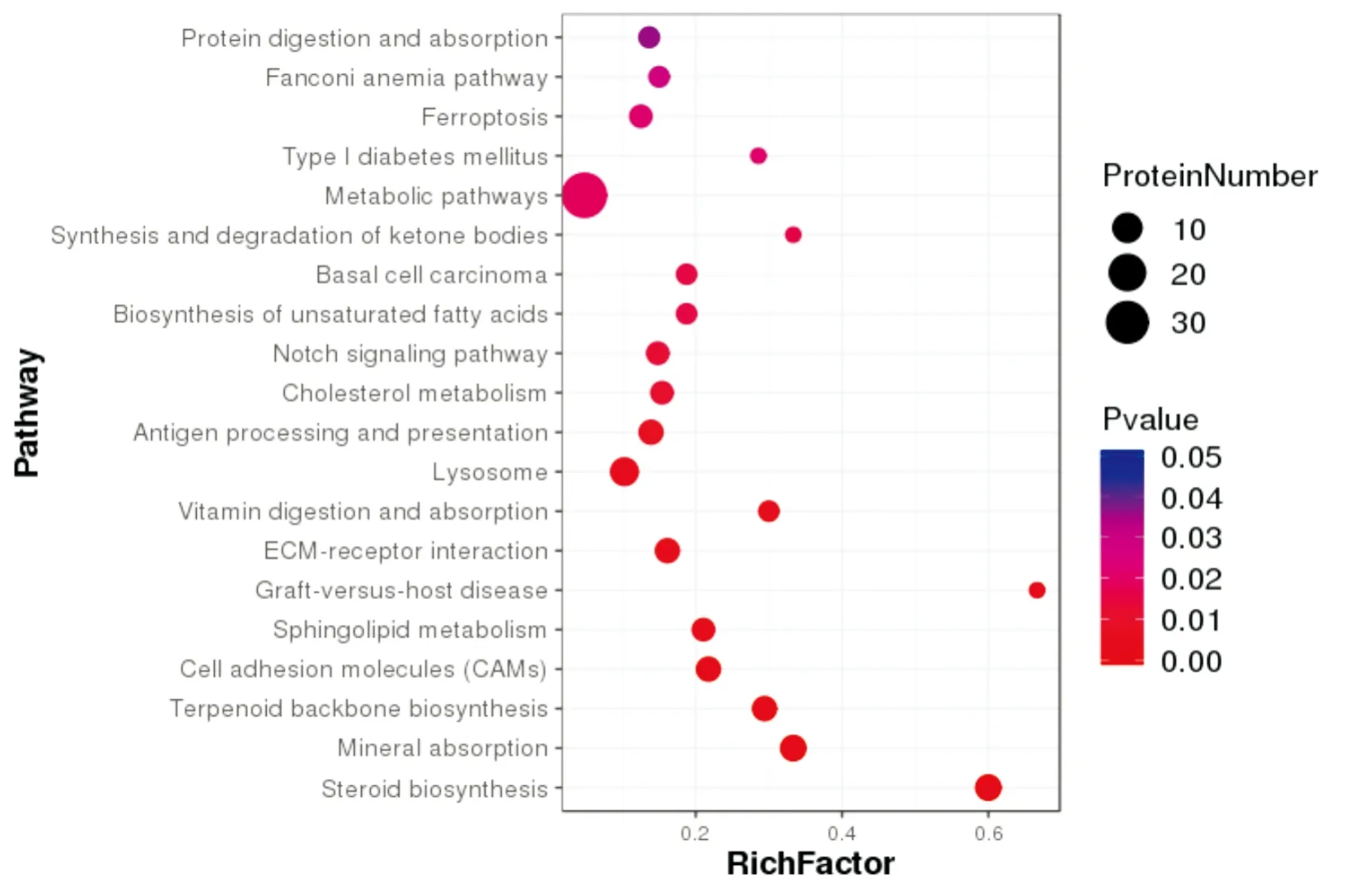
图4 KEGG富集分析结果气泡图
六、蛋白质相互作用分析
将分析所得的差异蛋白信息输入到string数据库进行PPI查询,在得到的结果中隐藏无连接的节点,并进行聚类分析得到图5。
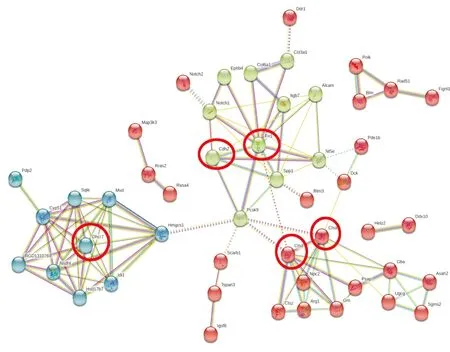
图5 蛋白互作分析图
从图中可发现,相互作用连线密集的区域可大致分为三部分,分别对这些区域的蛋白质的信息进行查询及分析,可以发现上方区域的蛋白质主要与ECM相关,下方区域主要与溶酶体的功能相关,左侧区域主要与胆固醇的代谢相关。纤维连接蛋白(Fn1)、钙粘蛋白-2(cdh2)、7- 脱氢胆固醇还原酶(Dhcr7)、组织蛋白酶D(Cstd)、组织蛋白酶A(Csta)为与周围蛋白质有广泛连接的关键蛋白。
讨 论
数据非依赖采集技术(DIA)是一种新兴技术,蛋白质组学研究中应用该技术能高效测定样品中丰度极低的蛋白分子,极大地提高了结果的可信度。GO富集分析的结果中有7条与胆固醇的合成及代谢相关;KEGG信号通路分析中:类固醇合成通路与胆固醇代谢通路属于显著富集的通路;PPI分析发现左侧相互间关系密切的蛋白质都与胆固醇的代谢合成相关,其中DHCR 7属于类固醇合成通路,是合成胆固醇的最后一个酶,这些都说明HSC的激活与胆固醇的代谢是高度相关的。研究表明,胆固醇能直接损伤肝细胞,诱导氧化应激,激活库普弗细胞以及HSC,游离胆固醇会在HSC中堆积,加重肝纤维化[5-6]。
钙粘蛋白-2是显著上调的蛋白质,通过PPI分析发现其处于重要地位。HSC被激活时就会上调该蛋白质的表达,表明抑制该蛋白质的功能可以显著促进已激活的HSC凋亡,说明钙粘蛋白-2是HSC激活过程中是重要的靶点蛋白[7-10]。
本研究结果显示,FN、CD44、Ⅰ型胶原蛋白都是显著上调蛋白,它们同属于细胞外基质受体相互作用信号通路,CD44是FN与Ⅰ型胶原蛋白的下游产物。其中CD44可帮助HSC在修复慢性肝脏损伤时进行细胞迁移,最终导致肝纤维化[11];FN是ECM的重要组成部分,在修复慢性肝脏损伤时,FN会持续增加,这个过程激活了HSC,同时TGF-β能够上调HSC的FN受体,增强激活作用[12]。
Notch信号通路在HSC激活的过程中起到了重要作用,Bansal等[13]与Chen等[14]的研究证明在肝纤维化过程中,该信号通路被显著激活,使用两种不同的Notch信号通路抑制剂都可以减轻肝纤维化程度。本研究中,被富集到该信号通路的差异蛋白质大部分处于上调状态,处于核心的Notch 1蛋白、Notch 2蛋白分别上调6倍与3倍,可认为Notch信号通路是HSC活化过程中的重要信号通路。
本研究从蛋白质组学的角度展示了HSC激活的机制可能与胆固醇代谢、细胞外基质相互作用、Notch信号通路等有关,其中钙粘蛋白-2、FN、Notch蛋白等可能是靶点蛋白,后续关于其激活机制的研究可以从这些方面继续深入,而对于防治肝纤维化的药物靶点也可以从这些方面筛选相关靶点。

