芹菜叶斑病病原菌的分离鉴定、生物学特性及其生防菌筛选
张建强,吴康莉,张晓梦,李佳佳,Abdramane Salah Zene,漆永红,沈 彤,,田永强,
(1.兰州交通大学 化学与生物工程学院,兰州 730070;2.兰州交通大学研究院,兰州 730070;3.甘肃省农业科学院 植物保护研究所,兰州 730070)
芹菜(Apiumgraveolens)属伞形科芹属植物,因耐低温是西部地区高原夏菜主要蔬菜栽培品种。近年来,定西市安定区高原夏菜发展迅速,芹菜是最主要的栽培品种之一[1]。因芹菜市场需求大,种植面积逐年增大和连作种植导致病虫害高发,尤其芹菜叶斑病是主要防治的病害之一,发病普遍,,一旦发生往往蔓延较快,从而给芹菜种植业造成严重损失。据文献记载,芹菜上发生的叶斑病主要有链格孢叶斑病(Alternariaspp.)[2-3]、尾孢叶斑病(Cercosporaapii)[4]、灰霉腐烂病(Botrytiscinerea)、菌核病(Sclerotiniasclerotiorum)、叶点霉叶斑病(Phyllostictaapii)[5-6]、斑枯病(Septoriaapiicola)[7]、细菌叶斑病(Pseudomonascichorii)[5]及细菌叶枯病(P.viridiflava)等[8]。在不同地区或不同品种上,芹菜病害发生种类和严重程度存在差异。
甘肃省定西市芹菜叶斑病发生比较普遍,但没有对其病原菌开展分离鉴定、生物学特性、药剂筛选和生物防治方面的深入研究工作,导致用药不科学,防治效果不佳,给农户造成极大的损失。对该病生物防治方面也未见报道。本试验通过芹菜叶斑病病原菌的分离和鉴定、生物学特性及生物防治药剂的筛选研究,以期进一步明确芹菜叶斑病的病原菌、病原菌生物学特性并筛选出生物防治菌剂,为该病害的大田防治提供理论参考。
1 材料与方法
1.1 供试材料
1.1.1 样品采集 2019年9月在甘肃省定西市安定区内官营镇(经度为104°24′41.9″,纬度为35°30′51.3″)蔬菜栽培地采集典型染病芹菜(品种为‘皇妃芹菜’)叶片,共采集10份样品。
1.1.2 供试生防菌株 选用兰州交通大学微生物实验室保藏的5株生防菌株,即蜡样芽胞杆菌Bacilluscereus(4-2-1)、贝莱斯芽孢杆菌B.velezensis(F3A)、甲基营养型芽孢杆菌B.methylotrophicus(9-2-1)、解淀粉芽孢杆菌B.amyloliquefaciens(SL1)、荧光假单胞菌Pseudomonasfluorescens(YG)。采用平板对峙培养法进行拮抗筛选试验。
1.2 方 法
1.2.1 病原菌的分离与纯化 采用常规组织分离法[9]进行病菌的分离,切取叶片病健交界处 3~4 mm×2~3 mm的组织,在70%的酒精中消毒5秒后用无菌水清洗3次,用灭菌滤纸拭干,接种于PDA培养基,在25 ℃培养箱培养约7 d时,产生孢子后进行单孢分离和纯化培养[10-11],将纯化好的菌种转接PDA斜面保存。
1.2.2 病原菌的致病性测定 根据柯赫氏法则,进行致病性测定。在菌落边缘用直径4 mm的打孔器打取菌饼,选取10叶龄皇妃芹菜叶片经酒精消毒和无菌针刺后,将菌饼贴于叶片的刺伤部位,每个菌株作3次重复接种,以刺伤但不接菌饼为空白对照。将接种后叶片置于已灭菌且底部加有湿滤纸片的平板25 ℃保湿培养,每天观察发病情况。5 d后对发病的叶片进行病菌的再分离培养,观察是否为同一种真菌侵染。
1.2.3 病原菌的形态鉴定 将致病菌接种在PDA平板上,在25 ℃培养箱中培养6 d后观察菌落特征,待产孢后,在显微镜下观察分生孢子形态特征。
1.2.4 病原菌的基因序列分析 DNA提取使用试剂盒(生工生物工程(上海)股份有限公司),刮取平板上新鲜菌丝体提取基因组DNA,分别选用ITS、GAPDH、TEF1、RPB2、Altal、endoPG和OPA10-2等引物(表1)进行PCR扩增。PCR反应体系25 μL,PCR扩增的反应参数:94 ℃预变性5 min,94 ℃变性45s,58 ℃退火45 s,72 ℃延伸1 min,共30个循环,最后72 ℃延伸5 min。扩增产物送深圳华大基因公司测序,测序结果提交GenBank,用BLAST进行比对分析,利用MEGA 6.0软件Neighbor Joining方法进行聚类,选择1 000个重复作Bootstrap值分析建立系统发育树。
1.3 病原菌生物学特性
1.3.1 碳氮源对病菌菌丝体生长的影响 以查氏培养基为基础培养基(蔗糖30 g/L、琼脂20 g/L、NaNO32 g/L、KH2PO41 g/L、MgSO4· 7H2O 0.5 g/L、KCl 0.5 g/L、FeSO40.01 g/L),分别用等质量的葡萄糖、乳糖、蔗糖、淀粉、玉米粉替换基础培养基中的碳源;分别用等质量的牛肉膏、蛋白胨、硝酸钾、硝酸铵、酵母浸粉替换基础培养基中的氮源,分别配制成不同碳源、氮源培养基,接菌后置于25 ℃恒温培养箱中,于7 d后利用十字交叉法测量菌落直径,每个处理作5次重复[17]。
1.3.2 温度、pH对病菌菌丝体生长的影响 设置培养基pH分别为5.0、5.5、6.0、6.5、7.0、 7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12、12.5共16个不同的梯度,将病原菌接种于不同pH的PDA平板上,于25 ℃恒温培养。设置温度为5、10、15、20、25、30、35 和 40 ℃ 8个温度梯度,病原菌接种于PDA平板上培养。7 d后利用十字交叉法测量不同pH和不同温度条件下的菌落直径,每个处理作 5 次重复[18]。
1.3.3 病原菌分生孢子萌发时间的测定 采用琼脂培养法[19],做一定改进,取灭菌载玻片,在灭菌冷却至约45 ℃的1.5%水琼脂培养基中沾一下,待水琼脂凝成薄层后,去掉一面水琼脂培养基,将有琼脂培养基的面朝上,置于培养皿中的“U”形玻棒,吸取10 μL孢子数为1.5×106的病菌孢子悬浮液均匀涂抹在水琼脂平板上,部加浸水的滤纸片保湿,置于25 ℃培养,分别在2、4、6、8、10、12、14和16 h时镜检孢子萌发率。每个处理重复3次。
1.3.4 温度、湿度、pH对病原菌分生孢子萌发的影响 配制1.5%水琼脂培养基,将pH调节为 5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0共8个梯度;温度设置5、10、15、20、25、30、35 和 40 ℃共8个梯度;湿度采用张佳星等[20]的方法,每个处理重复3次。孢子萌发保湿培养10 h后镜检,测定不同温度、湿度和pH条件下的孢子萌发率。
1.3.5 光照对病菌菌丝体生长的影响 将菌饼接种于PDA平板上,分别设置全光照、全黑暗和光暗交替 (12L/12D)3个处理,25 ℃恒温培养, 5 d后测量菌落直径,比较不同光照处理对菌丝体生长的影响,每个处理作3次重复。
1.3.6 光照对病菌孢子萌发的影响 将10 μL孢子数1.5×106的病菌孢子悬浮液涂布于水琼脂平板,设置全光照、全黑暗和光暗交替(12L/12D)3个处理,置于25 ℃保湿培养,10 h后镜检萌发率,每个处理作3次重复。
1.3.7 病原菌菌丝体与孢子致死温度的测定 将病原菌菌饼和孢子数为1.5×106的孢子悬浮液分别于50 ℃、55 ℃、60 ℃和65 ℃4个温度下水浴处理10 min,迅速冷却至25 ℃培养。10 h后镜检孢子萌发情况, 2 d后观察菌落生长情况。每个处理3次重复。

表1 研究中所用的引物序列Table 1 Primer sequences used in the study
1.4 生防菌抑菌活性测定
采用平板对峙培养法[21]。用直径5 mm的打孔器打取菌饼,接种于PDA平板中央。同时在其夹角呈90°的四周、间距靶标病菌3.0 cm处分别接种5种生防菌(菌株4-2-1、菌株F3A、菌株9-2-1、菌株SL1、菌株YG),25 ℃恒温培养6 d后测定病菌菌落直径,并计算生长抑制率,每个处理3个重复。并挑取抑菌率最高的平板病菌菌落边缘,用显微镜观察菌丝形态的变化。
抑制率=(对照组菌落直径-试验组菌落直径)/对照组菌落直径×100%
1.5 数据处理
利用Excel2003和SPSS 19.0软件对试验数据进行统计分析和Origin8.0软件作图,并应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 田间发病症状和发生情况
本试验调查了甘肃省定西市安定区芹菜叶斑病害,一般从老叶叶背开始发病,严重时幼叶发病,高温高湿的环境有利于发病。最初的叶片症状是许多浅棕色小斑点,圆形或不规则形,病症后期病斑会逐渐增多,并且多个病斑相互汇合成不规则形的大褐色病斑,严重时整片叶片发黄,枯萎死亡。该病害发生严重时感染芹菜茎部,与叶片症状一致(图1)。该病害发生比较普遍,发生率为25% ~ 45%,且传播速度快,给当地芹菜生产造成很大的经济损失。
2.2 病原菌的分离和致病性测定结果
通过常规分离法得到1株真菌Q1。依据柯赫氏法则开展回接试验,发现刺伤接种24 h后可在叶片上出现水渍状浅褐色小斑点,后发展成近圆形或不规则形坏死病斑,病斑呈黄褐色至深褐色,边缘清晰,并着生少量灰色菌丝,随后逐渐扩大成褐色典型病斑。7 d后芹菜叶片上的褐色病斑逐渐扩大并坏死,而对照组均未发病(图1)。对人工接种发病组织再次病菌分离,成功获得了原分离病菌Q1,证明该菌株为芹菜叶斑病的 病原。
2.3 病原菌形态学特征和分子生物学鉴定
2.3.1 病原菌形态特征 病原菌在PDA平板生长6 d时,菌落直径为8 cm,菌落初呈墨绿色,后呈黑灰色,中央灰白色边缘为灰橄榄色,菌丝浓密,绒毛状;菌丝无色,有隔;分生孢子梗直或弯曲,少有分支;分生孢子单生或短链生,倒棍棒状或卵形,黄褐色至青褐色,具横膈膜3~7个,纵、斜膈膜1~3个,孢子长20.0~50.0 μm,宽 3.5~14.0 μm,并参照文献进行形态鉴定[22-27],确定菌株Q1为细极链格孢(A.tenuissima) (图2)。
2.3.2 病原菌的基因序列分析 利用ITS、GAPDH、TEF1、RPB2、Altal、endoPG、OPA10-2等7个基因扩增和测序,在NCBI进行 BLAST比对分析,该菌属于Alternaria属,将基因序列提交GenBank获得登录号分别为:MN046364,MW016006,MW016001, MW016002,MW016 003,MW016004,MW016005。参照 Weir等[28]的研究方法,从GenBank中选取21个菌株的序列作为参照序列,利用7个基因序列,结合链格孢菌属其他同属菌株,以邻接法共同构建系统发育树(图3)。该系统发育树中菌株Q1的ITS基因与细极链格孢(A.tenuissima)和交链链格孢(A.alternata)聚在一个独立进化分支,同源性相近,无法将其区分。而菌株Q1的GAPDH、TEF1、Altal、OPA10-2和endoPG 5段基因均与细极链格孢(A.tenuissima)在系统发育树上聚在一起。并参考杨丽萍等[29],Zhao等[26]运用多基因鉴定细极链格孢的分析方法,最终确定菌株Q1为细极链格孢(A.tenuissima)。
2.4 病原菌生物学特性
2.4.1 碳、氮源对病菌菌丝体生长的影响 碳、氮源对病菌菌丝体生长有影响(图4),玉米粉为碳源的培养基生长最快,菌丝体生长浓密,7 d菌落直径达8.5 cm;其他培养基的利用相对较低。该菌在以硝酸钾为氮源的培养基上生长最快,7 d时菌落直径达6.0 cm,但菌落比较稀疏;蛋白胨次之,7 d时菌落直径达5.6 cm,菌落较厚;其他培养基的利用率较低,菌丝体生长缓慢。
2.4.2 温度、pH对菌丝体生长的影响 不同温度和pH处理对病原菌菌丝体生长的影响存在差异(图5)。该菌在5~40 ℃均可生长,其中25 ℃生长最快,7 d菌落直径达8.4 cm。该病菌在pH 5~12.5之间均可生长,pH 7.5时菌丝体生长 最快。
2.4.3 病原菌分生孢子的萌发率 结果如表2所示,处理2 h病菌孢子开始萌发产生芽管,6 h时孢子大量萌发,芽管不断伸长;而16 h萌发率达到最高,达98.6%。

表2 病原菌孢子在不同时间的萌发率Table 2 Germination rate of pathogen spores at different time
2.4.4 温度、湿度、pH对病原菌分生孢子萌发的影响 在处理10 h时镜检,病菌分生孢子在 5~35 ℃之间的萌发率均达18.6%以上,在10 ℃以上随温度增加,其萌发率显著增加,最佳萌发温度为25 ℃,萌发率达94.6%,但在40 ℃时其孢子萌发率显著下降6%。病原菌孢子在pH4-12范围内均可萌发,但在pH 7时萌发率达90.6%;在相对湿度为100%和自由水条件下萌发率分别为96.5%和98.1%,与其他处理存在显著差异(图6)。
2.4.5 光照对病原菌菌丝体生长和孢子萌发的影响 连续光照、光暗交替和连续黑暗条件下病菌菌丝体生长存在显著性差异(表3)。在连续光照条件下菌丝体生长最好,4 d菌落直径达5.5 cm;而在连续黑暗条件下菌丝体生长最差。分生孢子在全光照、光暗交替及全黑暗条件下差异不显著,表明光照对分生孢子的萌发无显著影响。

表3 光照对病菌菌丝体生长和孢子萌发率的影响Table 3 Effects of light on mycelium growth and spore germination rate
2.4.6 病原菌菌丝体及孢子致死温度的测定 菌株Q1培养2 d观察,在50 ℃水浴处理10 min后菌丝仍可生长,在55 ℃及更高温度处理后不再生长,表明该菌致死温度为55 ℃ 10 min。分生孢子在50 ℃水浴处理10 min后仍能萌发,但在55 ℃及其以上温度处理10 min则不再萌发,结果表明分生孢子的致死温度为 55 ℃ 10 min。
2.5 生防菌抑菌筛选
以5种生防菌(菌株4-2-1、菌株F3A、菌株9-2-1、菌株SL1、菌株YG)对芹菜叶斑病菌作对峙培养(图7)。6 d后发现5种供试菌均对该病菌具有抑菌活性(表4),其中解淀粉芽孢杆菌SL1抑菌率最高,达到69.80%。与对照组相比,病菌生长受抑制后菌丝膨大变粗或者皱缩变细,分枝增多,节间缩短,出现囊泡状畸形,并伴有细胞壁破裂等现象(图8),表明供试生防菌可产生抑菌活性物质。
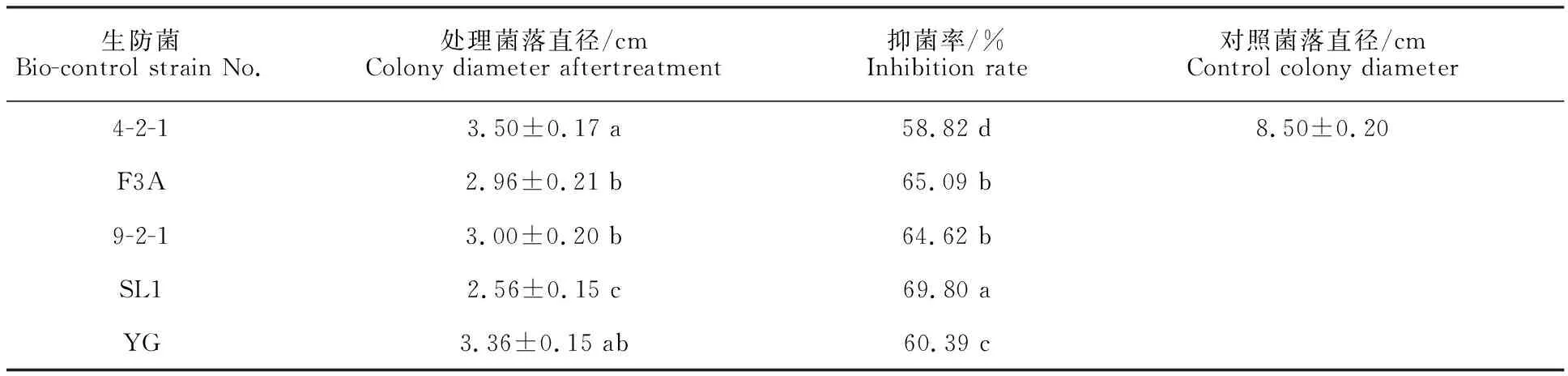
表4 供试生防菌对病菌菌丝体生长的抑制效果Table 4 Inhibitory effect of biocontrol bacteria on the growth of mycelium
3 结论与讨论
芹菜叶斑病是芹菜生产中普遍发生的一种主要病害,在澳大利亚、加拿大、巴西、古巴、几内亚、丹麦和意大利等均有报道。我国对芹菜链格孢叶斑病缺乏深入调查研究,本试验明确了该病害的田间侵染部位和发病症状,以老叶先发病,病斑多散生,大小不等,直径0.2~0.8cm,深褐色,边缘清晰,病斑中间有稀疏霉层,且易开裂;保湿培养易产生大量倒棍棒状的分生孢子。近年来,随着甘肃省芹菜种植面积的不断增加,芹菜叶斑病的发生呈逐渐加重趋势,研究叶斑病病原菌的生物学特性和生物防治具有中药意义。
明确病害的病原是研究其发生规律和制定有效防治措施的前提。据报道,链格孢菌是常见的植物叶斑类病害的主要病原菌[30],王莹莹等[31]对中国14个省份蔬菜主产区的病害调查发现,8个种的链格孢菌可侵染茄科、葫芦科、十字花科和百合科的32种寄主植物。张天宇在芹菜上描述A.burnsii,但指出依其形态应属于A.tenuissima群。报道称芹菜上发生的叶斑病主要有链格孢叶斑病(Alternariaspp.)[32],该报道确定了芹菜叶斑病病菌为链格孢属,仅依据形态特征确定为巴恩斯链格孢(A.burnsii),但没有开展分子生物学鉴定和病原生物学特性研究。本研究通过病原菌形态学特征和多基因分子序列鉴定,首次明确了引起甘肃省定西市芹菜叶斑病害的病原为细极链格孢(A.tenuissima),因此,将该病害称为芹菜链孢菌叶斑病。
病原菌生物学特性的研究为防治药剂的筛选和田间管理提供理论依据。本研究通过对芹菜链格孢叶斑病菌生物学特性的研究,发现该病菌菌丝体生长和孢子萌发的最适温度均为25 ℃,pH为中性、环境高湿时有利于菌丝体生长和孢子萌发。该病菌可利用多种碳氮源,但以玉米粉和硝酸钾为最佳碳源和氮源。光照更有利于菌丝体生长,但对孢子萌发无显著影响,菌丝和孢子的致死温度均为55 ℃处理10 min。这些特性说明芹菜链孢菌叶斑病在低温高湿易发病,与文献田间调查结果一致,在芹菜栽培期7-8月份易发病,特别是20~30 ℃,高温多雨、露水或浇水频繁时易侵染。因此,这个阶段也是防治叶斑病的关键时期[33-35]。
目前,芹菜生产上对叶斑病的防治主要以化学药剂为主,但过量施用化学药剂可造成抗药性增加、农产品农药残留和水土污染等食品安全和环境污染问题,基于蔬菜对农药要求的特殊性,筛选利用高效和环境友好的生防菌可有效解决化学农药带来的弊端。利用枯草芽孢杆菌防治三叶木通叶斑病(A.tenuissima)可显著抑制病害发生[35],俞家楠等[36]研究表明环状芽孢杆菌对银杏叶斑病细极链格孢的抑菌效果较好,抑菌率高达 80.88%。本研究通过生防菌株拮抗筛选,发现蜡样芽胞杆菌4-2-1、贝莱斯芽孢杆菌F3A、甲基营养型芽孢杆菌9-2-1、解淀粉芽孢杆菌SL1、荧光假单胞菌YG等5种生防菌均对芹菜叶斑病害的病原细极链格孢具有较好的生防效果,其中解淀粉芽孢杆菌的抑菌效果最好,抑菌率达到69.80%,具有开发生物防治菌剂的潜力。关于解淀粉芽孢杆菌对芹菜叶斑病的田间防治效果有待于进一步研究。

