鼠曲草对大鼠膀胱癌形成的抑制作用研究
王海东 林飞 林伟青
摘要 目的:观察鼠曲草提取液对N-甲基亚硝基脲(MNU)诱发膀胱肿瘤的抑制作用,并初步探讨其机制。方法:将120只SD大鼠按照随机数字表法分为对照组、高、中、低剂量组4组,每组30只。经膀胱内灌注MNU(1 mg/次,1次/2周,共4次)诱发膀胱肿瘤,对照组正常饮水,高、中、低剂量组分别以高、中、低剂量鼠曲草提取液代水喂食,于第12周处死全部大鼠,取其膀胱组织标本,观察其成瘤率。TUNEL法检测肿瘤细胞调亡情况,反转录聚合酶链反应(RT-PCR)法检测大鼠膀胱癌组织存活蛋白(Survivin)表达。结果:高、中、低剂量组大鼠膀胱癌成瘤率分别为60%(18/30)、75.86%(22/29)、86.21%(25/29),而对照组大鼠膀胱癌成瘤率为100%(28/28)。TUNEL法原位检测发现鼠曲草提取液可显著促进膀胱癌细胞的调亡,且与剂量相关;大鼠膀胱癌组织Survivin表达显示鼠曲草提取液可显著降低大鼠膀胱癌组织中Survivin表达。结论:鼠曲草提取液对大鼠膀胱癌形成有明显抑制作用。
关键词 鼠曲草;膀胱癌;甲基亚硝基脲;存活蛋白;反转录聚合酶链反应;凋亡;成瘤率;黄酮类化合物
Abstract Objective:To observe the inhibitory effect of the gnaphalium affine extracts on the formation of N-methylnitrosourea(MNU)-induced bladder tumor in rats,and to initially explore its mechanism.Methods:A total of 120 SD rats were divided randomly into 4 groups,high,medium and low concentration group,with 30 cases in each group.Bladder tumor was induced by intravesical instillation of MNU(1 mg/ times,once every 2 weeks,4 times),inducing bladder tumors.The control group was given normal drinking water.High,medium and low doses groups were fed with high,medium and low concentration of the extract of gnaphalium affine extracts.All rats were killed at the 12th week,and their bladder tissue samples were taken to observe the difference in tumor formation rate.We took a specimen of its bladder tissue and observed its tumor formation rate.TUNEL method was used to detect the apoptosis of tumor cells.The expression of Survivin in rat bladder cancer tissues was detected by RT-PCR.Results:The tumor formation rate of bladder cancer in high,medium and low concentration groups was 60.11%(18/30),75.86%(22/29) and 86.21%(25/29) respectively,while the rate of bladder cancer in the control group was 100%(28/28).In situ detection by TUNEL method,it was found that the gnaphalium affine extract can significantly promote the apoptosis of bladder cancer cells,which was related to the concentration; the expression of Survivin in rat bladder cancer tissues showed that the gnaphalium affine extract can significantly reduce the expression of survivin in rat bladder cancer tissues.Conclusion:The Gnaphalium affine extracts has a significant inhibitory effect on bladder cancer formation in rats.
Keywords Gnaphalium affine; Bladder cancer; N-methy-N-nitrosourea; Survivin; Reverse transcription polymerase chain reaction; Apoptosis; Tumor formation rate; Flavonoids
中圖分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.11.012
膀胱癌在我国是泌尿系统中最常见的恶性肿瘤,膀胱癌发病机制尚不明确,目前临床治疗膀胱癌大多采取切除膀胱以及膀胱灌注卡介苗,但膀胱癌复发率仍较高,目前尚无高效安全的预防治疗措施[1]。因此发挥中医药的优势,寻求高效低毒的方法,近年来国内外学者正积极研究探索有关防治方法,有关中药抗肿瘤的研究近年来报道逐渐增多[2-3]。
鼠曲草(Gnaphalium affine D.Don)又名白艾、佛耳草、清明菜,是药食两用野生植物,在中国民间已有几千年的使用历史,广泛用于各种疾病治疗和保健。进一步研究开发其药用价值有着十分重要的意义。本实验尝试通过动物实验研究观察比较鼠曲草提取液对大鼠膀胱癌形成是否存在抑制作用,初步探索鼠曲草对膀胱癌的预防机制。
1 材料与方法
1.1 材料
1.1.1 动物 选取10~12周龄无特定病原体(SPF)级雌性SD大鼠120只,体质量200~220 g,购自南昌大学医学院实验动物中心,动物生产许可证号:SYXK2010-0002。饲养于南昌大学医学院实验动物中心,温度(20±2)℃,湿度40%~60%,12 h周期性光照环境,普通饲料喂养,自由饮食。该项目通过伦理审批委员会审批[伦理审批号:scxk(湘)2010-0002]。
1.1.2 试剂 N-甲基亚硝基脲(MNU)(Sigma公司,美国,批号:20130906),鼠曲草(江西医学院第一附属医院药剂科中药房,货号:201609080016)。鼠曲草提取液水提取物的制备按水煎煮工艺由江西省人民医院制剂室自制,浓度分别为2 mg/mL,4 mg/mL,8 mg/mL。TUNEL试剂盒(上海罗氏制药有限公司,批号:20131217),安尔碘皮肤消毒剂(江西汇康实业有限公司,批号:20150908),水合氯醛(批号:20130506)、甲醛(批号:20140308)购于上海酶联生物科技有限公司。
1.1.3 仪器 显微镜(上海豫光仪器有限公司,型号:WMF-3580),多功能酶标仪(Tecan,瑞士,型号:Infinite 200 PRO),荧光定量PCR扩增仪(Roche,瑞士,型号:Light Cycler 480)。
1.2 方法
1.2.1 分组与模型制备 所有SD大鼠使用前在实验室喂养1周以适应环境,按照随机数字表法分为对照组、高、中、低剂量组4组,每组30只。以水合氯醛(浓度为10%,100 mg/kg)进行腹腔内注射,麻醉起效后将大鼠固定于仰卧位,用安尔碘皮肤消毒剂消毒大鼠尿道外口,以长约5 cm的无菌硬膜外导管代替导尿管,涂抹无菌甘油后,行膀胱灌注MNU(剂量1 mg/mL),1 mL/次。1次/2周,共4次。
1.2.2 给药方法 对照组正常饮水,高、中、低剂量组分别以高、中、低浓度鼠曲草提取液代水喂食。
1.2.3 检测指标与方法 于第12周处死全部大鼠,取其膀胱组织标本,低温生理盐水洗净,10%甲醛固定24 h,脱水,石蜡包埋,切片4~5 μm,行苏木精-伊红(HE)染色,置显微镜下观察其病理变化。1)原位末端转移酶标记TUNEL法检测癌细胞凋亡:具体步骤按说明书进行,显微镜下凋亡细胞的细胞核呈现蓝黑色为阳性,每张切片中随机选择5个高倍(200倍)镜视野,在每个视野中分别计数100个细胞,每组中随机选择3张共1 500个细胞,同时统计其中所含的阳性细胞数。凋亡指数(%)=阳性细胞数/1 500×100%。2)Survivin检测:通过Light Cycler 480荧光定量PCR扩增仪采用巢式RT-PCR相对定量法检测膀胱癌大鼠肿瘤组织中Survivin(280 bp)特异性mRNA条带并以β-actin(309 bp)为参照[4]。
1.3 统计学方法 采用SPSS 18.0统计软件进行数据分析,其中计量资料用均数±标准差(±s)表示;计量资料的统计采用方差分析,计数资料以百分率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各組SD大鼠的膀胱癌成瘤率 实验过程中,由于麻醉过量、感染和恶病质,中、低剂量组大鼠各死亡1只,对照组死亡2只,对照组在第12周膀胱癌成瘤率为100%(28/28),高、中、低剂量组大鼠膀胱癌成瘤率分别为60%(18/30)、75.86%(22/29)、86.21%(25/29),比较各组膀胱癌成瘤率差异有统计学意义(P=0.027)。
2.2 鼠曲草提取液对细胞凋亡指数的影响 高、中、低剂量组大鼠膀胱癌细胞凋亡指数(此凋亡指数无单位,对照组数据后有%,高中低剂量组也有)分别为(12.424 2±0.282 6)%、(10.292 3±0.137 2)%、(8.577 8±0.143 5)%,对照组膀胱癌细胞凋亡指数为(4.083 3±0.105 7)%,组间方差分析显示差异有统计学意义(P<0.01),另经相关性分析显示大鼠膀胱癌细胞凋亡指数与鼠曲草剂量正相关。
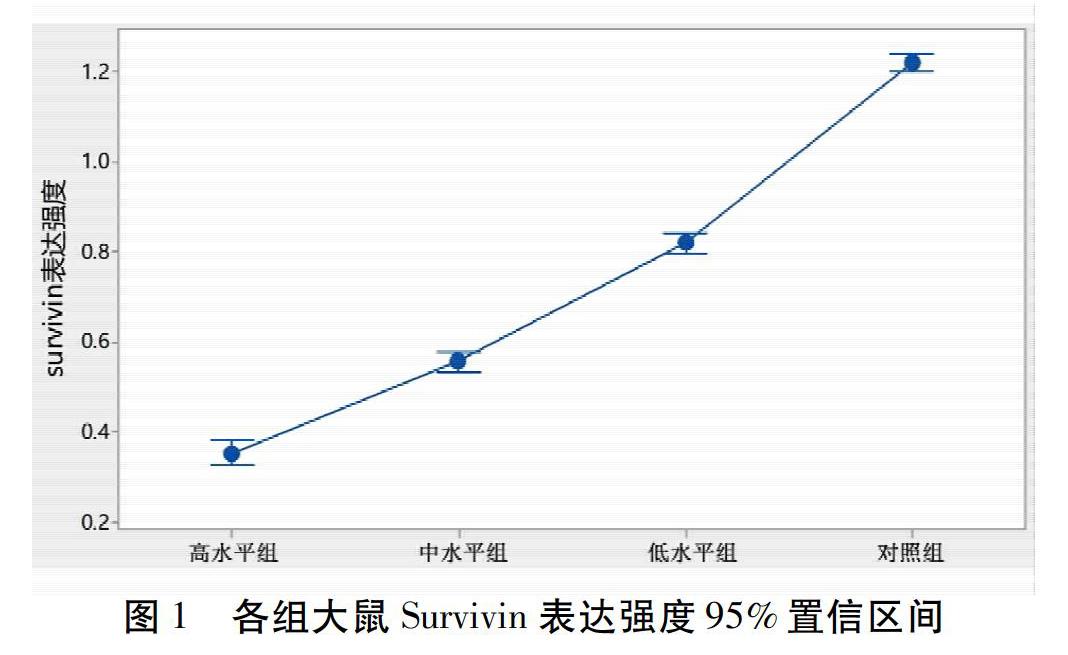
2.3 鼠曲草提取液对大鼠膀胱癌组织中Survivin表达的影响 高、中、低剂量组大鼠膀胱癌组织中Survivin表达阳性率分别为83.3%(15/18);90.9%(20/22);92%(23/25);对照组膀胱癌组织中Survivin表达阳性率为100%(28/28),差异无统计学意义(P>0.05)。而高、中、低剂量组大鼠膀胱癌组织中Survivin表达分别为0.352 7±0.029 9、0.557 5±0.026 5、0.820 9±0.048 9;对照组膀胱癌组织中Survivin表达强度为1.223 9±0.071 1,组间差异有统计学意义(P<0.01),另经相关性分析显示大鼠膀胱癌组织中Survivin表达强度与鼠曲草剂量正相关。见图1。
3 讨论
膀胱癌已成为中国男性常见的恶性肿瘤,据调查,城市人口膀胱癌发病率(6.47/10万)明显高于农村(4.30/10万),这可能与城市人口和农村人口的饮食差别有关[5],值得我们深入研究探索。
鼠曲草在我国各地均盛产,以野生为主,也分布于日本、朝鲜、菲律宾、印度尼西亚、中南半岛、澳大利亚等地。每年清明节前后,各地民间尤其是农民,食用方法不一,但基本都是全草食用,可新鲜食用也可晒干贮存,或水煮或拌入米面或玉米面后可食用,故有“清明菜、清明果”之称,是清明时节最早可食的野菜,营养丰富;同时具有食疗的作用,可治疗高血压、支气管炎、哮喘、风湿性腰痛等多种疾病,是民间十分喜爱的传统营养健康的野生蔬菜,有“仙草”之称。鼠曲草具体成分十分复杂,含氨基酸、黄酮类化合物、挥发油、豆甾醇、生物碱等,据相关研究报道,鼠曲草全草中所含的黄酮苷约为5%。黄酮类化合物经国内外研究发现具有抗肿瘤、抗氧化、抗突变、抗过敏、抗菌、抗病毒、抗炎、保护心脑血管系统和肝细胞的作用,还有杀虫等非常广泛的药理作用,而且对人体毒性较低[6-7]。
Aritomi和Kawasaki[8]报道从鼠曲草花的甲醇提取物中分离鉴定出一种新发现的查耳酮:2′,4,4′-三羟基-6-甲氧基查耳酮(2′,4,4′-trihydroxy-6′methoxychalcone)和2种较常见黄酮类物质:木犀草素(Luteolin)和木犀草素-4′-D-葡萄糖苷(Luteolin-4′-D-glucoside)。Morimoto等[9]研究发现从鼠曲草中分离提取得到黄酮类化合物有5-hydroxy-3,6,7,8-tetramethoxyflavone、5-hydroxy-3,6,7,8,4′-pentamethoxyflavone、4,4′,6′-trihydroxy-2′-methoxychalcone、5,6-dihydroxy-3,7-dimethoxy flavone等。Aquino等[10]报道从单花鼠曲草乙醇提取液中通过色谱分离和光谱方法,鉴定了一些肉桂酸衍生物和6种黄酮类化合物,它们分别是槲皮素-3-O-β-D-吡喃葡萄糖苷(Quercetin-3-O-β-D Glucopy Ranoside)、槲皮素-3-O-β-D-吡喃半乳糖苷(Quercetin-3-O-β-D-galactopy Ranoside-4′-O-β-D-glucopyranoside)、槲皮素(Quercetin)、芦丁(Rutin)、山柰酚(Kaempferol)、异鼠李黄素-3-O-β-D-吡喃半乳糖苷(Isorhamnetin-3-O-β+D-galactopy Ranoside),通过3种不同的体外试验评估提取物的抗氧化活性:1)稳定的1,1-二苯基-2-苦基肼基的漂白作用;2)由水溶性自由基引发剂2,2′-偶氮二(2-脒基丙烷)盐酸盐诱导的混合二棕榈酰磷脂酰胆碱/亚油酸单层囊泡的过氧化反应;3)紫外线辐射诱导的磷脂酰胆碱多层囊泡中的过氧化反应。在所有使用的体外试验中,ECR提取物显示出显着的抗氧化作用。此外,当局部使用时,证明含有该提取物的凝胶制剂在健康人志愿者中提供针对中波紫外线诱导的皮肤红斑的显着体内保护。Rockenbach等[11]研究发现槲皮素对肿瘤细胞的抗增殖作用可能至少部分地通过改变核苷酸的细胞外分解代谢而发生,可能是通过AMP积累,或者可能是阻断了腺苷受体,支持槲皮素治疗膀胱癌的潜在应用。
本课题组经前期实验发现鼠曲草中异泽兰黄素(Eupatilin)和5-羟基-6,7,3′,4′-四甲氧基黄酮为首次从鼠曲草属植物中分离得到,芹菜素(Apigenin)为首次从该植物中分离得到[12]。据国外研究报道鼠曲草成分中多种成分如Apigenin[13-14]和Eupatilin[15]等有较强的抗肿瘤作用。Suh等[13]研究发现Apigenin对SKOV3和SKOV3/TR细胞的抗增殖作用。RT-PCR和Western Blotting结果显示,Apigenin在mRNA和蛋白水平显著降低Axl和Tyro3受体酪氨酸激酶(RTKs)的表达,这是其细胞毒活性的原因。进一步发现Apigenin降低AKT磷酸化和B细胞淋巴瘤的水平-特别大(Bcl-xl或BCL2样1同种型1),一种凋亡抑制剂。与这些结果相反,Apigenin对IL-6产生,STAT3和磷酸化STAT3蛋白水平没有影响,表明Apigenin通过下调Axl和Tyro3表达,AKT磷酸化和Bcl-xl表达而发挥其抗增殖活性,但不是调节IL-6/STAT3轴。Tong等[14]报道:植物黄酮类芹菜素可预防和抑制中波紫外线诱导的皮肤癌发生,具有很强的抗增殖和抗血管生成作用,确定了芹菜素控制这些致癌事件的机制。研究显示芹菜素至少部分地通过内源性血管生成抑制剂血小板反应蛋白-1(TSP1)起作用。中波紫外线有效抑制表皮角质形成细胞的TSP1表达。它抑制皮肤血管生成和中波紫外线诱导的癌发生。我们显示芹菜素恢复经受中波紫外线的表皮角质形成细胞中的TSP1并使中波紫外线暴露的皮肤中的增殖和血管生成正常化。重要的是,用中波紫外线照射的皮肤重建TSP1抗血管生成功能,其中短的生物活性肽模拟物仅代表其抗血管生成结构域,再现了芹菜素的抗增殖和抗血管生成作用。Cox-2和HIF-1α是血管生成的重要介质。芹菜素和TSP1肽模拟物都通过中波紫外线减弱它们的诱导。最后,研究发现了其分子机制,其中芹菜素不影响TSP1 mRNA,但从头蛋白质合成增加。敲减研究涉及RNA结合蛋白HuR,其控制mRNA稳定性和翻译。芹菜素增加HuR细胞质定位和与TSP1 mRNA的物理结合,从而导致从头TSP1合成。反过来,HuR细胞质定位依赖于CHK2激酶。总之,研究发现了一种新机制,芹菜素通过该机制控制中波紫外线诱导的致癌作用。Park等[15]在人胃癌细胞系MKN-1中研究了Eupatilin的抗转移作用。Eupatilin以劑量和时间依赖性方式抑制MKN-1生长,并诱导细胞凋亡,伴随着Caspase-3活性的增加。ELISA证实了Eupatilin显著降低炎症介质(IL-1β,TNF-α,IL-6和IL-8)的释放。并且p-AKT和p-ERK(p44/42)减少。β-catenin和整合素的表达水平降低,p-GSKβ升高。在转录报告系统中,转内因子核因子κB的活性被Eupatilin降低,当用Eupatilin处理MKN-1细胞时p65的表达下调。此外,酶谱研究表明,这种侵袭能力的降低是由于Ⅳ型胶原溶解(明胶水解)活性的降低所致。用Eupatilin处理的MKN-1细胞中金属蛋白酶(MMP-2和MMP-9)的表达也降低。在体外侵袭测定中,Eupatilin抑制MKN-1穿透重建的基底膜屏障。这些结果表明,Eupatilin通过激活caspase-3和胃癌细胞的转移潜能,通过下调核因子κB活性,然后减少炎症介质介导的MMPs表达来抑制MKN-1胃癌细胞增殖。
本实验采用MNU膀胱灌注诱导大鼠膀胱癌,在对照组成瘤率为100%,是国内外最常采用的方法,该方法操作简单,实验周期短,成瘤率高。剂量为1 mg/mL,1 mL/次,让膀胱适度充盈,膀胱黏膜充分接触药液,操作也更为简便。本实验采用鼠曲草水煮提取液代饮用水喂食,与民间加工、食用方法相似,通过实验证实鼠曲草还有抗膀胱癌的功效。本实验研究发现,鼠曲草水提取液具有良好的抗肿瘤作用,且与其剂量相关;其作用机制可能主要与其抗氧化作用和自由基清除作用等保健作用,另外其促进肿瘤细胞调亡也是其抗肿瘤作用形成的关键机制,这与国内外相关报道一致。进一步从鼠曲草水提取液中找出其抗肿瘤的有效成分及其作用机制是摆在我们面前的一项难题,还需要做相当烦琐艰巨的实验研究工作。
参考文献
[1]Bhle A,Brandau S.Immune mechanisms in bacillus Calmette-Guerin immunotherapy for superficial bladder cancer[J].J Urol,2003,170(3):964-969.
[2]王靳,李丹,李斌.中药及天然产物单分子组分抗肿瘤免疫机理[J].自然杂志,2019,41(4):255-260.
[3]张宝月,郑一夫,庞晓丛,等.中药抗肿瘤作用的物质基础与网络机制研究[J].世界中医药,2018,13(8):1997-2009.
[4]Wang H,X Kong,Huang G,et al.The expression and significance of Surviving mRNA in urinary bladder carcinomas[J].J Cancer Res Clin Oncol,2004,130(8):487-490.
[5]陈晓芳,陈万青,周薇薇,等.2013年中国膀胱癌发病和死亡流行状况分析[J].中国肿瘤,2018,27(2):81-85.
[6]王世宽,潘明,任路遥.大有开发前景的野生蔬菜——鼠曲草[J].食品研究与开发,2005,26(4):95-98.
[7]张鞍灵,高锦明,王姝清.黄酮类化合物的分布及开发利用[J].西北林学院学报,2000,15(1):69-74.
[8]Aritomi M,Kawasaki T.Dehydro-para-asebotin,a new chalcone glucoside in the flowers of Gnaphalium affine D.Don[J].Chem Pharm Bull(Tokyo),1974,22(8):1800-1805.
[9]Morimoto M,Kumeda S,Komai K.Insect antifeedant flavonoids from Gnaphalium affine D.Don[J].J Agric Food Chem,2000,48(5):1888-1891.
[10]Aquino R,Morelli S,Tomaino A,et al.Antioxidant and photoprotective activity of a crude extract of Culcitium reflexum H.B.K.leaves and their major flavonoids[J].J Ethnopharmacol,2002,79(2):183-191.
[11]Rockenbach L,Bavaresco L,Fernandes Farias P,et al.Alterations in the extracellular catabolism of nucleotides are involved in the antiproliferative effect of quercetin in human bladder cancer T24 cells[J].Urol Oncol,2013,31(7):1204-1211.
[12]白丽明,高鸿悦,马玉坤,等.鼠曲草化学成分及其抗氧化活性研究[J].中草药,2016,47(4):549-553.
[13]Suh YA,Jo SY,Lee HY,et al.Inhibition of IL-6/STAT3 axis and targeting Axl and Tyro3 receptor tyrosine kinases by apigenin circumvent taxol resistance in ovarian cancer cells[J].Int J Oncol,2015,46(3):1405-1411.
[14]Tong X,Mirzoeva S,Veliceasa D,et al.Chemopreventive apigenin controls UVB-induced cutaneous proliferation and angiogenesis through HuR and thrombospondin-1[J].Oncotarget,2014,5(22):11413-11427.
[15]Park BB,Js Y,Es K,et al.Inhibitory effects of eupatilin on tumor invasion of human gastric cancer MKN-1 cells[J].Tumour Biol,2013,34(2):875-885.
(2019-05-25收稿 責任编辑:王明)

