全反式维甲酸暴露对斑马鱼的神经毒性效应
杨玉莹,李平灯,金英伟,丁 强,户业丽
1.武汉工程大学环境生态与生物工程学院,湖北 武汉430205;2.宜昌三峡制药有限公司,湖北 宜昌 443004
全反式维甲酸(all-trans-retinoic acid,atRA)是膳食维生素A的代谢衍生物,又名维甲酸、维A甲酸等[1]。atRA作为哺乳动物中的内源性维生素A活性代谢物,它是脊椎动物发育必不可少的形态形成因子,能够调节身体轴的形成和许多器官系统的发育[2]。由于atRA对干细胞具有很强的诱导分化以及免疫调节作用,被广泛应用于包括急性早幼粒白血病等各种血液恶性疾病的治疗中[3-4]。此外,atRA可以抑制角化过程,减少皮肤溢脂,具有抗炎杀菌作用,是临床上治疗痤疮、银屑病、鱼鳞病等皮肤角质化异常等疾病的首选药物[5-6]。同时,也有研究发现,过量atRA对人体具有较大的副作用,主要包括肝脏毒性[7]、发育毒性[8]、生殖毒性[9]等。Borracci P和Coluccia A研究指出成年大鼠孕期暴露atRA会造成后代长期的认知障碍[10-11],提示人类孕期应远离atRA。atRA作为过量使用的药物,无疑会造成水生环境的污染,通过长期接触可能进入体内并进而影响人类和野生动物的健康。
目前,关于atRA的神经发育毒性机制仅在人胚胎干细胞与大鼠中进行了初步研究[8,10-11],atRA在水生动物中的神经毒性研究鲜见报道。相较于哺乳类动物,斑马鱼繁殖力高、胚胎发育快速且特征明确,与人类大脑组织区域具有高度相似性,具有丰富的社会学行为,是毒理学中研究神经毒性的良好体外动物模型[12-13]。因此,本研究以斑马鱼为水生动物模型,探讨atRA暴露对斑马鱼胚胎及幼鱼的神经毒性和相关机制。
1 实验部分
1.1 试剂和仪器
atRA,二甲基亚砜(dimethyl sulfoxide,DMSO),甲基纤维素(methyl cellulose),多聚甲醛(美国Sigma公司);乙醇,氯仿,异丙醇(国药集团化学试剂有限公司);逆转录试剂盒,SYBR-GREEN荧光染料,焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水(美国Thermo Scientific公司)。
斑马鱼养殖系统(TMG3000,武汉汉科实验设备公司),斑马鱼行为分析仪(DanioVison,瑞士Noldus公司),体视显微镜(Stereo,德国ZEISS公司),光学显微镜(S22-ST,日本Olympus公司),纯水仪(Milli-Q Advantage A10,法国Merck Millipore公司),恒温培养箱(Blue pard,上海一恒科技公司),莱卡荧光倒置显微镜(Leica Application Suite,美国Leica公司),荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪(CFXconnec,美国Bio-Rad公司)。
1.2 实验动物
本实验所用斑马鱼为AB系野生鱼及转基因斑马鱼Tg[mbp(myelin basic protein):EGFP],均购买于国家斑马鱼资源中心中国科学院水生生物研究所。饲养条件如下:光照周期14 h(光)/10 h(暗)(电脑自动控制),水温(28±0.5)℃,水体溶氧6 mg/L,水中含盐0.25%。实验前一晚,将成年的斑马鱼按照雌鱼和雄鱼2∶2(个体数目比)的比例放置于产卵缸内,次日清晨完成交配和产卵,挑选发育正常的斑马鱼胚胎用于药物暴露实验。
1.3 斑马鱼胚胎暴露实验
将atRA溶解于DMSO中,配置成1 mol/L的母液,4℃避光保存,待用。实验共设4个atRA浓度梯度:对照(0 nmol/L,DMSO质量分数0.01%),5,10和20 nmol/L,暴露液现配现用。取已受精1 h(hour post fertilization,1 hpf)的斑马鱼胚胎置于恒温培养箱进行暴露,6孔板每孔含30枚胚胎,每个浓度设置3个平行孔,每24 h更换暴露液。
1.4 胚胎自发运动测定
从不同浓度暴露组中挑选15枚发育至24 hpf的斑马鱼胚胎,于显微镜下视频记录斑马鱼胚胎的自发胎动情况,每次1 min,重复观察3次,使用DanioScope软件统计单位时间内胚胎的活跃度。采用单位时间内胚胎运动时间占总测量时间的百分比作为活跃度的分析指标,以自发运动活力百分比表示。
1.5 幼鱼运动行为测定分析
经atRA暴露后,每组随机取出12条发育至120 hpf的斑马鱼幼鱼进行运动行为分析测定。将选取的幼鱼置于24孔板内,每孔1尾幼鱼。完成准备工作后,将24孔板置于斑马鱼行为分析仪,给予光照刺激。刺激条件:5 min光照/5 min黑暗循环,测试3个循环,共30 min。各组斑马鱼平均运动速率以及总移动距离由斑马鱼行为分析仪的Ethovision软件统计并计算。
1.6 转基因斑马鱼形态学分析
实验用转基因斑马鱼Tg(mbp:EGFP),转基因斑马鱼的髓鞘被标记绿色荧光蛋白,可用于研究斑马鱼神经组织特异性。取不同浓度组发育至72 hpf的转基因鱼Tg(mbp:EGFP),通过莱卡荧光显微镜,采用单荧光通道(绿色荧光激发)观察并拍摄转基因斑马鱼的形态变化,评估atRA不同暴露浓度对斑马鱼神经组织的毒性作用(评价指标:大脑及脊椎荧光强度)。
1.7 总RNA提取
斑马鱼胚胎暴露至72 hpf时,不同浓度组各取30条幼鱼于1.5 mL EP管内,吸干水分,使用高通量组织研磨器破碎研磨斑马鱼。随后,按照总核糖核酸(ribonucleic acid,RNA)提取试剂盒操作说明提取总RNA。利用NanoDrop 2000测定提取RNA的纯度(A280/A260值1.8~2.0)和浓度,并使用逆转录试剂盒[revertaid first strand cdna(complementary deoxyribonucleic acid)synthesis kit]逆转录RNA,获得cDNA,−20℃,保存备用。
1.8 qRT-PCR检测基因的表达
使 用SYBRTM Select Master Mix(Thermo Fisher Scientific,USA)进行实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)。荧光定量PCR总反应体系10.0μL:上下游引物各0.8μL,cDNA模板1.0μL,SYBR GREEN染料酶5.0μL,无菌水2.4μL。PCR反应程序如下:95℃预变性3 min;95℃变性10 s;55℃退火10 s;72℃延伸20 s(循环40次)。以扩增循环数(cycle threshold,CT)值表示达到阈值的循环数,β-actin为内参,利用2-ΔΔT来计算mRNA转录水平的相对变化。
qRT-PCR实验使用的引物序列如表1所示。

表1 qPCR的引物序列Tab.1 Primer sequence for qPCR
1.9 统计与分析
实验数据使用SPSS 16.0(SPSS Company,Chicago,IL,USA)软件进行统计,并在Graphpad Prism 7(Graphpad Software,La Jolla,CA,USA)软件中进行数据分析。显著性差异由单因素方差分析法(One way-ANOVA)计算,其中*p<0.05代表有显著性差异,实验结果用平均值±标准误差表示。
2 结果与讨论
2.1 atRA暴露对胚胎自发运动的影响
斑马鱼自主胎动是胚胎尾部的自主摆动,不受大脑神经元的控制,是能够检测到的最早神经行为[14],常常被作为评估斑马鱼早期神经发育毒性的指标之一。对照组及不同atRA浓度暴露24 hpf斑马鱼胚胎的自发运动活力测定结果如图1所示。与对照组相比,atRA暴露可显著抑制斑马鱼早期自发的神经活动,且具有浓度依赖性,当暴露浓度在10和20 nmol/L时,自发运动活力百分比相对于对照组分别下降25.6%和50.8%(p<0.05)。这提示atRA对斑马鱼幼鱼具有神经毒性,可通过影响斑马鱼脊柱区域的一些神经细胞,从而改变斑马鱼胚胎的自主胎动行为。
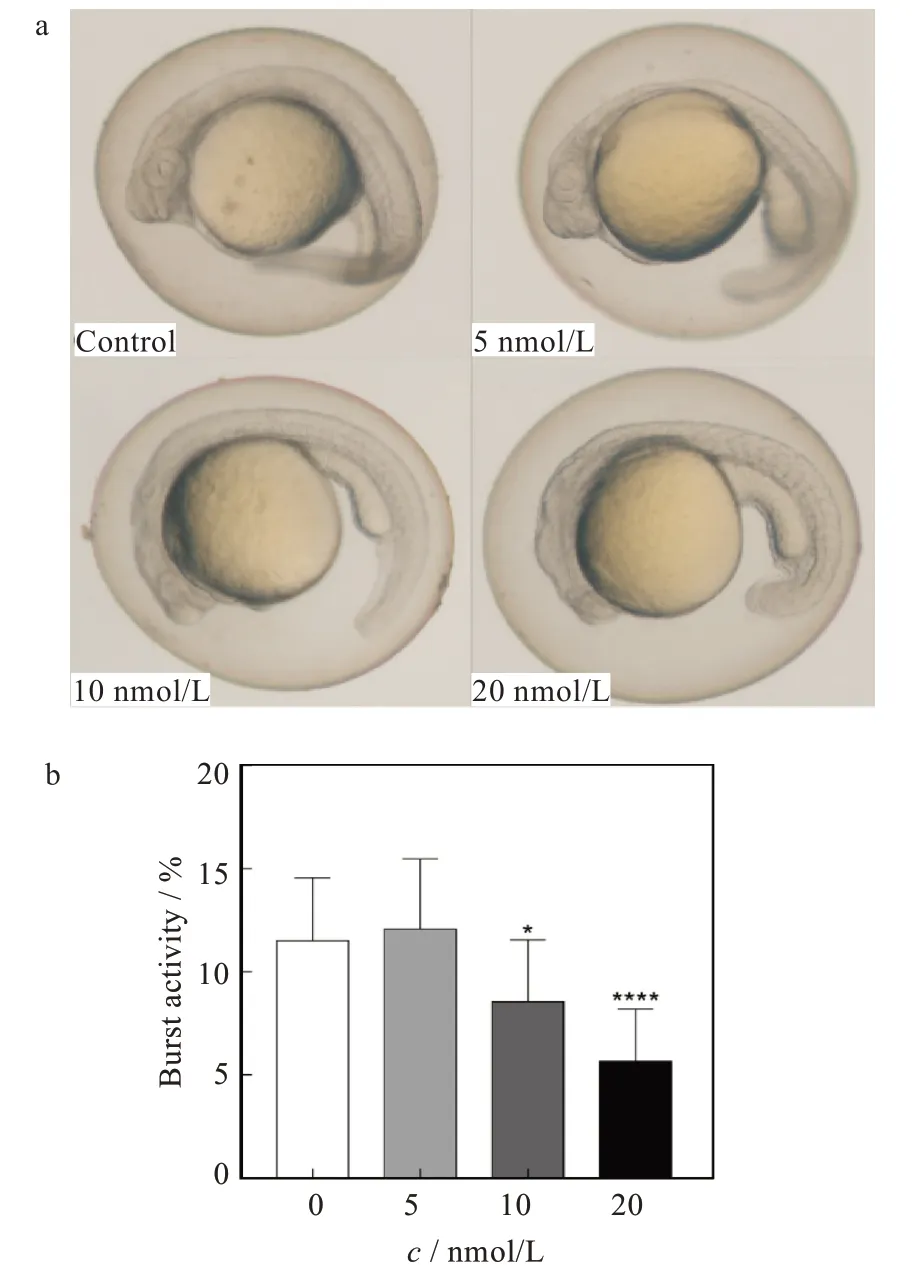
图1 不同浓度atRA暴露对胚胎自发运动的影响:(a)胚胎自发运动,(b)胚胎自发运动活力百分比Fig.1 Effects of exposure to ATRA with different concentrations on embryo spontaneous movement:(a)embryo spontaneous movement,(b)percentage of embryo spontaneous movement
2.2 atRA暴露对幼鱼运动行为的影响
在30 min检测时间内,120 hpf的幼鱼在不同浓度暴露组以及不同光暗周期的运动活力如图2所示。结果显示幼鱼对光暗转换的刺激较为敏感,表现出运动活力交替上升和下降。在明亮期,20 nmol/L组斑马鱼幼鱼的游动速率为0.5 mm/s,对照组为1.3 mm/s;在黑暗期,20 nmol/L组斑马鱼幼鱼的游动速率为0.6 mm/s,对照组为1.5 mm/s。且幼鱼游动速度在暗环境下降趋势表现得更加明显,表明幼鱼对暗刺激反应更为强烈;而在同一光暗周期内,其运动活力随着atRA暴露浓度的增加出现明显下降,且降低程度具有一定的浓度依赖性。低浓度暴露剂量对斑马鱼的运动速率影响较低,无论是光环境还是暗环境,其运动距离和运动速率变化均不明显;而随着atRA暴露浓度的升高,幼鱼平均运动距离和运动速度均出现下降趋势,这可能是因为atRA的暴露造成了斑马鱼幼鱼神经组织受损,引发神经肌肉协调性的中断,从而造成幼鱼行为异常且反应迟钝。

图2 不同浓度atRA暴露对幼鱼运动行为的影响:(a)幼鱼的运动轨迹,(b)幼鱼游动距离的变化,(c)幼鱼游动平均速度的变化Fig.2 Effects of exposure to atRA at different concentrations on motor behavior of larval fish:(a)movement trajectory of larval fish,(b)variation of swimming distance of larval fish,and(c)variation of average swimming speed of larval fish
2.3 atRA暴露诱导斑马胚胎神经毒性
MBP是中枢神经系统髓鞘中的主要蛋白,具有神经组织特异性[15],荧光标记转基因鱼Tg(mbp:EGFP)神经元可以直接观测斑马鱼的神经系统发育情况。在atRA(20 nmol/L)暴露至72 hpf,转基因斑马鱼Tg(mbp:EGFP)胚胎神经系统发育状况如图3所示。结果显示,斑马鱼神经发育出现明显异常,主要表现为脑部神经中枢的形态缺陷和结构复杂程度的显著减少。整体荧光强度定量结果显示,20 nmol/L atRA暴露组胚胎的总荧光强度相对对照组下降38.7%,表明mbp蛋白表达减少,这些结果进一步证实了atRA可以导致斑马鱼神经发育畸形。

图3 atRA暴露对斑马鱼胚胎具有神经发育毒性:(a)斑马鱼胚胎神经发育畸形,(b)mbp荧光蛋白表达强度Fig.3 Neurodevelopmental toxicity of exposure to atRA over zebrafish embryos:(a)neurodevelopmental malformations in zebrafish embryos,(b)expression intensity of mbp fluorescent protein
2.4 atRA对斑马鱼胚胎神经发育相关基因表达的影响
有研究[16-17]报道,有毒化合物通过抑制斑马鱼神经发育关键基因mbp和突触蛋白基因syn2a的表达来诱导神经毒性。本研究利用荧光PCR仪测定了mbp与syn2a基因的相对表达量,结果如图4所示,syn2a的表达量在高浓度(20 nmol/L)暴露组中出现明显下调,仅为对照组的41.2%;mbp的表达也明显受到了atRA的抑制,为对照组的54.6%,这与atRA暴露mbp标记荧光蛋白转基因斑马鱼的总体荧光强度变化是一致的。揭示atRA可能通过调节这些神经基因的表达,从而影响斑马鱼的运动,诱导了神经毒性。

图4 atRA暴露对斑马鱼神经发育相关基因表达的影响Fig.4 Effects of exposure to atRA on expression of neurodevelopmental genes in zebrafish
3 结 论
atRA暴露斑马鱼胚胎后,能显著抑制斑马鱼胚胎自主运动、幼鱼游动的总运动距离和平均运动速度,并且在分子水平上抑制神经相关基因mbp与syn2a的表达,从而干扰斑马鱼胚胎早期的神经发育及行为活力,具有典型的神经毒性,更深入的内在机制有待进一步研究。本研究可为atRA在水生动物体内的神经毒性作用机制提供有价值的理论依据,并为atRA临床使用的剂量及安全性提供一定的参考作用。

