抑郁症患者低频振幅与艾司西酞普兰疗效的关联性研究*
肖洪奇 袁敏兰 邱昌建
抑郁症影响了全世界超过3亿人[1],已成为中国患病率第二的精神疾病[2],是致残的主要原因之一,也是自杀的主要风险之一。但目前抑郁症治疗的发展仍然滞后,临床上抑郁症治疗的首选治疗方式为抗抑郁药物治疗,但仅有30%~40%的患者最终能达到缓解[3]。抗抑郁药物治疗较低的有效率可能与抑郁症较高的异质性有关,根据目前临床标准定义,抑郁症包含各种神经生物学表型的异质性混合。如果能识别出抗抑郁药物治疗有效的神经生物学表型,将有助于提高治疗有效率,减轻疾病负担,也利于进一步理解抑郁症的神经病理学机制。静息态功能磁共振是目前探索抑郁症疗效影像学标志物的常用方法,具有操作简单,无需任务设计,空间分辨率高等优点,其中低频振幅(Amplitude of Low-frequency Fluctuations, ALFF)是衡量局部大脑活动的有效方法。本研究通过ALFF分析方法,探讨大脑局部活动与抗抑郁药物疗效的关系,以期寻找抗抑郁药物疗效的影像学标志物。
1 对象与方法
1.1 对象 收集2017年9月~2020年9月至华西医院心理卫生中心门诊及住院部就诊且满足下列纳排标准的不伴有精神病性症状的抑郁症患者。入组标准:(1)年龄18~65岁(包括 18 岁和 65 岁),性别不限;(2)右利手;(3)符合美国精神障碍诊断与统计手册第Ⅳ版(DSM-Ⅳ)抑郁症诊断标准[通过简明国际神经精神访谈(MINI-International Neuropsychiatric Interview,MINI)中文版[4]进行筛查],且不伴有精神病性症状;(4)本次发作未经过抗抑郁药物系统治疗或近14 d累积使用抗抑郁药治疗不超过7 d;(5)抑郁症状快速自评量表(16-Item Quick Inventory of Depressive Symptomatology-Self-Report ,QIDS-SR16)≥11分[5];(6)小学以上文化程度,能理解量表内容;(7)患者与医生达成一致同意进行药物治疗。 排除标准:(1)既往明确的躁狂或轻躁狂发作;(2)既往诊断双相情感障碍、精神分裂症、分裂情感性精神障碍及其他疾病伴发的精神障碍者;(3)既往曾有酒药依赖及急性中毒史的患者; (4)妊娠期或哺乳期女性患者; (5)有磁共振扫描禁忌证,如心脏起搏器、胰岛素泵、幽闭恐惧症等。本研究通过四川大学华西医院医学伦理会批准,所有受试均签署了知情同意书。
1.2 方法
1.2.1 临床评定 本研究使用QIDS-SR16作为抑郁严重程度的衡量标准[6, 7],所有受试在基线及治疗后第8周末完成QIDS-SR16的评估,根据治疗后第8周末时QIDS-SR16相较于基线的减分率是否大于50%,将患者分为有效组和无效组。
1.2.2 药物治疗 所有患者在评估及磁共振成像(MRI)扫描后接受8周的艾司西酞普兰治疗,艾司西酞普兰为临床常用的一线抗抑郁药物,为选择性五羟色胺再摄取抑制剂,艾司西酞普兰治疗起始剂量为10 mg/d,最大剂量为20 mg/d。治疗过程中,有经验的临床医生根据指南调整用药剂量,研究期间,所有受试不得使用情绪稳定剂、抗精神病药或其他抗抑郁药物,不能接受物理治疗及系统的心理治疗。
1.2.3 磁共振数据采集 在四川大学华西医院西藏成办分院,使用8通道线圈,Philips Achieva3.0 T磁共振成像系统进行磁共振扫描。扫描时受试佩戴耳塞以减少噪音干扰,并嘱咐被试平卧、闭眼,头部及身体保持不动,避免系统的思考,且不能睡着。采用平面回波成像(Echo Planar Imaging,EPI)序列采集功能磁共振数据,具体扫描参数如下:重复时间=2 000 ms;视野大小=220 mm×220 mm×150 mm;回波时间=30 ms;体素=3.75 mm×3.75 mm;层数=38;层间距=0.4 mm;层厚=4 mm;重建矩阵=64×64;扫描时间为486 s,共获得240个图像。T1图像使用3D扰相梯度回波序列获得,具体扫描参数如下:重复时间=8.2 ms;回波时间=3.8 ms;视野大小=256 mm×256 mm;体素=1 mm×1 mm×1 mm;重建矩阵=256×256;层数=188;层厚=1 mm,翻转角度= 7°。
1.2.4 MRI数据预处理 功能影像数据预处理使用Data Processing Assistant for Resting-State fMRI (DPARSF_V4.3; http://rfmri.org/DPARSF)[8]软件,在Matlab2013b 平台上进行。具体步骤如下:(1)去除前10个时间点,以保证信号稳定;(2)层间时间校正:以减少不同层面因为采集时间不一致所带来的干扰;(3)头动校正:剔除头动在x、y、z轴平移大于1.5 mm或旋转移动大于1.5°的被试图像。此外,回归掉平均框架位移大于0.20的时间点[9, 10];(4)回归脑脊液和脑白质信号;(5)空间标准化:将功能图像标准化到蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)标准空间进行空间标准化;(6)高斯平滑,平滑核半高宽=6 mm。
1.2.5 ALFF值计算 运用DPARSF软件包计算每个受试的ALFF值,首先利用快速傅里叶变化将每个体素的时间序列转化为功率谱,并进行开方,然后计算0.01~0.08 Hz频域的功率谱[11],得到ALFF值,通过将每个体素的ALFF值除以整个大脑的平均ALFF值,得到标准化的ALFF值。

2 结果
2.1 两组一般资料比较 共30例患者完成了本研究,其中有效组14例,无效组16例。两组年龄、性别、受教育程度及基线QIDS-SR16得分比较差异均无统计学意义(P>0.05);有效组治疗后第8周末QIDS-SR16总分低于无效组(P<0.05),减分率高于无效组(P<0.05)。见表1。
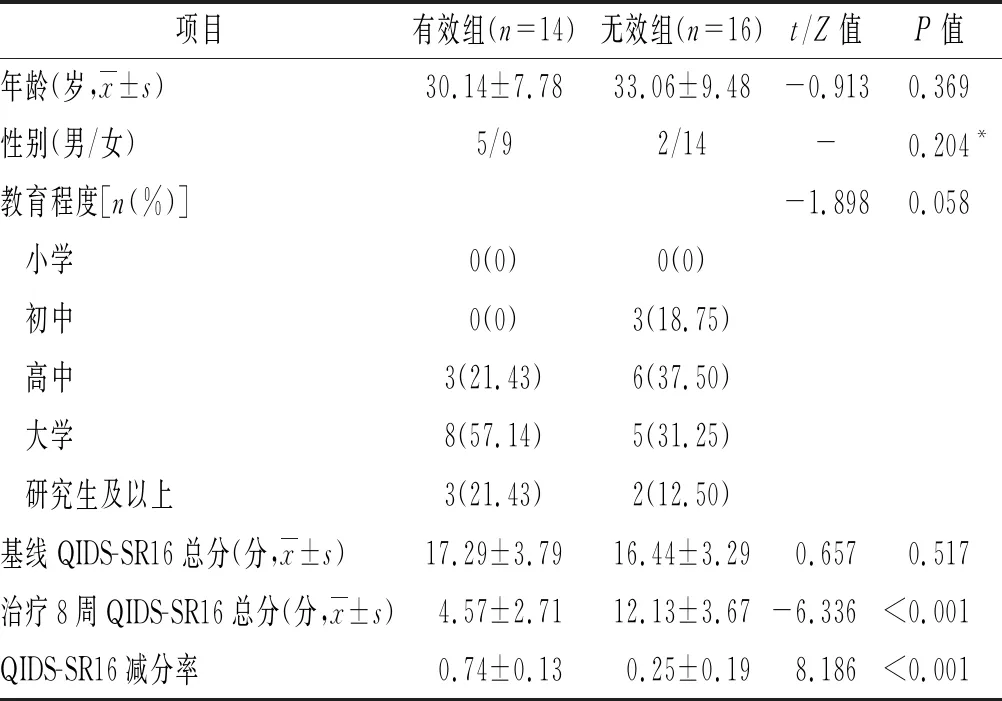
表1 两组人口统计学和临床资料比较
2.2 两组基线低频振幅比较 有效组右侧纹状体以及右颞上回/右海马ALFF值高于无效组(体素水平P<0.005,团块水平FEW校正,P<0.05)。见表2、图1。

表2 两组ALFF值差异脑区
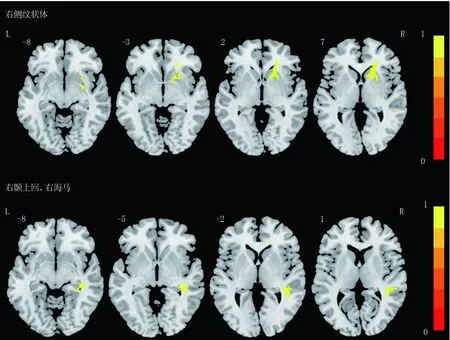
图1 两组ALFF差异脑区
2.3 偏相关分析结果 右侧纹状体ALFF值(r=0.346,P=0.083)和右颞上回/右海马ALFF值(r=0.370 ,P=0.063)与基线QIDS-SR16得分无相关性,右侧纹状体的ALFF值与QIDS-SR16减分率呈正相关(r=0.661,P<0.001),右颞上回/右海马的ALFF值与QIDS-SR16减分率呈正相关(r=0.692,P<0.001)。
2.4 ROC分析结果 右侧纹状体ALFF值区分有效组与无效组的AUC值为0.748,最佳截断值为-0.442,敏感度57.1%,特异度87.5%。右颞上回/右海马ALFF值区分有效组与无效组的AUC值为0.786,最佳截断值为-0.560,敏感度64.3%,特异度81.2%。见图2。
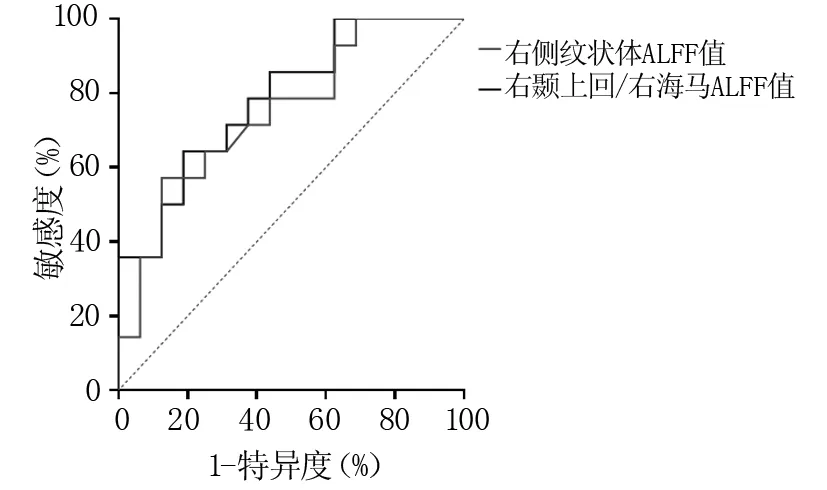
图2 右纹状体及右颞上回、右海马区分疗效的ROC曲线
3 讨论
本研究通过比较艾司西酞普兰治疗8周后有效组与无效组基线低频振幅发现,相较于治疗有效者,无效者右侧纹状体和右颞上回/右海马ALFF值降低,且右侧纹状体和右颞上回/右海马的ALFF值均与疗效呈正相关,对疗效判别的特异度较好,右侧纹状体以及右颞上回/右海马的功能活动可能可以区分8周艾司西酞普兰治疗反应。
纹状体是奖赏网络的核心区域,既往研究发现抑郁症患者存在奖赏网络功能障碍,且与抑郁症的核心症状即快感缺乏有关[12],而快感缺乏症状被发现是治疗反应不良的预测因素[13],既往的影像学研究也发现奖赏网络异常与抗抑郁治疗反应有关,Hou Z等[14]研究发现奖赏网络内的功能连接可以区分抗抑郁药物治疗的早期疗效,一项正电子放射断层扫描研究发现腹侧纹状体多巴胺受体可用性与抗抑郁疗效有关,非缓解者腹侧纹状体存在更大的多巴胺受体可用性[15],而Downar J等[16]发现重复经颅磁刺激治疗无效者奖赏网络内功能连接低于有效者。本研究也发现艾司西酞普兰治疗无效者奖赏网络内右侧纹状体活动更低,而针对难治性抑郁症的研究发现,对难治性抑郁症患者的腹侧纹状体进行深部脑刺激,可以有效改善抑郁症状[17]。本研究结合既往研究结果,提示奖赏网络功能活动较低的患者可能更难从常规治疗中获益。
右侧颞上回在情绪加工和社会认知中起着重要作用[18],被认为与抑郁症的情绪管理有关[19],既往研究表明抑郁症患者右颞上回功能活动存在异常[20, 21],且难治性抑郁症患者颞上回的体素-镜像同伦连接(VMHC)小于药物治疗有效者[22],此外相较于治疗有效者,难治性抑郁症患者右颞上回与右颞中回功能连接降低[23]。本研究与既往研究一致,发现艾司西酞普兰治疗无效的患者右颞上回ALFF更低,较低的右颞上回功能活动可能是难治性抑郁症的病理学特征。而关于电休克治疗的研究发现,右侧颞上回的局部功能连接密度与电休克治疗反应密切相关,电休克治疗可以降低抑郁症患者右侧颞上回和右侧顶内沟之间的功能连接[24]。猜测右颞上回的功能活动可能具有指导抑郁症治疗选择的潜力,未来还需要进一步研究证明。
海马参与了情绪及记忆的形成过程,海马神经可塑性的损伤被认为是抑郁症病理生理学的核心因素[25],基础研究发现抗抑郁药物治疗可以逆转海马受损的神经可塑性[26~28],表明海马可能是抗抑郁药的作用靶点。既往结构影像学研究较一致地发现抑郁症海马体积减小[29],Meta分析发现抑郁症患者右海马体积减小的效应大于左海马[30],也有研究认为右海马体积是复发性抑郁障碍的内表型[31]。此外,基线较大的海马体积可预测抗抑郁药物治疗的缓解[32],而持续服用抗抑郁药物3年的抑郁症患者海马体积增加[33],功能影像研究也发现有抑郁症海马功能活动异常[34~36],且此种异常与抑郁症患者的情绪调节记忆障碍有关[37]。此外海马网络间的功能连接被证明是舍曲林和安慰剂疗效预测的关键枢纽,而艾司西酞普兰治疗可以增加在基线时降低的海马功能连接强度[38]。关于难治性抑郁的研究也发现难治性抑郁症患者海马的VMHC小于非难治性抑郁症患者[22],与既往研究一致,本研究发现海马在8周艾司西酞普兰治疗反应判别中的关键作用,右海马的功能活动强度可能代表了患者恢复的难易程度。
本研究发现与疗效相关的大脑区域均位于右侧,左右大脑在解剖学和功能上并不对称,抑郁症也被证明存在大脑偏侧化,既往研究发现,抑郁症患者存在较大的右侧脑电图异常[39,40]。此外,在面对情绪刺激时,抑郁症患者右顶叶和右颞叶的活动减退,抑郁症患者右半球静息态代谢的差异也被证明与诊断亚型和治疗反应有关[41]。本研究与既往研究一致,发现艾司西酞普兰疗效主要与右侧大脑内的纹状体、颞上回以及海马的功能活动有关。
本研究结果表明基线右侧纹状体和右颞上回/右海马的功能活动可能是艾司西酞普兰疗效的影像学标志物,未来还需要扩大样本量对本研究结果进行验证。此外,本研究只探索了基线脑局部活动与艾司西酞普兰8周治疗的关系,治疗前后脑局部活动是否改变还需要进一步的研究,以明确艾司西酞普兰对脑局部活动的作用。

