妊娠中期胎盘生长因子与妊娠期高血压发生及预后的相关性研究
杜 晶,薛 伟,张晋芳
妊娠期高血压(HDPS)是一类严重的妊娠并发症,一般在妊娠24周后出现,除了血压持续升高及尿蛋白等异常表现外,随着病情持续进展,可出现惊厥、抽搐,甚至引起不良妊娠结局[1-2]。有报道称新生儿低体重、早产和生长发育受限与HDPS的严重程度密切相关,尤其子痫前期孕妇的病情程度十分严重,血压升高更为明显,母婴预后均欠佳[3]。目前对于HDPS尚缺少特异性治疗方法,建议早期进行针对性防治,有助于避免病情进一步恶化,改善妊娠结局。由于HDPS早期并无特异性表现,孕妇伴有或不伴有血压升高,难以在早期辨别疾病的发生及病情进展程度。在HDPS发生及发展的过程中,会伴随一系列病理生化因子的改变,有学者在妊娠中期女性胎盘组织中发现PLGF的存在,其表达与妊娠期并发症和孕周呈一定关联,推测其可作为HDPS一类重要标志物[4-5]。为进一步提高HDPS的风险防控措施,本次研究回顾性查阅我院24~28周妊娠女性的体检档案,分析血清PLGF与妊娠期高血压发生及预后的相关性,现报告如下。
1 资料与方法
1.1 一般资料:经过医学伦理委员部门的审查,回顾性纳入2018年1月-2020年6月于我院建立体检档案的24~28周妊娠女性的信息资料,将74例妊娠期高血压疾病患者(观察组)作为本次观察对象,年龄23~34岁,平均(28.20±3.02)岁,孕周24~28周,平均(26.12±1.37)周,体重在64~71 kg,平均(67.37±2.51)kg,初产妇49例,经产妇25例。纳入标准:参照《妊娠期高血压疾病血压管理专家共识(2019)》[6]中“妊娠期高血压”的诊断要点,年龄≤35岁。排除其他器质性疾病、原发性或继发高血压、醛固酮增多症及生命状态不稳定者;有其他妊娠期并发症者;有精神病史,或烟酒等不良嗜好者;建档期间失随,未于我院生育或基础资料不全者。同时纳入同一时期来诊的24~28周正常妊娠女性112例(健康组),既往体健,无任何肝肾异常,年龄22~34岁,平均(27.56±3.21)岁,孕周24~28周,平均(25.92±1.42)周,体重在62~70 kg,平均(67.21±3.02)kg,初产妇71例,经产妇41例,2组间一般资料比较,差异无统计学意义(P>0.05)。
1.2 研究方法
1.2.1 检测方法
1.2.1.1 回顾性查阅患者妊娠15~20+6 周唐氏筛查的血液样本,经实验室常规处理,取上层血清,及时上机检测。应用双抗夹心-酶联免疫检测方法测定血清胎盘生长因子(PLGF)水平,参照试剂说明书的操作步骤:①准备标准品、试剂及检测样本;②加样(标准品及样本)100 μL,37 ℃温育60 min;③吸弃,加检测液A 100 μL,37 ℃温育60min;④洗板3次;⑤加检测液B 100μL,37 ℃孵育30 min;⑥洗板5次;⑦加TMB底物90 μL,37 ℃温育10~20 min;⑧加终止液50 μL,在酶标仪(Bio-Tek公司,ELX800型)450 nm上读取数值。
1.2.1.2 所有孕妇静息状态下15 min,采用臂式血压测量仪测量血压情况,包括收缩压和舒张压,连测3次,取平均值。同时取孕妇清晨7:00~次日7:00的尿液标本,保证清洁无污染,应用生化分析仪(贝克曼公司,AU5800型)测定24 h尿蛋白含量。
1.2.2 分组方法:记录患者血压、尿蛋白及水肿情况,根据妊娠期高血压疾病的严重程度,分为轻度(n=27例)、中度(n=34例)、重度(n=13例)3个等级。
1.2.3 妊娠预后情况:对患者进行产后随访,由专人负责记录不良妊娠结局,包括胎儿生长受限、胎儿窘迫、新生儿窒息、新生儿死亡等。
1.3 统计学方法:采用SPSS 17.0统计软件,计量资料用方差分析,两两比较LSD-q检验;线性相关采用Pearson分析,秩相关采用Spearman分析,以P<0.05为差异有统计学意义。
2 结果
2.1 2组孕妇各项观察指标:观察组收缩压、舒张压及24h尿蛋白均高于健康组,血清PLGF高于健康组,差异有统计学意义(P<0.05),见表1。
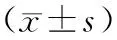
表1 2组孕妇各项观察指标比较
2.2 不同程度HDPS各项观察指标:3组HDPS血压、24 h尿蛋白及妊娠中期血清PLGF水平比较,差异有统计学意义(P<0.05)。在收缩压、舒张压及24h尿蛋白上,轻度、中度、重度依次升高;在血清PLGF上,轻度、中度、重度依次降低,差异有统计学意义(P<0.05),见表2。
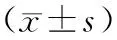
表2 不同程度HDPS各项观察指标比较
2.3 不同预后各项观察指标:不良预后HDPS血压、24 h尿蛋白及血清PLGF水平比较,差异有统计学意义(P<0.05),见表3。
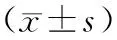
表3 不同预后各项观察指标比较
2.4 HDPS血清PLGF水平与血压、24 h尿蛋白的相关性:HDPS血清PLGF水平与收缩压、舒张压、24 h尿蛋白呈负相关(r=-0.426、-0.398、-0.357,P<0.05)。血清PLGF水平与HDPS的严重程度呈负相关性(r=-0.502,P<0.05),血清PLGF水平与胎儿生长受限、胎儿窘迫、新生儿窒息、新生儿死亡呈负相关性(r=-0.411、-0.439、-0.381、-0.427,P<0.05)。
3 讨论
妊娠是女性一个特殊的生理阶段,为适应孕婴需求,此阶段各类激素及神经内分泌机制均会发生一定变化,对周围环境的敏感性增加,极易诱发各种妊娠并发症[7]。随着现代医学技术的不断发展,多种产前筛查手段被广泛应用,妊娠并发症可以早期诊断及治疗。我国妊娠女性中HDPS的发病率高达5%~10%,表现为母婴的多脏器和系统损害,有长期观察发现患HDPS的女性产后高血压和心脑血管疾病、肾功能减退发生的概率显著上升[8]。医学界普遍认为超重、孕前高血压、多胎妊娠、不良饮食是妊娠期高血压的危险因素,如果女性血压控制欠佳,极易罹患高血压肾病、尿蛋白增加等,而且新生儿有宫内窘迫或早产、流产的高风险[9]。鉴于孕妇特殊的生理特点,临床用药受到严格限制,HDPS尚缺少有效的治疗方法,一部分重度HDPS孕妇最终采取终止妊娠。早期进行筛查及鉴别诊断、评估预后,仍是HDPS高危人群的重要手段,尤其子痫和子痫前期的高危孕妇,更需要严格控制血压,避免恶性情况出现。
目前常用的HDPS产前筛查指标很多,包括孕妇的身高、体重、子宫动脉彩色多普勒超声、尿蛋白及平均动脉压等,各项指标的预测价值差异较大。血压是评价HDPS的“金标准”,然而由于妊娠20周前HDPS孕妇的个体差异,部分孕妇早期血压升高不大,甚至不会有血压波动,在一定程度上影响了医学工作者的判断;子宫动脉彩色多普勒超声、尿蛋白均为一类辅助性指标,单用的预测价值较低,往往需要联合应用。总结来说临床上仍然缺少一个特异性的预测指标[10]。目前有学者发现HDPS的发病机制复杂,与多种病变因素有关,如遗传倾向、免疫学机制、滋养细胞或胎盘缺血、氧化应激等,在上述各个病理变化环节,机体不可避免地出现各种反应,分泌某些生化因子,并伴随妊娠的整个过程[11]。有学者提出PLGF可作为HDPS一种高度特异性的预测指标,较传统的指标预测价值高,且检测简便、实用性高。PLGF由滋养细胞合成,有着多种生理作用,可以促进滋养细胞的增殖与分化、促进血管生长和抗内皮细胞凋亡等,随着对PLGF的研究深入,妊娠中期PLGF与妊娠高血压发生及预后的关系成为研究重点[12]。
本次发现观察组收缩压、舒张压及24h尿蛋白均高于健康组,血清PLGF高于健康组,在血清PLGF上,轻度、中度、重度依次降低,均说明血清PLGF参与了HDPS的发生及病情进展过程。HDPS会增加不良妊娠结局的风险,与健康妊娠女性比,HDPS围产期及新生儿不良风险上升数十倍[13]。本次分析血清PLGF与HDPS不良妊娠结局的关系,发现胎儿生长受限和胎儿窘迫、新生儿窒息、新生儿死亡血清PLGF依次降低,随着不良妊娠的严重程度加重,血清PLGF也会发生一定降低。进一步分析发现,血清PLGF与HDPS收缩压、舒张压、24 h尿蛋白及严重程度、妊娠预后呈负相关,也证实了上述结论。
总结来说,妊娠中期血清PLGF与HDPS发生及预后密切相关,通过早期测定PLGF,可以及时发现及评估高危HDPS人群,避免不良妊娠结局。

