乳腺导管内癌的病理特征与钼靶X线摄影及超声造影检查的相关性
宋 倩, 刘景萍, 冯华梅, 聂维齐, 王 泱
(河北省唐山市人民医院 超声科, 河北 唐山, 063000)
乳腺导管内癌(DCIS ) 是一种变质性肿瘤,其定义是一种恶性增生,局限于乳腺的导管上皮细胞处,未入侵于乳腺的基底膜层和间质阶层的乳腺癌[1]。DCIS患者的临床治疗重点在于提高早期诊断准确率[2]。乳腺钼靶 X线摄影和超声造影是临床常用诊断恶性肿瘤的方式[3]。乳腺钼靶 X线摄影是一种无创性的检查方式,患者痛苦较小,简单方便,有较高的分辨率[4]。超声造影是一种利用造影剂增强后散射回信号,从而提高超声诊断的特异性、分辨力和敏感性的技术[5]。目前,有关DCIS的病理特征与乳腺钼靶X线摄影及超声造影的相关性的研究尚少。本研究探究DCIS的病理特征与乳腺钼靶X线摄影及超声造影检查的相关性,现报告如下。
1 资料和方法
1.1 一般资料
选取2018年1月—2020年1月本院诊治的83例DCIS患者为研究对象。纳入标准: ① 所有患者均在本院经手术切除或穿刺检验确诊为DCIS; ② 临床表现为可触及性乳腺肿块者; ③ 患者对此次实验知情且同意; ③ 患者为单侧发病; ④ 患者相关临床资料完整 。排除标准: ① 患有心脑血管、肝脏、肾脏、造血系统疾病者; ② 妊娠期与哺乳期妇女; ③ 精神疾病患者。83例DCIS患者年龄35~78岁,平均(56.33±3.22)岁; 体质量指数(BMI)17~26 kg/m2, 平均(23.64±3.18) kg/m2。本研究征得医院医学伦理委员会批准。
1.2 方法
① 病理学诊断方法: 所有患者乳腺癌组织经石蜡包埋、切片,诊断为DCIS。② 乳腺钼靶X线摄影: 采用美国通用的 GEAphaSTMGF-101型乳腺钼靶仪器,对患者两侧的乳腺内外部位进行摄影。③ 超声造影: 仪器使用乳腺模式检查,造影探头替换为8 MHz, 使用诺维 (Sonovue)干粉剂(产自意大利Bracco公司)做造影剂,使用时加入生理盐水调成微泡混合液。先对患者先进行常规检查,扫描到病灶后,静脉注射混合液,探头调至造影模式,对患者进行扫描,保存影像视频,时长3 min以上。
1.3 观察指标与评判标准
DCIS细胞核分级(组织学分级)[6]: ① 高级别(低分化)为胞核异型性显著。细胞胞体大,细胞核较正常上皮细胞核大约2.5倍,空泡状或深染,核分裂明显,核仁多个,细胞核坏死,细胞核碎片、鬼影细胞或块状颗粒状嗜酸性组织碎片,粉刺型癌为此级别。② 中级别(中分化)为胞核异型性不显著。细胞胞体中度大,细胞核较正常上皮细胞核大1.52~2.50倍,核分裂少,异型性不明显伴坏死、中度异型不伴坏死筛状型、实性型和微乳头型癌。③ 低级别(高分化)为核异型性不明显。细胞胞体大小相当,胞质少,细胞核较正常上皮细胞核大约1.52倍,呈卵圆或圆形,弥漫分布,表膜平滑染色质细,核无分裂,无核仁,无坏死的筛状型、实性型和微乳头型癌。
恶性钙化判断标准[7]: ① 孤立、丛状、微小性钙化,直径<0.5 mm,分布>5枚/cm2; ② 成群密集性微小钙化,或者是微小钙化为主的大小不一的钙化,且密集分布于同一区域; ③ 线样、针状、虫状分布钙化; ④ 病变区内或边缘发现钙化; ⑤ 密集分布于乳腺导管的钙化等。软组织块影判断标准[6]: ① 肿块影; ②结构紊乱,局限致密。
超声造影增强评分标准[8]: ① 高级增强,在造影剂到达峰值位置,清楚显示病区肿块信号提高的幅度要高于健康区域,记为4分; ② 中级增强,造影剂达峰时,病区肿块信号提高的幅度和健康区域相近,记为3分; ③ 低级增强,造影剂达峰时,病区肿块信号提高的幅度小于健康区域,记为2分; ④ 无等级增强,从开始到结束,病区肿块信号一直没有任何变动,记为1分。
1.4 统计学分析
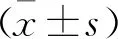
2 结 果
2.1 乳腺钼靶X线摄影与DCIS临床病理特征关系
在83例DCIS患者中,恶性钙化影60例,主要表现为线状、树枝状; 软组织块影有27例,均分布于同一区域,多呈现为V形、圆形、不规则形,病区呈现密度较高,边缘较清晰。 乳腺钼靶X线摄影与恶性钙化、软组织块影临床病理特征关系结果显示,乳腺钼靶X线摄影结果在恶性钙化、软组织块影方面具有差异性(P<0.05), 见表1。

表1 乳腺钼靶X线摄影与恶性钙化、软组织块影临床病理特征关系[n(%)]
2.2 乳腺钼靶X线摄影与恶性钙化、软组织块影临床病理特征相关性分析
乳腺钼靶X线摄影结果与DCIS患者恶性钙化、软组织块影呈显著正相关(P<0.05), 见表2。

表2 乳腺钼靶X线摄影与DCIS患者恶性钙化、软组织块影的相关性(n=83)
2.3 超声造影评分与DCIS临床病理特征的关系
83例DCIS患者中,超声造影增强评分数值在不同分化类型、淋巴结转移患者的病理特征间存在差异,差异具有统计学意义 (P<0.05), 见表3。
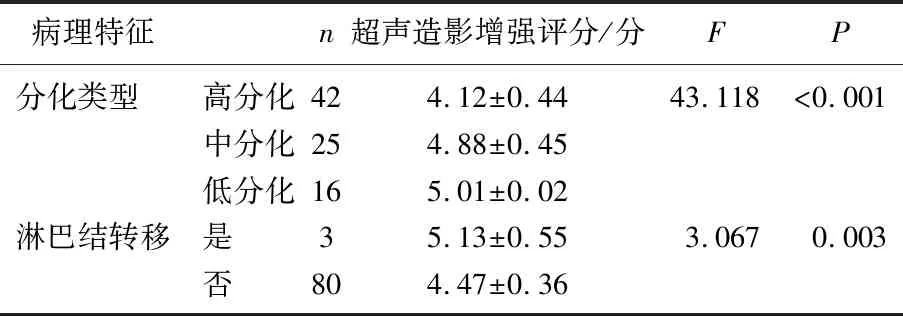
表3 超声造影与DCIS临床病理特征的关系
2.4 超声造影与DCIS临床病理特征相关性分析
超声造影增强评分与DCIS患者分化类型呈显著负相关(r=-0.771,P<0.05), 与淋巴结转移呈显著正相关(r=0.225,P<0.05), 见表4。

表4 超声造影增强评分与DCIS患者分化类型与淋巴结转移的相关性(n=83)
3 讨 论
DCIS是乳腺癌常见类型之一,其生长速度较快,肿瘤内部易引发细胞坏死或区域性钙化[9-10]。钙化是由于钙盐从细胞中分泌,随之沉淀堆积在细胞间隙中间,形成不规则的粗糙形态。由于DCIS患者病区的肿块生长于导管内,未突破基底膜层,生长成浸润性DCIS,所以其肿块影分布区域通常表现为边缘清晰,与浸润性DCIS的肿块影分布特征在边缘上有所不同[11-12]。DCIS的癌细胞生长在基底膜层内部,所以DCIS肿瘤转移扩散能力不高。DCIS患者临床确诊时多为早期,且DCIS在管内肿块较小,在常规外部检查时往往不能直接用手触摸到。为了提高诊确率,避免漏查,临床多采用钼靶X线或者超声造影进行检查[13]。乳腺钼靶X线应用于DCIS的优势为能快速、准确发现较小的钙化点以及坏死病区,因此对于部分没有肿块生成的DCIS, 运用乳腺钼靶X线进行检查仍能确诊[14]。超声造影可增强信号散射能力,提高区域的比较强度,提高影像的分辨水平,使成像效果更加直观准确,提高了诊断水平,弥补了常规超声不能清晰显示肿瘤内细小血管的缺点[15-16]。DCIS在超声造影技术下可清晰呈现出特征表现,高频图像与造影剂结合有助于提高诊断准确率[17]。
本研究结果显示,乳腺钼靶X线摄影结果在恶性钙化影、软组织块影病理特征方面具有差异性。乳腺钼靶X线摄影结果与DCIS患者恶性钙化、软组织块影呈显著正相关,提示DCIS的病理特征与乳腺钼靶X线摄影具有一定相关性,而由于恶性钙化和软组织肿块影是发现和诊断DCIS的主要特征,因此,钼靶X线是发现和诊断DCIS的重要检查手段。孙琳等[18]研究指出,乳腺钼靶X线摄影对DCIS腺体内钙化灶的诊断率较高,与本研究结论相符。同时,超声造影增强评分数值在分化类型、淋巴结转移方面存在差异; 超声造影增强评分与DCIS患者分化类型呈负相关,与淋巴结转移呈显著正相关,提示DCIS的病理特征与超声造影具有一定相关性。分析其原因为随着患者临床分化程度降低,发生转移,患者病情加重,超声造影的增强评分明显增加。任静等[19]也提出,随着肿瘤患者的肿瘤恶性程度加深,肿瘤的新生血管会增多,从而血流信号加重,超声造影评分随之增高,与本研究结论一致。乳腺钼靶X线观察DCIS病变区可能被高密度腺体遮盖,发生漏诊[20]。研究[21]表明, DCIS患者肿块严重增加,血管呈高通透性,超声造影后可见周边血管放射状显影,边界模糊不清,故临床可采用钼靶X线与超声造影联合诊断DCIS, 提高诊断准确率。但本研究存在不足之处,样本数量较少,后期需扩大样本进行深入分析。
综上所述, DCIS的病理特征与恶性钙化、软组织肿块影、不同分化类型及淋巴结转移相关。临床可将钼靶X线摄影与超声造影联合应用于DCIS诊断,以提高诊断准确性。

