噬菌体解聚酶及其与细菌荚膜间作用机制的研究进展
朱明希,何 平,盛跃颖
噬菌体在发现之初,就被认为对细菌治疗意义重大。直到青霉素等一系列抗生素被发现、提取和合成,噬菌体疗法逐渐居于次位。随着抗生素的广泛应用,多重耐药菌成为重要的医源性感染源,并且逐渐面临无药可医的境地。在此背景下,噬菌体疗法重新在抗菌效能和发展前景上显示出巨大优势[1]。噬菌体疗法主要是应用噬菌体对致病菌的特异性识别与裂解作用,进行高特异性抗菌,并且理论上对人体正常组织和生理功能的副作用较小,对正常菌群的破坏不大。但是已有文献也反映,噬菌体疗法若要广泛投入临床还有很多问题需要克服,如噬菌体与致病菌共进化导致抗菌作用下降,及噬菌体进入人体后会诱导产生抗体等问题[2]。
因此,分离提取噬菌体相关成分进行抗菌治疗,同时规避噬菌体的生物风险也开始得到广泛研究。部分噬菌体的尾丝蛋白被认为包含有特定的解聚酶,能够识别细菌荚膜并与之结合,主要通过分解荚膜多糖,使荚膜结构完整性破坏而使其丧失对菌体的保护作用,更便于抗生素发挥杀菌作用。甚至有实验表明,一定条件下机体本身的血清就足以杀死丧失荚膜保护的致病菌[3]。
相比噬菌体,解聚酶对细菌的作用更稳定,对菌株型别的敏感性不易受其他因素影响。已证明针对某种荚膜型的噬菌体,对相同荚膜型的不同菌株的侵染能力有所不同[4]。但若使用针对该荚膜的解聚酶,其对具有相同荚膜型的菌株的作用具有一致性且结果稳定。除此以外,解聚酶的热稳定性一般较高,可进行提取或表达、纯化,适合大量生产[4]。
本文将讨论噬菌体尾尖蛋白(tail spike protein, TSP)与细菌荚膜成分(以多糖为主)的相互作用,包括尾尖蛋白包含的解聚酶性质、解聚酶的作用菌株型别及可能的作用机理等。
1 尾丝蛋白-解聚酶概述
细菌荚膜是细菌致病性的重要因素之一,但同时它也为噬菌体的吸附提供位点。噬菌体尾丝一般可特异性识别宿主菌,并通过降解荚膜多糖而穿入细胞,输入遗传物质等成分[5-6]。噬菌体尾丝是多种蛋白的复合结构,解聚酶是噬菌体的尾丝实现吸附与降解功能的必要基础。
自1915年噬菌体被发现后,直到20世纪90年代后期,噬菌体上可以降解细菌荚膜多糖的成分才被真正提取和纯化[7]。截至2015年10月,在细菌-噬菌体相互作用的研究领域已有160个以上推定的解聚酶被发现,其编码核酸序列长度从197 bp至2 417 bp不等[8]。
判断噬菌体是否能够产生解聚酶一般是通过观察其透明噬菌斑(plaque)周围是否具有半透明的晕圈(halo),这是噬菌体的解聚酶裂解细菌胞外聚合物(Extracellular Polymeric Substance, EPS)产生的现象。晕圈的大小取决于噬菌体可以产生的解聚酶量以及每个噬菌斑包含的噬菌体个数;同时,噬菌体自身的潜伏期和增殖速率也会对其产生影响[9]。
基于解聚酶的高耐热性特点可以进行噬菌体与解聚酶的分离。将噬菌体在60 ℃下孵育30 min,待噬菌体被灭活后,再进行菌板点样实验观察是否有半透明晕圈产生[10]。除上述定性分析的方法,还有多种方法可对解聚酶的降解荚膜能力作量化评估。例如,可使用标准结晶紫或二甲基亚甲基蓝(DMMB)染料比色法,或对还原糖进行光谱测量以确定荚膜多糖的降解率。除此以外,利用聚丙烯酰胺凝胶电泳可比较未被降解的荚膜多糖和已被降解的荚膜多糖,或直接用扫描电镜来测量荚膜厚度,以检测解聚酶的降解能力。近年来还出现了激光干涉技术,可以根据小分子穿透荚膜的扩散速率来判断其降解情况[11]。
解聚酶可特异性降解宿主菌的荚膜,部分噬菌体的尾丝甚至包含不止1种解聚酶,可具有双特异性甚至是多特异性,扩大了噬菌体的宿主范围。双重宿主特异性使这类噬菌体具有明显的进化优势。这种现象的产生较为普遍,可能是具有2种不同宿主特异性尾尖蛋白的噬菌体在侵染同一宿主后,产生了第3种同时具有2种尾尖蛋白的噬菌体[5]。以肺炎克雷伯菌的噬菌体ØK5-2为例,Dean Scholl等人通过实验证明每一个噬菌体ØK5-2都含有K5和K30/K69两种解聚酶,而不是存在2个分别包含K5和K30/K69解聚酶的噬菌体集群[3]。再如,针对肺炎克雷伯菌的噬菌体IME205可产生2种解聚酶Dpo42和Dpo43,分别对肺克K47荚膜型菌株及K64荚膜型菌株有特异性作用[12]。
2 解聚酶的结构、分类及作用机制
2.1 解聚酶的结构 不同的解聚酶在作用底物、理化性质等方面具有显著差异,但它们具有相似的保守结构特征。大部分解聚酶存在于噬菌体尾丝的底板部位,一般构成同源三聚体(其中也有例外,如大肠杆菌噬菌体 63D 的解聚酶呈现同源四聚体结构[9])。每一个亚基都是平行的右手β-螺旋结构,该结构有利于拓展活性位点,可识别多糖结构并与其更紧密地贴合。正是由于这种三聚体以及每个亚基的β-折叠高度交织的结构,使解聚酶的化学性质十分稳定,可以在较宽泛的温度区间和pH值区间内都能保持活性[9,13-14]。
解聚酶因底物的不同而具有不同结构,但解聚酶所在的尾尖蛋白结构具有一定相似性。一般地,尾尖蛋白结构可以分为3个部分:N-末端结构域、中间结构域及C-末端结构域。以鲍曼不动杆菌噬菌体ΦAB6为例,其尾尖蛋白TSP三聚体结构中的一个单体如图1所示[15]。N-末端结构域可对应图中particle-binding domain,一般用于受体结合蛋白(receptor binding protein, RBP)或受体结合区(receptor binding domain, RBD)与尾丝结构或底板结构的连接;中间结构域的空间占比较大,活性部分可对应图中RBD,一般用于宿主的识别和发挥解聚酶活性;C-末端结构域即C-terminal domain,一般用于解聚酶单体蛋白的三聚体化,同时也发挥受体识别的作用。对于同一噬菌体群,其N-末端和C-末端的结构域是保守的,但中间结构域的可变性很大,用于适应不同宿主以及不同生存环境[13]。
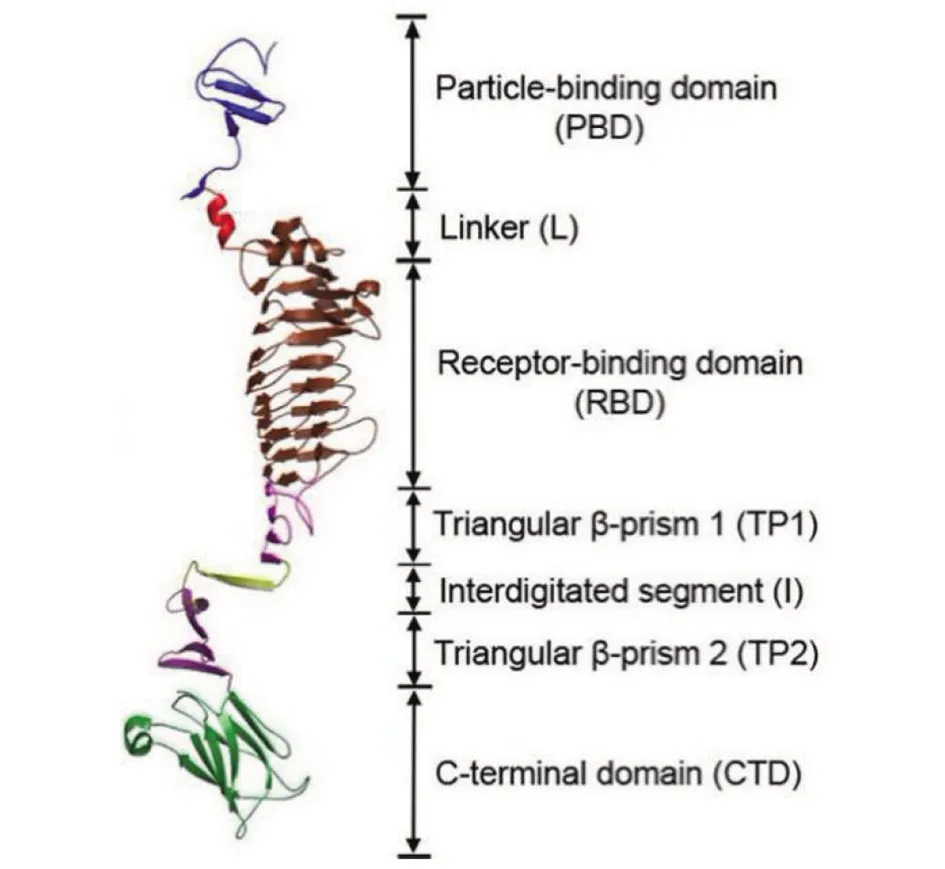
图1 ΦAB6 尾尖蛋白(TSP)单体的结构域[15]
除上述的尾丝自身结构外,还存在很多噬菌体通过附加在尾部的辅助结构域来介导与宿主的识别。例如部分长尾噬菌体和肌尾噬菌体,在其尾部蛋白的C-末端结合有Ig样结构域,目前推测该结构域与细胞表面糖类结构的结合作用有关[13]。
2.2 解聚酶的分类及作用机制 根据解聚酶的存在形式可分为以下两类:其一是作为噬菌体结构的组成部分,其二是裂解宿主细胞过程中产生的可溶性蛋白质。绝大多数的噬菌体解聚酶属于第一种类型,而第二类解聚酶不与结构基因有关,目前尚无法进行认定分类。本篇综述将着重讨论作为噬菌体的结构——尾丝蛋白复合物的组成部分而存在的解聚酶。
根据解聚酶的作用机制不同,可分为水解酶和裂解酶两大类。这两种解聚酶的作用方式将细菌的肽聚糖、荚膜多糖或脂多糖降解为低聚糖。
2.2.1 水解酶 此类解聚酶的作用机制为催化糖苷键水解,包括唾液酸酶、乙酰化酶、木糖苷酶、葡聚糖酶、鼠李糖胺酶等。以唾液酸酶为例,唾液酸酶作用于多聚糖末端的唾液酸的α-键。唾液酸广泛存在于细胞表面寡聚糖的末端,并且在多种致病菌中,唾液酸屏障都具有免疫防御的作用,与细菌致病力相关。唾液酸酶的作用可能对细菌生存没有直接影响,但荚膜结构的破坏使细菌对补体等的杀菌作用更加敏感,并且增强了巨噬细胞的吞噬作用[8]。
近年来研究发现,不同解聚酶对其作用的底物有不同的作用结构,并有其特异性的作用方式。如大肠杆菌噬菌体 HK620的尾丝蛋白 TSP 具有内切N-乙酰氨基葡糖苷酶活性,可以分解宿主菌表面脂多糖的O抗原,能将O抗原的六糖重复序列分解为六糖分子。缺失N-末端结构域的TSP(TSPΔD)为三聚体结构,三聚体轴心可平行地结合细菌O抗原六糖重复序列结构的一个六糖结构(如图2)。TSPΔD的每一个单体结合位点都位于β-螺旋结构域,结合槽表面带有负电荷,能与一个六糖结构形成17个氢键,随后通过水解产生的六糖分子,其还原端均具有N-乙酰氨基葡萄糖。由于空间限制,TSPΔD的结合槽内每次只能容纳一个六糖序列,理论上若仅从O抗原的外端进行切割,产物应为单一的六糖分子,然而通过分析裂解产物发现还存在更长的糖链,因此推测也存在从O抗原的内端进行切割的情况[16]。
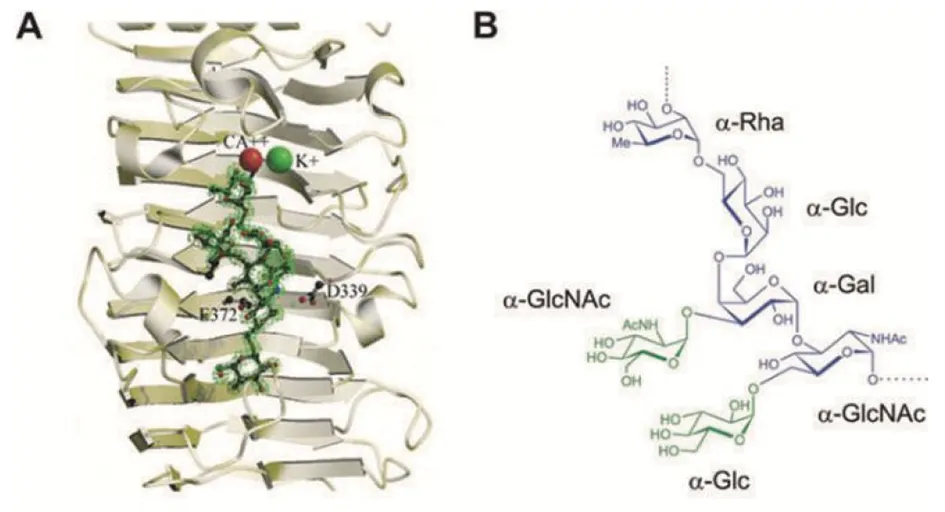
E372为Glu372,D339为Asp339。
除了对大肠杆菌的噬菌体及解聚酶研究较深入外,也有研究对肺炎克雷伯菌的噬菌体及其解聚酶作用机制开展了较全面的研究。如研究发现肺炎克雷伯菌噬菌体KP32的尾丝蛋白 KP32gp38 具有解聚酶活性。其酶的催化结构为一个“催化口袋”,在这个“口袋”中存在4个重要的氨基酸残基,分别是:Glu170,Asp229,Glu239和Asp241(如图3C)。该糖苷水解酶通过以上氨基酸残基的羧基之间的距离(Glu239与Asp229的羧基间距;Asp241与Glu170的羧基间距)来实现其生理活性——羧基间的距离不同,糖苷酶的作用机制也将发生变化。而在尾丝蛋白 KP32gp38 催化位点的邻近部位还有一个结构,称为糖类结合模块(carbohydrate binding modules, CBMs)(如图3A、B)。该模块的顶端区域含有芳香残基,这一类残基可通过其芳香环与糖类底物间成键,从而将底物锚定于催化位点的邻近部位,并促进催化作用。根据噬菌体家族的不同,CBM的糖类结合位点以及结合糖类的特异性可能不同[17]。
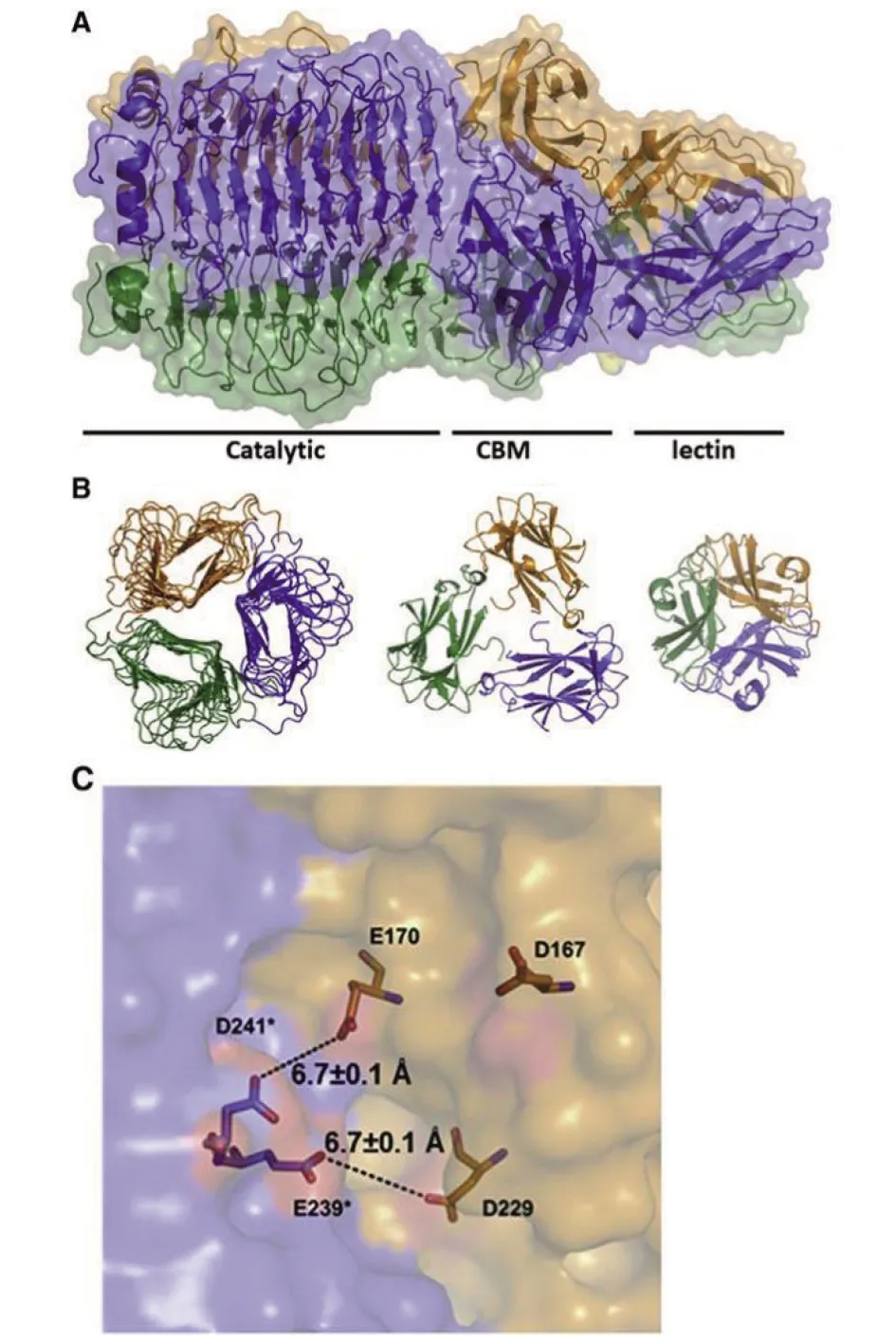
E170为Glu170,D229为Asp229,E239为Glu239,D241为Asp241。
2.2.2 裂解酶 裂解酶是通过β消除机制裂解β-1,4糖苷键,过程中不利用水分子,如透明质酸裂解酶、藻酸盐裂解酶和果胶裂解酶等。以透明质酸裂解酶为例,透明质酸是一种线性未硫酸化的糖胺葡聚糖聚合物,葡萄球菌、梭状芽孢杆菌、链球菌等具有透明质酸裂解酶,可以增加组织渗透性,增强其致病力。在一些前噬菌体中也可发现该酶,用于突破细菌荚膜以及促进溶原性转化。细菌细胞壁的肽聚糖结构是由N-乙酰葡糖胺(NAG)和N-乙酰胞壁酸(NAM)两种单糖互相间隔连接成长链,这种肽聚糖分子交织覆盖在细胞膜上。从结构来看,部分解聚酶能作用于肽聚糖分子间的联合键,如:N-乙酰基-β-D-氨基葡萄糖苷酶可切割NAG、NAM间的β-1,4糖苷键;N-乙酰基-β-D-胞壁质酶可切割NAM和NAG间的β-1,4糖苷键;N-乙酰胞壁酰基-L-丙氨酸酰胺酶可切割切割糖基与肽间的的酰胺键等[18]。
针对大肠杆菌K5菌株的噬菌体K5A能编码一种裂解酶KflA,该裂解酶存在于尾丝蛋白,可裂解K5的荚膜多糖上的重复序列。Kf5A由三聚体构成,每个单体可分为3部分——N-末端的α-螺旋结构域、中段单链、C-末端的右手β-螺旋结构域。3个单体在C-末端缠结。Kf5A中主要起催化β-消除反应的氨基酸残基是Glu206和Lys208。Glu206的羧基从C5获得质子,发生质子化;葡萄糖醛酸的C5的质子发生解离;质子化的Glu206的羧基和去质子化的葡萄糖醛酸的C5之间形成氢键。Lys208作为中间传递体,接受C5的质子并将其传递给糖苷键上的氧原子,通过上述过程实现裂解糖苷键作用[19-20]。
除此以外,极少部分的噬菌体具有脂肪解聚酶,其作用于三酰基甘油的羧基酯键的酶,可释放有机酸和甘油。目前在某些嗜纤维素菌属噬菌体和假单胞菌噬菌体中发现脂肪解聚酶结构域的存在[8]。
对于不同科的噬菌体,解聚酶的所在位置也可不同。对于肌尾噬菌体科,其尾丝上可能存在的解聚酶有唾液酸酶或果胶裂解酶:底盘上可能存在的解聚酶有唾液酸酶、果胶裂解酶或肽酶;对于短尾噬菌体科,其颈部可能有唾液酸酶或果胶裂解酶,尾丝可能有唾液酸酶或果胶裂解酶,底盘可能有果胶裂解酶;对于长尾噬菌体科,颈部可能有唾液酸酶或果胶裂解酶,尾丝可能有果胶裂解酶,底盘可能有唾液酸酶或果胶裂解酶[8]。
2.3 解聚酶的作用条件 尾丝蛋白的解聚酶活性范围较广泛,对环境的要求较低。如鲍曼不动杆菌的新型肌尾噬菌体(vB_AbaM_B9),其荚膜解聚酶B9gp69在一个很宽泛的pH值(5~9)、离子强度(0~500 mmol/L)和温度(20 ℃~80 ℃)范围内都能保持活性。并且在体外人肺细胞、哺乳动物细胞和人血清模型中进行试验,证明B9gp69对细胞无害。人血清中,K45菌株对血清的补体杀伤具有抗性,而经过解聚酶B9gp69处理后,K45菌株对体外血清敏感并被杀灭[21]。
噬菌体解聚酶具有其各自发挥作用的最佳环境,在特定条件下表现出最大活性。以针对大肠杆菌K1型荚膜多糖的大肠杆菌噬菌体的神经氨酸酶为例:其表现最大活性的酸碱度区间在pH 5.2到5.5。缓冲液的摩尔浓度同样对酶活性大小造成影响:在磷酸盐和乙酸盐缓冲液中,神经氨酸酶的最大Kl水解速率均为0.05 mmol/L。向乙酸盐缓冲液中添加9 mmol/L CaCl2会严重降低酶的活性,在此基础上再加入155 mmol/L NaCl,抑制作用将更为明显[21]。
2.4 解聚酶的变异 为了适应荚膜多糖结构以完成侵染,解聚酶可发生结构变化。通常来说,自然发生的适应可以有以下两种类型:
其一,通过突变来改变活性位点,属于垂直转移。此种突变一般发生在中间结构域,并且不会改变β-螺旋结构。噬菌体可以通过改变蛋白的折叠方式,使同一肽链因最终空间构象的不同而能够适应不同的底物[9]。
其二,通过与其他噬菌体进行多糖识别结构域的交换来实现特异性的改变。这类噬菌体通常具有高度保守的N-末端结构域,因其与解聚酶与尾丝结构或底板结构的连接相关。有的噬菌体还进化出更复杂的受体结合蛋白RBP结构来实现解聚酶和病毒体的连接[9]。
3 总结与展望
目前噬菌体疗法尚未被广泛普及,很大程度上是由于噬菌体存在潜在安全风险。噬菌体的遗传物质中可能携带抗生素抗性基因或其他细菌毒力因子,通过转导等方式可能转移到细菌中,造成致病菌抗性增强。若不选用溶原性噬菌体而选用裂解性噬菌体,则可能引起大量细菌裂解,导致短时间内大量内毒素和超抗原释放,从而引发炎症反应,使患者产生严重不良反应。并且噬菌体本身存在的免疫原性可能激发机体的清除作用,使得有效噬菌体浓度难以维持[22]。解聚酶作为非生物体,其安全性相比噬菌体更好,实际的应用疗效与毒副作用仍有待进一步研究。
解聚酶可以使细菌的荚膜被降解,虽无法直接杀死细菌,但若辅以抗生素治疗能达到更好杀菌效果。研究显示,细菌感染的个体可以依靠自身免疫力甚至是被抑制的免疫力将经解聚酶酶处理的细菌杀死,这是由于解聚酶降解细菌荚膜后,细菌对补体系统的杀菌作用更敏感,并且能增强巨噬细胞的吞噬作用[8,23]。
目前部分噬菌体解聚酶已经在临床得到应用。如已有临床使用3种解聚酶的复合物破坏阴沟肠杆菌的生物膜。部分特定酶没有已知噬菌体编码,可通过对噬菌体进行基因改造来实现[8]。
在医学、化学甚至食品加工行业,噬菌体解聚酶均有潜在应用前景。除此以外,解聚酶还可应用于细菌检测与诊断。特定的解聚酶已应用于肺炎克雷伯菌的荚膜分型。例如,对于肺炎克雷伯菌而言,荚膜合成位点——K-locus 长10~30 bp,K-locus的中央区域高度可变,编码合成荚膜特异糖类、加工输出蛋白质等。因噬菌体对荚膜成分特异性识别,可针对荚膜型别来进行肺炎克雷伯菌的分型,即Kl分型方法[24-25]。
噬菌体以其简单的生物学特性和基因编辑的简便性,便于诱导编码多种蛋白质等生物成分,可作为天然的蛋白质库,在生物技术方面拥有巨大意义[8]。由此可以推测,除了将已有解聚酶应用于抗菌治疗外,利用噬菌体的基因工程技术设计制造针对某些耐药性致病菌的解聚酶也具有广阔的临床应用前景。
利益冲突:无

