提取方法对香蕉皮粗多糖的组成、性质及结构的影响
刘小辰,林海龙*
(国投生物科技投资有限公司,北京 100034)
香蕉(Musa nana)属于芭蕉科芭蕉属植物,广泛种植于热带地区[1]。作为世界上栽培香蕉的古老国家之一,我国也有大面积栽培[2]。香蕉因其营养丰富、风味独特、口感甚佳深受人们的喜爱。香蕉皮占香蕉总质量的30%~40%[3],在加工后一般会被直接丢弃,不仅会造成资源浪费,还会对环境造成污染。国内外有很多对香蕉的研究,但多数集中在香蕉果肉上,对香蕉皮的研究和利用较少。
多糖(polysaccharides)是近年来研究的热点,其具有多种生理功能如抗氧化[4]、降血糖血脂[5]、降胆固醇、抗肿瘤[6]、免疫调节、调节肠道菌群[7]、保湿[8]等。香蕉皮中含有大量多糖,具有很大的应用潜力。王丽娟等[9]采用热水提取法从香蕉皮中提取多糖,香蕉皮粗多糖(banana peel crude polysaccharide,BPCP)得率为4.25%。朱开梅等[10]则进一步在热水浸提的基础上加入超声辅助,并对提取条件进行优化,最终香蕉皮多糖得率可达13.85%,且该多糖对人乳癌细胞MCF-7具有显著的抑制作用。赵广河等[11]通过单因素及正交试验优化了酸提与酶提香蕉皮多糖的工艺,并对提取效果进行了对比,发现酶法提取的得率明显高于酸法提取[12]。
为了比较不同提取方法对香蕉皮粗多糖(BPCP)结构的影响,本实验采用热水浸提(hot water extraction,HWE)、酸辅助提取(acid assisted extraction,ACAE)、碱辅助提取(alkali assisted extraction,ALAE)、酶法浸提(enzyme extraction,EE)、高压热水提取(high pressure hot water extraction,HPHWE)、超声热水提取(ultrasonic hot water extraction,UHWE)等6种方法进行香蕉皮粗多糖(BPCP)的提取,比较不同提取方法下BPCP化学组成、分子质量、单糖组成、表观结构、表观黏度等性质的差异,以期为香蕉副产物的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
香蕉皮:市售香蕉的皮;果胶酶(酶活5 U/mg)、纤维素酶(酶活10 U/mg)、牛血清蛋白(纯度≥98%),葡萄糖、甘露糖、鼠李糖、木糖、阿拉伯糖、半乳糖、氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸(均为色谱纯):美国Sigma-Aldrich公司;拜耳医药保健有限公司;体积分数80%乙醇、苯酚、浓硫酸、盐酸、考马斯亮蓝(均为分析纯):国药集团化学试剂(北京)有限公司。
1.2 仪器与设备
KQ5200DB型数控超声波清洗器:昆山市超声仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵:巩义市子华仪器有限公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪、Waters-2998紫外检测器:美国Waters公司;DAWN HELEOS-II激光光散射仪:美国Wyatt公司;Bruker VERTEX 33傅里叶变换红外光谱:德国Bruker公司;S-3400N扫描电子显微镜:日本Hitach公司;HAAKE MARS流变仪:美国热电公司;Alpha 1-4 LD冷冻干燥机:德国Christ公司。
1.3 方法
1.3.1 香蕉皮粗多糖提取方法及制备
热水浸提法(HWE)[9]:取香蕉皮100 g加入1 L去离子水打浆,于90 ℃水浴搅拌(350 r/min)提取2 h。
酸辅助提取(ACAE)[13]:取香蕉皮100 g加入1 L柠檬酸(pH值为2)打浆,于90 ℃水浴搅拌(350 r/min)提取2 h。
碱辅助提取(ALAE)[13]:取香蕉皮100 g加入1 L NaOH(0.5 mol/L)打浆,于90 ℃水浴搅拌(350 r/min)提取2 h。
酶法浸提(EE)[14]:取香蕉皮100 g加入1 L去离子水打浆,调pH至6.0(0.1 mol/L NaOH),加入0.5%果胶酶和1.0%纤维素酶,于50 ℃水浴搅拌(350 r/min)提取2 h。
高压热水提取(HPHWE)[15]:取香蕉皮100 g加入1 L去离子水打浆,在115 ℃、0.2 MPa条件下提取2 h。
超声热水提取(UHWE)[16]:取香蕉皮100 g加入1 L去离子水打浆,在超声功率400 W、50 ℃条件下处理30 min,于90 ℃水浴搅拌(350 r/min)提取2 h。
香蕉皮粗多糖提取结束后,冷却至室温,8 000 r/min离心15 min,200目纱布过滤得上清液,加入体积分数80%的乙醇,4 ℃条件下醇沉24 h,10 000 r/min离心20 min收集沉淀,超纯水沉淀复溶,减压旋蒸除去乙醇。再经过5 kDa超滤膜进行超滤,收集大分子,减压旋蒸(温度60 ℃,真空度0.1 MPa),-40 ℃冻干24 h得到香蕉皮粗多糖。
1.3.2 分析与检测
总多糖含量的测定:采用苯酚-硫酸法[17]。将粗多糖配制为0.1 mg/mL的溶液,移取1 mL样品溶液于玻璃试管中,加入1 mL 现配的6%苯酚溶液与5 mL浓硫酸,充分振荡混匀后静置反应25 min,于波长490 nm处测定吸光度值。用蒸馏水代替样品溶液,作为空白对照测定其吸光度值。以葡萄糖为标准品绘制标准曲线,按照标准曲线回归方程计算样品中总多糖的含量。
总蛋白含量的测定:采用Bradford法[18]。将粗多糖配制为0.1 mg/mL的溶液,移液枪移取50 μL样品溶液,滴加到96孔板中,再加入200 μL的考马斯亮蓝试剂。静置10 min后,用酶标仪在波长595 nm处测得溶液的吸光度值。用磷酸盐缓冲液代替样品溶液,作为空白对照测定其吸光度值。以牛血清蛋白为标准品绘制标准曲线,按照标准曲线回归方程计算样品中蛋白质的含量。
分子质量分布测定[19]:采用凝胶色谱法(gel permeation chromatography,GPC)测定多糖分子质量。将香蕉皮粗多糖配制为质量浓度10 mg/mL的溶液,进样量为20 μL,Ultrahydrogel保护柱(40 mm×6 mm),Ultrahydrogel 2000 SEC色谱柱(7.8 mm×300 mm)和Ultrahydrogel 1000 SEC(7.8 mm×300 mm)串联使用,柱温30 ℃,以超纯水为流动相,流速0.5 mL/min,采用示差检测器(refractive index detector,RID)检测多糖峰。用葡聚糖标品制作标准曲线,确定样品分子质量。
单糖组成分析:采用高效液相色谱法[20],Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)柱,柱温30 ℃,流动相为0.02 mol/L磷酸盐缓冲液(pH 6.7)和乙腈的混合溶液(83∶17,V/V)。控制流速为1 mL/min,进样量为20 μL,检测波长为245 nm。
傅里叶变换红外光谱分析[21]:1 mg样品与100 mg KBr混合并充分研磨至均匀粉末,压片。于波数3 750~500 cm-1范围扫描,分辨率为4 cm-1。
扫描电子显微镜观察[22]:样品放于双面胶带上并喷薄金层,以15.0 kV的加速电压于扫描电子显微镜观察台上收集图像,放大倍数为1 000。
流变学特性测定[22]:分别配制质量浓度为10 g/100 mL的样品溶液,于20 ℃、剪切速率1~100 s-1条件下使用流变仪测定不同BPCP的表观黏度。
1.3.3 数据处理
所有实验均重复3次,结果取平均值,表示为“平均值±标准差”(n=3)。使用Origin 9.0软件作图。
2 结果与分析
2.1 不同提取方法得到香蕉皮粗多糖的化学组成
不同提取方法得到的香蕉皮粗多糖的化学组成见表1。由表1可知,提取方式对粗多糖的总多糖、总蛋白含量有显著影响。与其他提取方式相比,BPCP-ACAE的总多糖含量较低(7.54%),这可能是由于酸提取的样本中含有大量酚类、色素等。通过其他方式获得的粗多糖中总多糖含量都在30%以上,其中BPCP-UHWE总多糖最高(39.62%)。BPCP-ACAE和BPCP-HPHWE中不含蛋白质,BPCP-ALAE中总蛋白含量最高(17.77%)。因此,香蕉皮粗多糖更适合采用超声热水提取的方法制备。

表1 不同提取方法对香蕉皮粗多糖化学组成的影响Table 1 Effect of different extraction methods on the chemical composition of banana peel crude polysaccharides
2.2 不同提取方法得到香蕉皮粗多糖的分子质量分布情况
不同提取方式得到的香蕉皮粗多糖的平均分子质量分布情况见表2。由表2可知,不同提取方式制备的香蕉皮粗多糖分子质量分布有显著差异。BPCP-HPHWE多为分子质量较小的多糖,其分子质量为2.68 kDa的多糖占94.4%,说明BPCP-HPHWE分子质量分布较为集中。

表2 不同提取方法对香蕉皮粗多糖分子质量分布的影响Table 2 Effect of different extraction methods on the molecular mass distribution of banana peel crude polysaccharides
2.3 不同提取方法得到香蕉皮粗多糖的单糖组成
由表3可知,几种BPCP的单糖组成差异显著,均含有甘露糖、葡萄糖醛酸和半乳糖醛酸。BPCP-ACAE中不含有鼠李糖、葡萄糖、阿拉伯糖;BPCP-ALAE不含有半乳糖;BPCP-HPHWE不含有葡萄糖、阿拉伯糖;BPCP-HWE不含有氨基葡萄糖、葡萄糖、半乳糖;BPCP-UHWE、BPCP-EE均不含有氨基葡萄糖、木糖。不同的制备手段对细胞壁的破坏程度不同,进而导致溶出物的组成和化学结构不同,这可能是本研究获得的六种多糖在单糖组成上明显差异的关键因素[23-24]。

表3 不同提取方法对香蕉皮粗多糖的单糖组成的影响Table 3 Effect of different extraction methods on monosaccharide composition of banana peel crude polysaccharide
2.4 不同提取方法得到香蕉皮粗多糖傅里叶变换红外光谱结果
由图1可知,粗多糖在3 750~500 cm-1波数范围内具有明显的多糖特征吸收峰。波数3 340 cm-1处的吸收峰为O-H的伸缩振动峰,波数2 931 cm-1附近的吸收峰与糖环中C-H的伸缩振动有关[25]。波数1 750 cm-1处的吸收峰是由C=O的伸缩振动引起的[25],波数1 600 cm-1和1 410 cm-1处的吸收峰是由羧基(COO-)的非对称和对称伸缩振动引起的[27],波数1 200~1 000 cm-1范围的两个吸收峰证明了吡喃糖苷的存在[28]。不同提取方式得到的香蕉皮粗多糖有机官能团组成无明显差异。
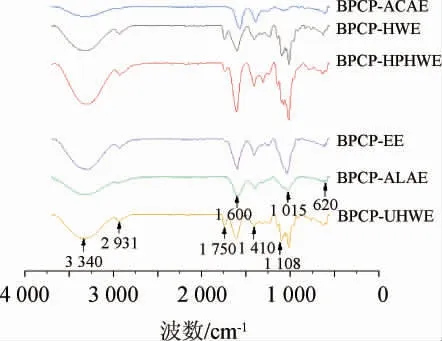
图1 不同提取方法得到香蕉皮粗多糖的红外光谱Fig.1 Infrared spectra of banana peel crude polysaccharides obtained by different extraction methods
2.5 不同提取方法得到香蕉皮粗多糖分子形态观察结果
不同提取方法得到香蕉皮粗多糖的扫描电镜图结果图2。由图2可知,BPCP-HWE与BPCP-UHWE有着相似的结构,表面光滑,分子间结合紧密;BPCP-HPHWE表面光滑,整体结构呈乳液状;BPCP-ALAE、BPCP-EE、BPCP-ACAE均为分散型结构,其中BPCP-ALAE、BPCP-ACAE呈颗粒状聚集,BPCP-EE呈碎片状、表面疏松多孔。可能是不同处理方式获取的多糖种类不同,以及对糖苷键及多糖链内与链间的氢键破坏程度不同,进而造成多糖表面微观结构的明显差异[29]。

图2 不同提取方法得到香蕉皮粗多糖的扫描电镜图Fig.2 Scanning electron micrographs of banana peel crude polysaccharides obtained by different extraction methods
2.6 不同提取方法得到香蕉皮粗多糖流变学特性结果
不同提取方法得到香蕉皮粗多糖流变特性见图3。由图3可知,在实验涉及的剪切速率范围内,BPCP-HWE(0.006~0.023 mPa·s)和BPCP-UHWE(0.006~0.016 mPa·s)的黏度始终高于其他几种多糖,具有更大分子质量的BPCP-ACAE表观黏度则比较小(0.001~0.005 mPa·s),说明分子质量不是影响BPCP黏度的主要因素。但是结合SEM表观结构观察结果可以看出,BPCP-UHWE与BPCP-HWE有相似的结构,均为比较大的块状固体,说明其分子间结合比较紧密,这可能是造成其高黏度的原因。随着剪切速率的增加,BPCP的黏度也随之下降,呈现明显的剪切稀化现象[30],这是因为在高剪切速率下多糖溶液中的分子交联会因为外力的作用断裂,造成溶液黏度的下降[19]。

图3 不同提取方法对香蕉皮粗多糖流变特性的影响Fig.3 Effects of different extraction methods on the rheological properties of banana peel crude polysaccharides
3 结论
本实验对比了6种不同提取方法对BPCP的化学组成、分子质量、单糖组成、表观结构、表观黏度等的影响。结果表明,BPCP-UHWE总多糖含量最高(39.62%),BPCP-ALAE中总蛋白含量最高(17.77%);不同BPCP的平均分子质量分布及单糖组成存在明显差异;BPCP-W与BPCP-UHWE均为分子间结合比较紧密大块状结构,表面光滑;BPCP-HPHWE表面很光滑,呈乳液状;BPCP-ALAE、BPCP-ACAE呈颗粒状聚集,BPCP-EE呈碎片状、表面疏松多孔。BPCP的表观黏度与其平均分子质量大小无关,而与其表观结构明显相关。综上所述,不同提取方法对BPCP的化学组成、分子质量、单糖组成、表观结构、表观黏度等均有较大的影响。

