奥格列汀合成研究进展
刘竺云,李情情,吕萌,王立中,,张茂风,,管运才,周国春
(1.泰州职业技术学院,江苏 泰州 225300; 2.南京工业大学,江苏 南京 211816;3.江苏省智能制药产教融合平台,江苏 泰州 225300)
奥格列汀(Omarigliptin)化学名为(2R,3S,5R)-2-(2,5-二氟苯基)-5-[2-(甲基磺酰基)-2,6-二氢吡咯并[3,4-C]吡唑-5(4H)-基]四氢-2H-吡喃-3-胺(图1),别名MK-3102,是由美国默沙东公司开发的新一代超长效二肽基肽酶-4(DPP-4)抑制剂类口服降糖药[1-2]。2015年9月28日,奥格列汀(商品名Marizev)在日本批准上市,主要作为成年人长效的Ⅱ型糖尿病治疗用药[3-4]。
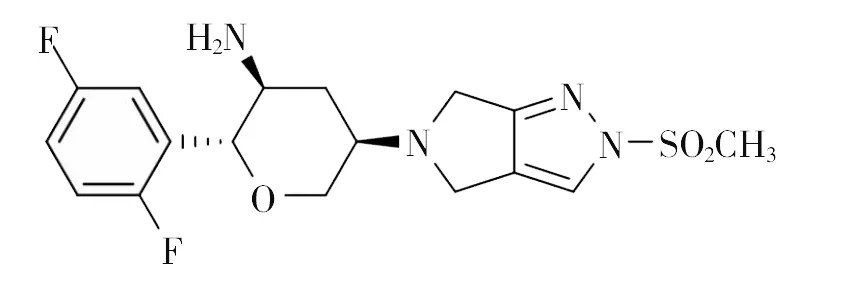
图1 奥格列汀的化学结构式
Biftu等[5-6]于2010年率先合成了Omarigliptin。2013年Zacuto等[7]改进反应路线,缩短了反应步骤,在此基础上,Chung[8-10]及Delucchi等[11]又优化了反应条件及路线,避免使用重金属及毒剧试剂,有利于工业化放大生产。笔者对奥格列汀进行了逆合成分析(图2)。

图2 奥格列汀逆合成分析
由图2可见,奥格列汀有3种有效的逆合成切断方式。按照切断1和切断2的组合,可将目标分子分为片段A,B,C+D;按照切断2和切断3的组合,可将目标分子分为片段A+B,C+D或A+B,C,D;按照切断1、切断2和切断3,可将目标分子分为片段A,B,C,D。其中片段A+B和片段C+D是合成奥格列汀的关键中间体。按照不同的切断方式,本文对奥格列汀关键中间体(A+B,C+D)及奥格列汀的合成方法进行了报道。
1 关键中间体[(2R,3S)-2-(2,5-二氟苯基)-5-氧四氢-2H-吡喃-3-基]氨基甲酸叔丁酯(10)的合成(10=片段A+B)
奥格列汀中间体(10)的合成,主要包括6种路径(见图3)。

图3 关键中间体(10)的合成路线
1.1 以N-(二苯基亚甲基)甘氨酸乙酯(2)为原料[8]
2015年,Chung[8]等化合物2和苯磺酸炔丙基酯(3)为起始原料,通过烷基化反应、氨基保护、酯化反应、酰化反应、不对称加氢反应、环合反应、环合反应、硼氢化-氧化反应,最后经氧化反应得到化合物10,9步反应总收率42.3%。该路线中使用多种贵金属催化剂及昂贵的手性配体,且后处理工艺复杂,不适合工业化生产。
1.2 以1,4-二氟苯(11)为起始原料
Ottorino等[11]以1,4-二氟苯(11)为起始原料经过傅克反应、氨化后成盐反应得到2-氨基-1-(2,5-二氟苯基)乙酮盐酸盐(13),两步收率77.3%;作为选择,化合物12也可以经重氮化反应、催化氢化后成盐反应得到化合物13,两步收率78.2%;化合物13再经酰胺化反应、烷基化反应分别得到化合物1-(2,5-二氟苯基)-1-氧代戊-4-炔-2-基氨基甲酸叔丁酯(6)、1-(2,5-二氟苯基)-1-氧代戊-4-炔-2-基氨基甲酸苄酯(17),两步收率分别为87%~90%,43.5%;再参照1.1合成得到中间体10。该路线中化合物14的制备需要用到剧毒易爆的叠氮化钠,化合物16、17需要经二氧化硅柱层析纯化,不适合工业化放大生产,但由化合物11依次经12、13、15制备得到化合物6的路线适合工业化生产。
1.3 以2-(2,5-二氟苯基)-2-氧代乙基氨基甲酸叔丁酯(15)或2-(2,5-二氟苯基)-2-氧代乙基氨基甲酸苄酯(16)为起始原料[11]
根据Ottorino等报道的另外一种方案是以化合物15或化合物16作为原料依次经烷基化反应、不对称加氢反应、环氧化反应、环合反应得到化合物叔丁基((2R,3S)-2-(2,5-二氟苯基)-5-羟基四氢-2H-吡喃-3-基)氨基甲酸酯(9),4步总收率分别为64.7%、69.7%。再参照1.1合成得到中间体10。该路线中使用到价格昂贵的钌试剂,不适合工业化生产。
1.4 以2,5-二氟苯甲醛(24)为起始原料
Biftu等[5-6]及Chung等[9-10]均以2,5-二氟苯甲醛(24)在碱性环境下与硝基甲烷发生偶联反应得到(R)-1-(2,5-二氟苯基)-2-硝基乙烷-1-醇(25),收率92%~100%;化合物25再经过迈克尔-内酯化反应、氯化反应、消去反应、碱促进的结晶诱导的非对映异构体转化反应、硼氢化-氧化反应、氢化还原反应得到化合物9的总收率为54.9%。再参照1.1合成得到中间体10。该路线中使用到昂贵的手性配体,硝基甲烷毒性很大且易制爆,故不宜规模化生产。
1.5 以(R)-1-(2,5-二氟苯基)-2-硝基乙烷-1-醇(25)为起始原料[5-6]
化合物25使用三氧化铬或者戴斯马丁(Dess-Martin)试剂发生氧化反应得到1-(2,5-二氟苯基)-2-硝基乙烷-1-酮(30),收率80%;化合物30再与3-碘-2-碘甲基丙烯成环反应得到6-(2,5-二氟苯基)-3-亚甲基-5-硝基-3,4-二氢-2H-吡喃(31),收率30%;化合物31经硼氢化钠还原、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)构型转化得到(2S,3R)-2-(2,5-二氟苯基)-5-亚甲基-3-硝基四氢-2H-吡喃(32);化合物32在酸性条件下利用锌还原得到(2R,3S)-2-(2,5-二氟苯基)-5-亚甲基四氢-2H-吡喃-3-胺(33);化合物33经Boc2O保护氨基得到[(2S,3R)-2-(2,5-二氟苯基)-5-亚甲基四氢-2H-吡喃-3-基]氨基甲酸叔丁酯(34),再经四氧化锇氧化得到[(2R,3S)-2-(2,5-二氟苯基)-5-羟基-5-(羟甲基)四氢-2H-吡喃-3-基]氨基甲酸叔丁酯(35);化合物35再经高碘酸钠或者四醋酸铅氧化得到化合物10;作为选择,化合物34也可以经高碘酸钠/四氧化锇一锅法氧化得到化合物10。该路线中化合物31需要柱层析纯化,且收率偏低,氧化反应使用了剧毒的四氧化锇,均不利于大规模生产。
1.6 以2-氯-1-(2,5-二氟苯基)乙酮(12)为起始原料[5]
化合物12在DIPEA碱性环境下与苯酚反应得到2,5-二氟苯甲酸苯酯(36);化合物36在氢化钠存在下与硝基甲烷反应得到化合物30。再参照1.5合成得到中间体10。该路线中同样使用了毒性很大且易制爆的硝基甲烷,故不宜规模化生产。
2 关键中间体2-(甲基磺酰基)-2,4,5,6-四氢吡咯并[3,4-c]吡唑43的合成(43=片段C+D)
奥格列汀中间体43的合成,主要包括3种(见图4)。
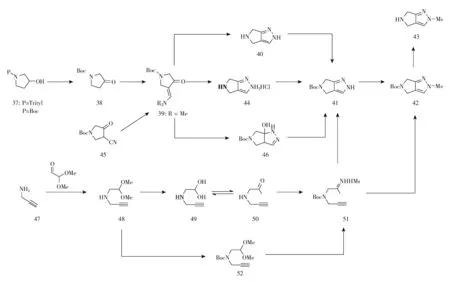
图4 关键中间体43的合成路线
2.1 以1-三苯吡咯烷-3-醇或3-羟基吡咯烷-1-羧酸叔丁酯37为原料[5-8,12]
1-三苯吡咯烷-3-醇或3-羟基吡咯烷-1-羧酸叔丁酯(37)发生斯文(Swern)氧化分别得到1-三苯吡咯烷-3-酮或3-氧吡咯烷-1-羧酸叔丁酯(38);化合物38与N,N-二甲基甲酰胺二甲基缩醛发生缩合反应得到3-[(二甲氨基)亚甲基]-4-氧吡咯烷-1-羧酸叔丁酯(39),收率88%~99%;化合物39与肼反应后在盐酸条件下环合形成盐酸盐再经碱化得到2,4,5,6-四氢吡咯并[3,4-c]吡唑(40),收率62%;化合物40在碱性条件下经Boc2O保护氨基得到化合物41,收率96%;化合物41在氢化钠或二(三甲基硅基)氨基钠等碱存在下与甲磺酰氯反应得到2-(甲基磺酰基)-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-羧酸叔丁酯(42),收率100%[6]、83%~85%[7]、84%[8]、92%[12];化合物42经三氟乙酸水解得到2-(甲基磺酰基)-2,4,5,6-四氢吡咯并[3,4-c]吡唑(43)。在该路线中化合物40的收率偏低。作为选择,化合物39与水合肼反应后在酸性条件下反应得到2,4,5,6-四氢吡咯并[3,4-c]吡唑二盐酸盐(44),收率80%,较之前提高了18%;化合物44再在碱性条件下经Boc2O保护氨基得到化合物41,收率76%。该路线的整体收率较高,且简化了反应路线及步骤。
2.2 以3-氰基-4-氧吡咯烷-1-羧酸叔丁酯45为原料[8]
3-氰基-4-氧吡咯烷-1-羧酸叔丁酯(45)在雷尼镍/氢气环境下与二甲胺反应得到化合物39;化合物39与水合肼反应得到6a-羟基-3a,4,6,6a-四氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(46),收率92%[8];化合物46在对甲基苯磺酸一水合物存在下发生消去反应得到化合物41,收率87%[8]。再参照2.1合成得到中间体43。该路线中原料易得,反应收率较高,后处理纯化简单,适合工业化放大生产。
2.3 以炔丙基胺(47)为原料[9]
化合物47在三乙酰氧基硼氢化钠催化下与2,2-二甲氧基乙醛反应得到N-(2,2-二甲氧基乙基)丙-2-炔-1-胺(48),然后在酸性条件下脱保护得到2-(丙-2-炔-1-基氨基)乙烷-1,1-二醇(49),脱水得到2-(丙-2-炔-1-基氨基)乙醛(50);化合物50与甲磺酰肼反应后再经Boc2O保护氨基得到叔丁基(E)-(2-(2-(甲基磺酰基)肼基)乙基)(丙-2-炔-1-基)氨基甲酸酯(51);作为选择,化合物48经Boc2O保护氨基得到(2,2-二甲氧基乙基)(丙-2-炔-1-基)氨基甲酸叔丁酯(52);化合物52在酸性环境下与甲磺酰肼反应得到化合物51;化合物51在碱性环境下发生环合得到化合物41;再参照2.1合成得到中间体43。作为选择,化合物51也可以在磷酸钾/过氧乙酸叔丁酯存在下经乙二醇二甲醚溴化镍和醋酸亚铜共同催化反应得到化合物42;再参照2.1合成得到中间体43。该路线中原料和催化剂价格较昂贵,合成路线较长,不利于工业化生产。
3 奥格列汀的合成
3.1 按片段A+B→C+D的顺序构建方式
以化合物42为起始原料与苯磺酸反应得到2-(甲基磺酰基)-2,4,5,6-四氢吡咯并[3,4-c]吡唑苯磺酸盐(53),收率99%[6]、95%[8,12]、91%~92%[13];化合物53在三乙酰氧基硼氢化钠/二甲基乙酰胺(DMA)体系下与中间体10反应得到叔丁基((2R,3S,5R)-2-(2,5-二氟苯基)-5-(2-(甲基磺酰基)-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-基)四氢-2H-吡喃-3-基)氨基甲酸酯(54),收率94%[6]、75%~83%[13];化合物54在硫酸/DMA体系下水解得到奥格列汀(1),收率89%[6-7];作为选择,化合物54也可以使用苯磺酸[8,13]或三氟乙酸[8-9]水解得到化合物1,收率58%(苯磺酸)[8]、90%(三氟乙酸)[8]、69%~71%[13]。该路线反应条件温和、操作简便、副产物少、收率较高、适合于工业化生产。同时,化合物42与关键中间体10也可以依次经过三氟乙酸脱保护、三乙酰氧基硼氢化钠/DMA体系下一锅法制得化合物1,收率63%[14];也可以化合物53为起始原料与关键中间体10依次经过三氟乙酸脱保护、三乙酰氧基硼氢化钠/DMA体系下反应一锅法制得化合物1,收率57%[14]。该路线均使用一锅法、操作更简便、但使用了柱层析分离纯化不利于工业化放大生产(图5)。
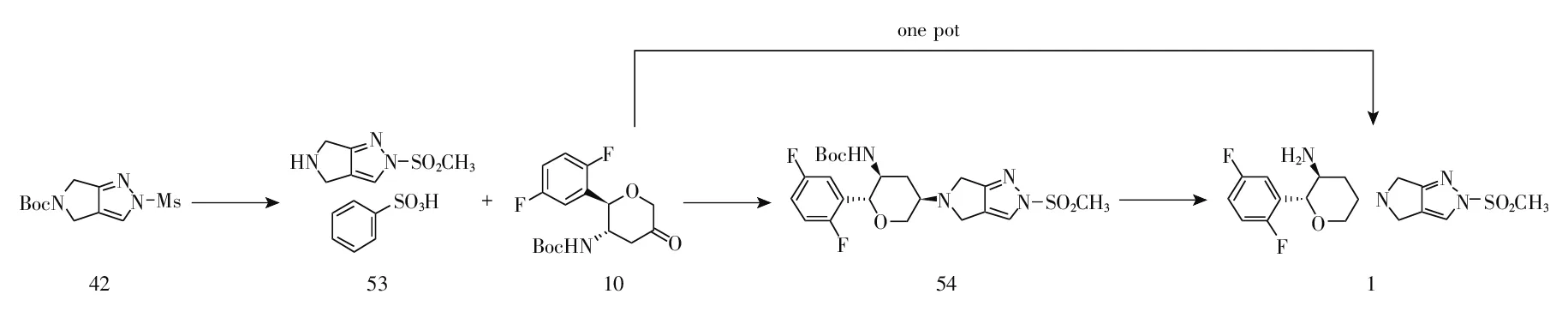
图5 奥格列汀合成路线1
2017年,佘阳[15]以(9S,10S)-9-(2,5-二氟苯基)-8-氧杂-1,5-二硫杂螺[5.5]十一烷-10-羧酸乙酯(55)为起始原料先后经脱保护反应、亚胺化-还原反应、氨化反应、重排反应得到目标化合物1,4步反应总收率65.6%。该路线中使用到毒性较大的氯化汞、氧化汞和氨气,不适合工业化生产(图6)。
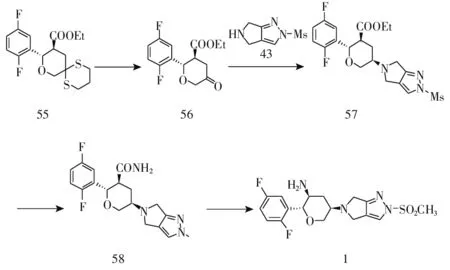
图6 奥格列汀合成路线2

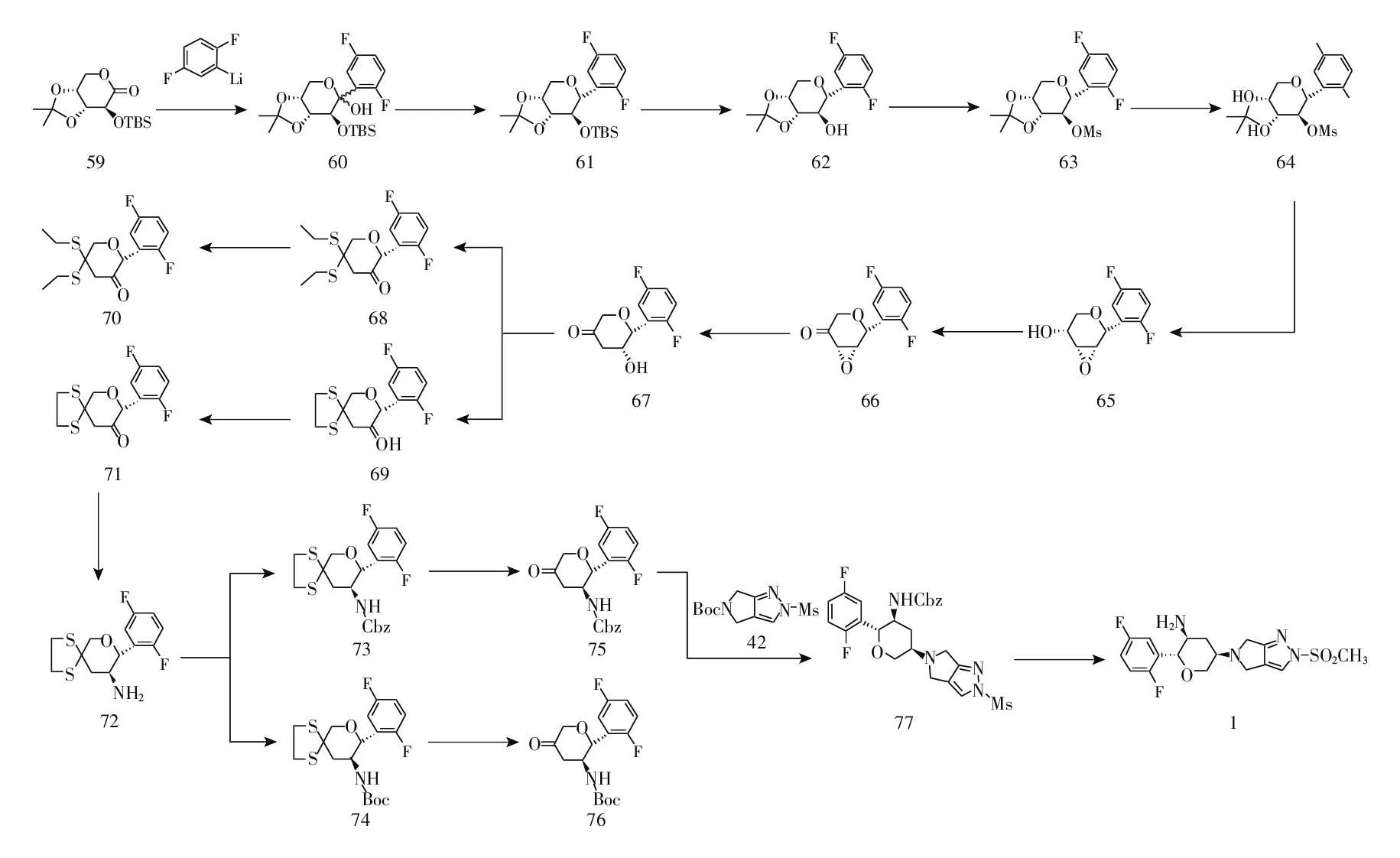
图7 奥格列汀合成路线3
2016年,黄燕鸽[17]以化合物24为起始原料与4-硝基-1-丁炔经不对称Henry反应、分子内关环反应、氧化反应、加成反应、催化还原反应得到目标化合物1,5步总收率73.8%。该路线中原料4-硝基-1-丁炔、合成化合物27所使用的催化剂和配体价格昂贵,不适合大工业化生产(见图8)。
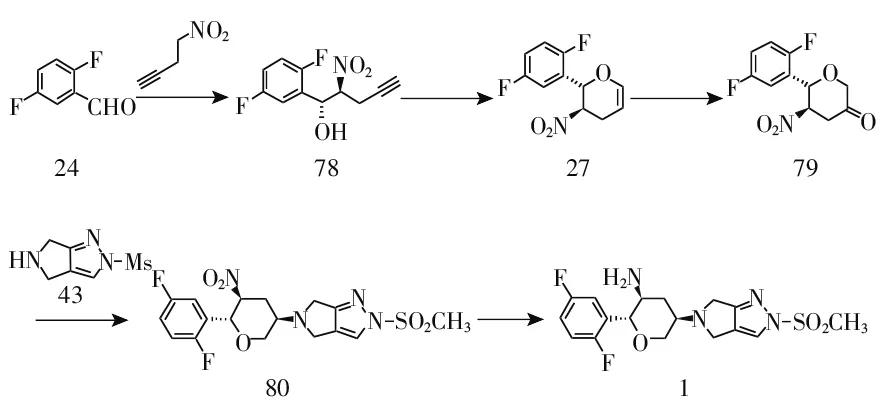
图8 格列汀合成路线4
3.2 按片段A+B+C→D的顺序构建方式
以关键中间体10为起始原料与化合物40的对甲苯磺酸盐在STAB存在下反应得到叔丁基((2R,3S,5R)-2-(2,5-二氟苯基)-5-(2,6-二氢吡咯[3,4-c]吡唑-5(4H)-基)四氢-2H-吡喃-3-基)氨基甲酸酯(81),收率80%[8];化合物81再与甲磺酰氯缩合得到化合物54,收率75%~79%[7]、72%[8];化合物54再参照1.1得到目标化合物1。该路线原料易得、操作简便、适合工业化生产(图9)。
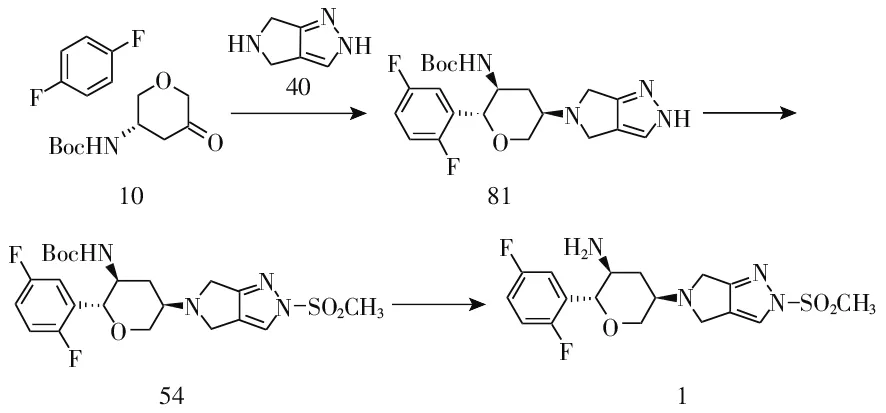
图9 奥格列汀合成路线5
4 奥格列汀晶型制备
同一药物的不同晶型在溶解度、溶解速度、洁净度、结晶形态和稳定性等方面存在差异,而且在加工、结晶、处理、压力稳定性和给药方面具有一定影响。上市商品Marizev属于奥格列汀(化合物1)的无定形游离碱(表1),因此研发更适合临床应用的新晶型对于药物开发具有重大意义。

表1 奥格列汀晶型种类及制备[18-19]
5 结束语
采用逆合成分析,可以将奥格列汀切为A,B,C,D共4个片段,奥格列汀的合成路线以汇聚式为主,其中A+B→C+D型为热点构建方式。对比发现,路线1.2中以1,4-二氟苯(11)为起始原料,依次经12、13、15制备得到化合物6的路线适合工业化生产。路线2.2、路线3.1中以化合物42为起始原料分步合成目标化合物1及路线3.2反应条件温和、操作简便、副产物少、收率较高、具有较高的应用前景。同时,也为新型DPP-4抑制剂的研发提供了一定帮助。

