HBV抗原对乙型肝炎相关性肝细胞癌分化程度的影响*
罗昊翔,李秀惠
(1.右江民族医学院,广西百色 533000;2.首都医科大学附属北京佑安医院,北京100086)
据流行病学统计,全球大约有3.5~4.0亿人患HBV感染相关的疾病,而接近50%的慢性HBV感染者可能会发展为肝癌[1]。原发性肝癌在我国也是发病率和病死率均较高的恶性肿瘤之一,且有逐年增高的趋势[2]。然而,乙型肝炎相关性肝细胞癌(HCC)的发生机制尚未完全清楚,目前对于HBV血清标志物组合模式与HCC发生的关系及HBsAg、HBeAg、HBcAg在HCC发生机制中的研究较少。探究HBV抗原导致肝细胞异常分化的机制对于乙型肝炎相关性HCC的诊断、治疗、预防和预后有重要的意义。本研究通过收集乙型肝炎相关性HCC患者的住院病例资料,对乙型肝炎相关性HCC患者的HBV血清标志物、病理标本的免疫组织化学检测结果与HCC分化类型的关系进行探讨,现将结果报道如下。
1 资料与方法
1.1 一般资料
收集首都医科大学附属北京佑安医院2019年诊断HCC且HBV感染或既往感染的住院患者260例,性别和年龄不限。纳入研究的HCC患者需同时具备以下要求:HBV感染或既往感染者;病理检查有分化类型;须有免疫组织化学(HBsAg、HBcAg)的检测结果;诊断须为HCC。排除标准:抗-HBs单一阳性者;合并HCV等其他肝炎病毒感染者;酒精性肝病等其他因素相关性肝癌患者;血清学、病理学和免疫组织化学(HBsAg、HBcAg)检查资料任一项不全者;肝腺癌、胆管细胞癌等非HCC的类型。
1.2 资料收集及分析
收集患者的HBV血清学、免疫组织化学(HBsAg、HBcAg)和HCC病理学检测高、中、低分化类型的资料,按照检测结果指标,输入SPSS21.00软件进行统计分析。
1.3 统计学处理
使用SPSS21.00软件对收集的数据进行处理和统计分析。将病例资料中的结果,根据HBV血清标志物组合模式的不同,分类输入SPSS21.00统计软件,使用χ2检验进行统计分析,理论频数小于1时,使用Fisher确切概率法。并分别统计分析血清HBsAg、血清HBeAg、免疫组织化学检测结果中HBsAg和HBcAg与HCC组织分化的关系。以P<0.05为差异有统计学意义。
2 结 果
2.1 HBV血清标志物组合模式与HCC分化程度的相关性
乙型肝炎HBsAg(+)、抗-HBe(+)、抗-HBc(+)(简称“小三阳”)血清标志物组合模式152例(58.5%),其中肝组织病理显示HCC高分化类型3例(1.2%),中、低分化类型149例(57.3%);非“小三阳”血清组合模式共108例(41.5%),其中HCC高分化类型7例(2.7%),中、低分化类型有101例(38.8%)。HBV血清标志物组合模式对乙型肝炎相关性HCC分化类型的影响差异无统计学差异(χ2=0.125,P>0.05),见图1。
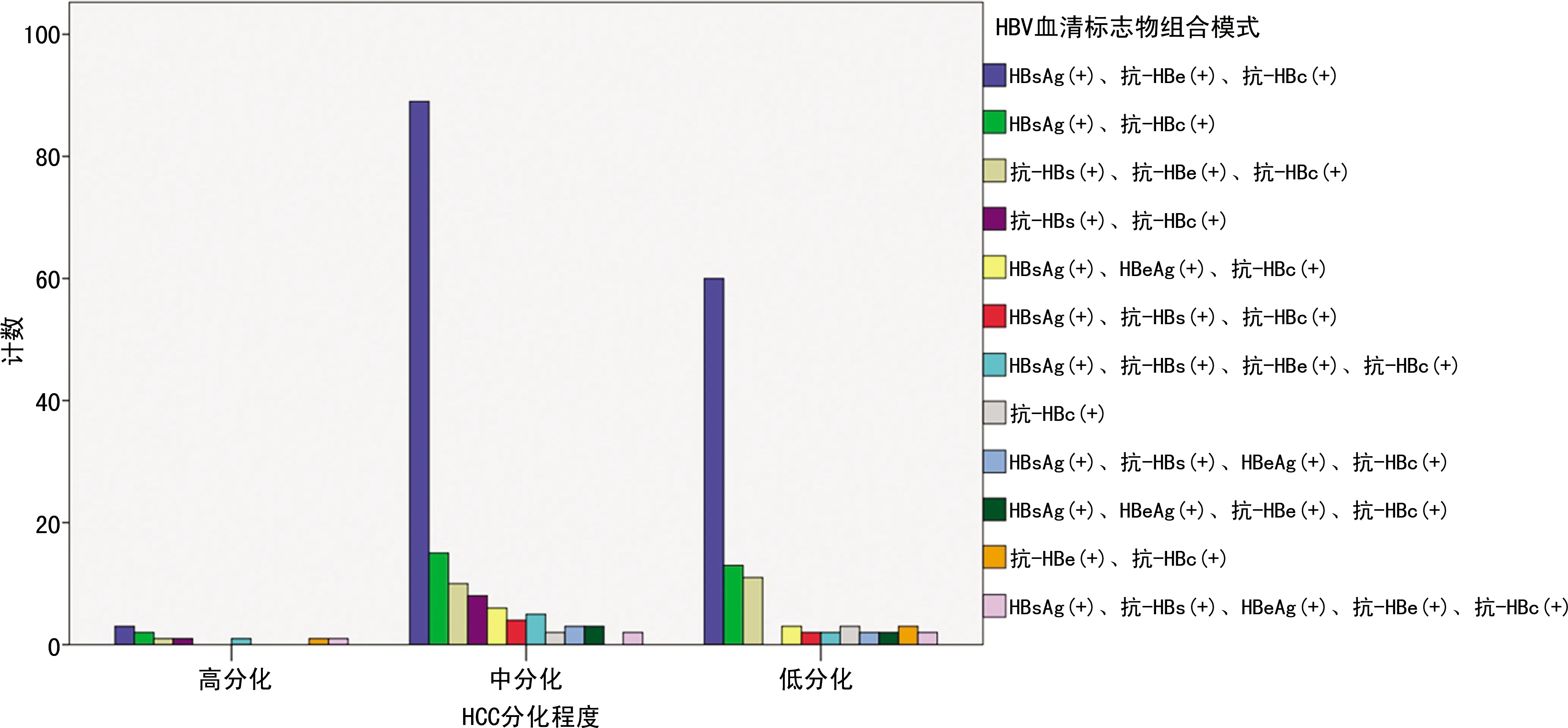
图1 HBV血清标志物组合模式与HCC分化程度
2.2 血清HBsAg与HCC分化程度的相关性
在260例病例资料中,血清HBsAg阳性221例(85.0%),其中属于高分化类型7例(2.7%),中、低分化类型214例(82.3%);血清HBsAg阴性39例(15.0%),属于高分化类型3例(1.2%),中、低分化类型36例(13.8%),HBsAg对HCC高分化和HCC中、低分化的影响差异无统计学意义(χ2=0.366,P>0.05)。进一步通过Pearson相关性分析,r=-0.084,P>0.05。
2.3 HCC组织HBsAg与HCC分化程度的相关性
在260例病例资料中,HCC组织免疫组织化学HBsAg阳性206例(79.2%),其中HCC高分化类型5例(1.9%),中、低分化类型201例(77.3%);HCC组织免疫组织化学HBsAg阴性54例(20.8%),其中HCC高分化类型5例(1.9%),中、低分化类型49例(18.8%),HBsAg对HCC高分化和HCC中、低分化的影响差异有统计学意义(χ2=0.020,P<0.05)。经Pearson相关性分析,r=-0.144,P<0.05。
2.4 血清HBeAg与HCC分化程度的相关性
在260例病例资料中,血清HBeAg阳性19例(7.3%),其中属于HCC高分化类型0例,中、低分化类型19例;HBeAg阴性241例(92.7%),其中属于HCC高分化类型10例,中低分化类型231例,经Fisher确切概率法进行统计检验,HBeAg对HCC高分化和HCC中、低分化的影响差异无统计学意义(P>0.05),经Pearson相关性统计分析,r=-0.056,P>0.05。
2.5 HCC组织HBcAg与HCC分化程度的相关性
在260例病例资料中,HCC组织HBcAg阳性39例(15.0%),其中属于HCC高分化类型2例(0.8%),中低分化类型37例(14.2%);HCC组织HBcAg阴性221例(85.0%),属于HCC高分化类型8例(3.1%),中低分化类型213例(81.9%),HBcAg对HCC高分化和HCC中低分化的影响差异无统计学意义(χ2=1.000,P>0.05)。Pearson相关性统计分析,r=0.028,P>0.05。
3 讨 论
在我国,乙型肝炎为原发性肝癌的主要原因[3],近年来仍呈上升趋势,HBV血清标志物组合模式中,以“小三阳”模式患者更易发生HCC。以往文献认为,乙型肝炎“小三阳”血清组合模式HBV DNA多为变异株,HBV DNA变异与原发性肝癌的发生有关,而且乙型肝炎“小三阳”血清组合模式多为慢性HBV感染;HBV在体内存在多年,HBV DNA可能已与细胞基因组整合,导致细胞基因突变,继而和原发性肝癌的发生有关。近年来的研究表明,HBV的抗原有反式激活作用,通过反式激活细胞基因的表达,调控细胞信号传导通路,进而与原发性肝癌的发生有关。然而,目前文献显示,HBV抗原对肝癌细胞分化影响的研究较少。本研究通过收集病例资料,对其统计分析,探讨HBV的抗原与HCC分化程度的关系。
在本研究中,通过对260例乙型肝炎相关性HCC患者的病例资料进行分析,发现乙型肝炎相关性HCC中“小三阳”血清标志物组合模式有152例(58.5%),其中HCC中、低分化类型有149例(57.3%),虽然目前尚不能说明乙型肝炎“小三阳”血清标志物组合模式和乙型肝炎非“小三阳”血清标志物组合模式对乙型肝炎相关性HCC分化类型有影响,但是可以看出乙型肝炎相关性HCC的发病人群主要HBV血清标志物组合模式为“小三阳”者及乙型肝炎相关性HCC分化类型多为中、低分化的趋势。
本研究发现,乙型肝炎相关性HCC组织中HBsAg阳性与乙型肝炎相关性HCC组织中HBsAg阴性对HCC高分化和中、低分化的影响差异有统计学意义(P<0.05),且乙型肝炎相关性HCC高分化和中、低分化类型与HCC组织HBsAg的存在与否呈负相关(r=-0.144,P<0.05),说明HBsAg在HCC组织的存在可能会影响HCC分化,且HBsAg在肝组织中存在时间越长及存在于肝组织中的水平越高,乙型肝炎相关性HCC的分化程度可能越低。TSENG等[4]的研究表明,在HBeAg阴性且低病毒载量的患者中,HCC的风险取决于HBsAg的水平、丙氨酸氨基转移酶水平和年龄。HBsAg为HBV S基因编码的蛋白,是构成HBV外衣壳的主要成分,也是HBV感染的重要指标。有研究表明,HBsAg是一种转录激活子,可以反式激活多种细胞基因包括癌基因[5],如c-myc、c-fos、c-Ha-ras等,且能激活c-Raf-1/MEK /Erk2信号传导途径[6],从而导致肝细胞恶性转化。SHAN等[7]的研究表明,HBsAg的刺激可促进乙型肝炎相关性肝癌细胞的侵袭。高水平的HBsAg在肝细胞内积累可导致严重的肝损伤,而肝损伤又可以激活Met原癌基因,启动HGF/MET信号传导通路[8],与肝癌的发生密切相关。然而,乙型肝炎相关性HCC患者血清HBsAg阳性和血清HBsAg阴性对HCC高分化和中低分化的影响差异无统计学意义(P>0.05)。HBsAg作为HBV大球形颗粒外衣壳和小球形颗粒及管型颗粒的主要成分,在肝细胞内产生后分泌到细胞外,主要在血清中存在,其在肝细胞中存在时间的长短及水平对肝细胞分化的调控可能起到一定作用。SALPINI等[9]的研究表明,阻止HBsAg的分泌与促进细胞增殖有关。
综上所述,乙型肝炎相关性HCC组织分化程度主要与HCC组织中HBsAg有关。乙型肝炎相关性HCC组织中细胞的增殖和分化程度,可能与HBsAg长期留存于肝组织有关。
HBeAg和HBcAg都是HBV在细胞内复制时产生前基因组3.5 kb mRNA翻译出的重要蛋白[10],且这两种抗原都由HBV C基因区编码[11],都是与HBV的复制过程同步的蛋白,一般将其视为HBV复制的指标,而高病毒载量往往是HCC发生的高危因素[12]。HBcAg为HBV大球形颗粒内衣壳的主要成分,HBcAg在细胞内产生后,可存在于HBV大球形颗粒的内衣壳,也可经内源性抗原提呈途径提呈后表达在肝细胞表面,导致一系列免疫反应,进而与导致的肝损伤有关。HBV C基因区翻译出的HBeAg的前体,经剪切加工后,分泌到肝细胞外,HBeAg主要在血清中存在。侯环荣等[13]的研究表明,HBcAg能促进HepG2.2.15细胞的侵袭力,而在本研究中,目前尚不能说明HCC组织中HBcAg及血清HBeAg的存在对HCC分化程度有影响,另外,与肝损伤有关的HBcAg在肝组织持续存在是否与HCC分化程度有关,有待于进一步研究。

