慢性脑低灌注通过NF-κB通路致大鼠肠黏膜屏障损伤及辛伐他汀的保护作用*
蔺阳刚, 陈 长, 刘 辉, 王庆松
(中国人民解放军西部战区总医院神经内科,四川成都610500)
慢性脑低灌注(chronic cerebral hypoperfusion,CCH)是各种缺血性脑损害的病理生理基础,随着社会老龄化进程的加剧,脑卒中已经成为中国脑血管病患者的首位死亡原因[1]。缺血性脑卒中除了导致卒中后认知障碍外,远隔器官的损伤也很常见,肠道作为全身应激反应的主要器官之一,肠道黏膜屏障功能的损害是其常见的继发反应[2]。肠道黏膜屏障的破坏会导致菌群失调,内毒素移位等诱发炎症反应,这也将进一步加重神经系统的损伤[3],因此肠道黏膜屏障在机体内环境稳态维持与炎症反应调控等功能中都有重要作用。核因子κB(nuclear factorκB,NF-κB)通路是与炎症反应相关的信号通路,研究证实其参与细胞凋亡,炎症等病理生理过程[4]。骨桥蛋白(osteopontin,OPN)又被称为早期T 细胞活化因子,当机体处于应激、炎症和低氧等环境时,OPN 会激活 αvβ3 和 NF-κB 等途径导致炎症反应[5]。辛伐他汀(simvastatin,SV)是神经内科的常用药物之一,其在调节血脂和抗炎等方面都有很好的效果[6],研究表明[7],辛伐他汀可通过抑制肠道上皮NF-κB 通路改善小鼠的急性结肠炎。我们的前期研究揭示了,通过建立CCH 模型来模拟大鼠慢性脑缺血状态,会导致大鼠长达24 周的认知行为受损[8]并伴随回肠黏膜屏障的损伤[9],并且在4 周时,认知行为受损最严重。在使用SV 作为干预后,大鼠的认知行为有了明显的改善[10],但CCH 致大鼠肠黏膜屏障损伤的可能机制及SV 对于肠黏膜屏障是否有改善作用未探讨亦未见相应研究报导。本项工作拟在前期研究基础上,通过观察大鼠回肠黏膜屏障变化以及检测大鼠回肠组织NF-κB 通路相关蛋白和血清炎性因子含量变化,研究CCH 致大鼠回肠黏膜屏障损伤的可能机制;通过SV 作为干预,观察其对大鼠肠黏膜屏障的保护作用。
材料和方法
1 实验动物、主要试剂及仪器
雄性 SPF 级 SD 大鼠 40 只,7 周龄,体重(250±20)g,由重庆医科大学实验动物中心提供,许可证编号为SLXK(渝)2018-0003。购置后于动物房饲养,保持通风良好,12 h明暗交替,大鼠自由进食饮水。
辛伐他汀(大连美仑生物技术有限公司);兔抗大鼠 OPN 抗体(Abcam);兔抗大鼠 claudin-1 抗体(Abcam);兔抗大鼠NF-κB p65 和p-p65 抗体(CST);兔抗大鼠GAPDH 抗体和山羊抗兔II 抗(Proteintech);大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)酶联免疫吸附测定试剂盒(上海江莱生物有限公司)。荧光显微镜(Olympus);电泳槽及转印系统(Bio-Rad)。其他所用药品试剂均为市售分析纯。
2 主要方法
2.1 动物模型建立及给药 40只SD 大鼠按照随机数表法分为 CCH 组(n=10)、假手术(sham)组(n=10)、溶剂对照(solvent control,SC)组(n=10)和SV 组(n=10)。按照课题组前期的文献[8],采用永久性双侧颈总动脉闭塞(bilateral common carotid artery occlusion,BCCAO)法进行 CCH 模型的制备,SC 组和SV 组大鼠与CCH 组大鼠模型制备方法相同。具体方法为:实验大鼠适应性饲养1 周后,开始进行模型制备;术前8 h 禁食,1.5%戊巴比妥钠腹腔注射麻醉,颈部备皮,取颈部正中纵切口,分离一侧颈总动脉血管与周围组织,结扎并离断血管,缝合组织和皮肤后,青霉素注射抗感染;7 d 后,同法结扎离断另一侧颈总动脉。sham 组除不离断血管外,其余操作与CCH 组相同。以10 mg 辛伐他汀∶1 mL 0.5%羧甲基纤维素钠溶液的比例配制混悬液,术后第1 天开始,SV 组大鼠按照2 mL/kg 用混悬液灌胃,SC 组按照2 mL/kg 用0.5%羧甲基纤维素钠灌胃,连续4 周。CCH组和sham组大鼠不做给药处理。
2.2 标本取材 造模结束4 周后进行大鼠回肠组织取材。1.5%戊巴比妥钠腹腔注射麻醉,将大鼠固定,打开胸腔充分暴露心脏,心尖取血4 mL。血液样本4 ℃、1 000×g离心15 min,取上层血清-80 ℃保存待测。沿腹正中线打开腹腔,于距回盲部5 cm 处取回肠组织约1 cm,生理盐水冲洗后,-80 ℃保存用于进行免疫蛋白印迹实验。另取回肠组织1 cm,冲洗干净后4%多聚甲醛固定,石蜡包埋用于HE 染色及免疫荧光染色。
2.3 回肠组织组织形态学检测 回肠石蜡标本切片后脱蜡,苏木精染色,分色后伊红染色。光镜下观察回肠组织的形态学变化,截取十个随机视野使用Chiu肠黏膜损伤评分[11]进行评估,评分标准:1分,肠道绒毛正常;2分,绒毛顶端黏膜下出现间隙,毛细血管充血;3 分,间隙扩大,肠黏膜也黏膜下层分离;4分,肠道绒毛两侧出现间隙;5 分,肠道绒毛变钝,固有层暴露,炎症组织浸润;6 分,固有层消失,有出血或溃疡)。取平均值为该标本的最终损伤评分。
2.4 回肠组织免疫荧光检测大鼠回肠组织claudin-1 表达量 回肠石蜡标本切片脱蜡,用0.01 mol/L 枸橼酸钠缓冲液进行抗原修复,PBST 洗3 次,每次5 min,室温封闭30 min,滴加claudin-1 Ⅰ抗,37 ℃孵育1 h,PBST 洗3 次,每次5min,滴加Ⅱ抗,室温避光孵育 1 h,PBST 洗 3 次,每次5min,DAPI 染色 10 min,PBST洗3次,每次5 min后封片,用荧光显微镜观察,截取3 个随机视野Image-Pro Plus 6.0 测量积分吸光度(IA),取平均值为标本的最终IA值。
2.5 Western blot 检测大鼠回肠组织 OPN、NF-κB p65及p-p65蛋白水平 取回肠组织解冻后用全蛋白提取试剂盒提取蛋白,BCA 蛋白定量后,用10%SDS-PAGE 分离。PVDF 膜转膜,5%脱脂奶粉和BSA 封闭 1 h,OPN 抗体(1∶1 000)、NF-κB p65 抗体(1∶2 000)和p-p65 抗体(1∶2 000)4 ℃孵育过夜。次日摇床复温1 h 后,TBST 洗涤条带3 次,每次10 min,室温下加入Ⅱ抗(1∶5 000)孵育1 h,洗涤条等3次后进行化学发光显影。
2.6 ELISA检测大鼠血清TNF-α和IL-6水平 将试剂盒和样本平衡至室温后,严格按照试剂盒说明书进行实验操作。检测重复3次。
3 统计学处理
使用SPSS 20.0 对实验数据进行统计分析。正态分布的计数资料采用均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),多重比较采用LSD 法。以P<0.05 为差异有统计学意义。
结 果
1 回肠组织病理学改变
与sham组比较,CCH组与SC组大鼠回肠黏膜绒毛结构破坏更加严重,绒毛变粗变钝变短,基底层失去完整性,Chiu病理评分显著升高(P<0.05);与CCH组和SC组比较,SV组大鼠回肠黏膜绒毛结构有一定程度的恢复,绒毛呈指状排列,Chiu 病理评分显著降低(P<0.05);sham组与SV组、CCH组与SC组间Chiu病理评分未见显著差异(P>0.05),见图1及表1。
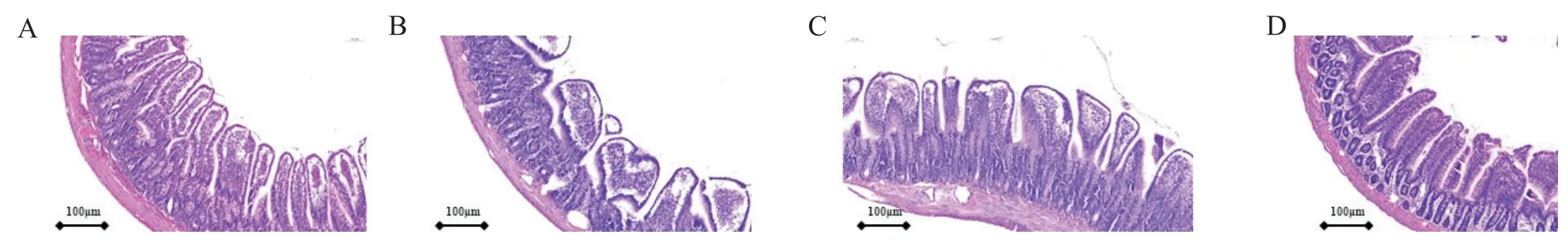
Figure 1.HE staining results of ileum tissue(scale bar=100 μm).A:sham group;B:CCH group;C:SC group;D:SV group.图1 回肠组织HE染色结果

表1 回肠组织Chiu病理评分Table 1.Chiu pathological score of ileum(Mean±SD. n=10)
2 大鼠回肠组织claudin-1表达量的变化
与sham组比较,CCH组与SC组大鼠回肠黏膜绒毛细胞间 claudin-1 表达量显著降低(P<0.05);与CCH组和SC组比较,SV组大鼠回肠黏膜绒毛细胞间claudin-1 表达量显著升高(P<0.05);sham 组与 SV组、CCH 组与SC 组间回肠黏膜绒毛细胞间claudin-1表达量未见显著差异(P>0.05),见图2及表2。

Figure 2.Immunofluorescence staining of claudin-1 in the ileum tissue.A:sham group;B:CCH group;C:SC group;D:SV group.图2 回肠组织claudin-1免疫荧光染色结果
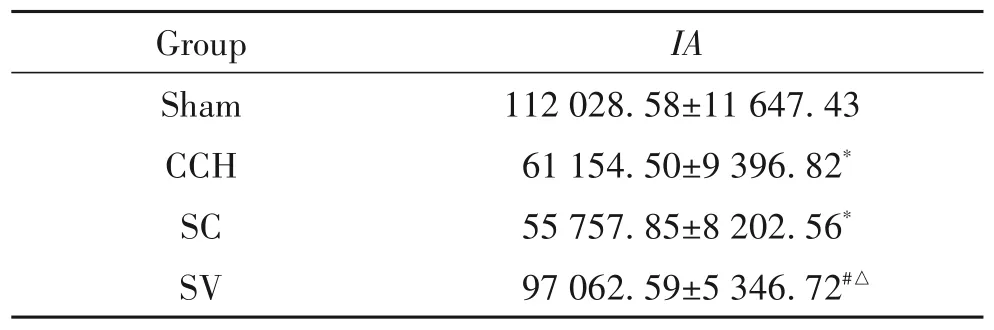
表2 大鼠回肠组织claudin-1免疫荧光IA值Table 2. IA value of claudin-1 immunofluorescence in rat ileum tissues(Mean±SD. n=10)
3 回肠组织OPN 和NF-κB 通路相关蛋白表达的变化
与sham 组比较,CCH 组和SC 组大鼠回肠组织OPN 表达量显著增加(P<0.05),p-p65/p65 比值显著升高(P<0.05);与CCH 组和SC 组比较,SV 组大鼠回肠组织OPN 表达量显著降低(P<0.05),p-p65/p65 比值显著降低(P<0.05);sham 组与SV 组、CCH 组与SC组间OPN 表达量及p-p65/p65 比值的差异无统计学显著性(P>0.05);各组大鼠回肠组织NF-κB 表达量的差异无统计学显著性(P>0.05),见图3及表3。

Figure 3.Changes in the expression of OPN and NF-κB pathway-related proteins in ileum.图3 回肠组织OPN和NF-κB通路相关蛋白表达的变化

表3 各组大鼠回肠组织OPN及NF-κB通路相关蛋白表达Table 3.The expression of OPN and NF-κB pathway-related proteins in rat ileum tissues(Mean±SD. n=10)
4 大鼠血清TNF-α及IL-6含量的变化
与 sham 组比较,CCH 组和 SC 组大鼠血清 TNF-α与IL-6含量显著增加(P<0.05);与CCH组和SC组大鼠比较,SV 组大鼠血清 TNF-α 与 IL-6 含量显著降低(P<0.05);sham 组与 SV 组、CCH 组与 SC 组间血清TNF-α 和 IL-6 含量的差异无统计学显著性(P>0.05),见表4。
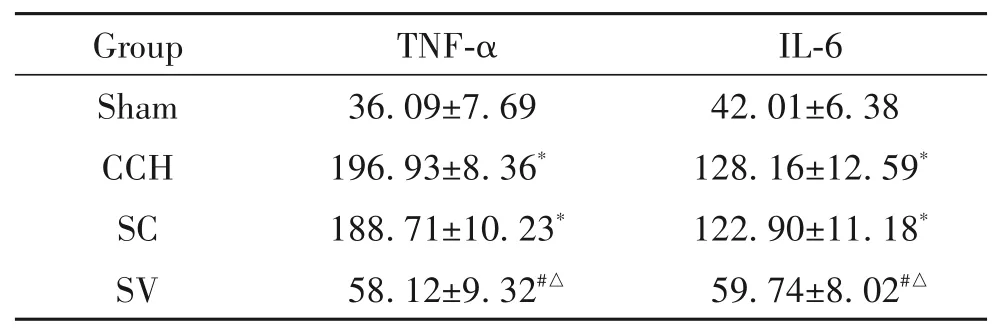
表4 各组大鼠血清TNF-α及IL-6含量Table 4.Serum TNF-α and IL-6 levels of the rats in each group(ng/L.Mean±SD. n=10)
讨 论
随着人口老龄化等因素的影响,脑卒中已经成为全球第二、中国首位的死亡原因[12]。CCH 导致的慢性脑缺血状态是缺血性脑卒中的病理生理基础,也是各种血管性痴呆的重要发病原因。有研究发现[13],缺血性脑卒中后,机体会因处于应激状态出现腹泻,便秘,溃疡和胃肠道出血等一系列的消化系统并发症。Tascilar 等[14]的实验表明,当缺血性卒中发生后,机体的肠道黏膜组织受损,导致菌群移位,细菌内毒素进入机体,导致消化系统的防御能力变得脆弱,也使其他系统的病变更加严重。课题组前期实验说明[9],CCH 会导致大鼠长达 24 周的回肠黏膜屏障受损以及肠黏膜细胞间紧密连接蛋白claudin-3的表达降低。肠黏膜屏障分为化学屏障,生物屏障,免疫屏障和机械屏障,其中机械屏障是肠黏膜屏障发挥防御功能的基础[15]。紧密连接蛋白以黏附方式存在于细胞之间,是组成机械屏障的分子基础。作为紧密连接蛋白家族中最具有代表性的亚型之一,claudin-1 在人和大鼠的肠道上皮中均有表达。Iraha等[16]的研究结果表明,使用药物增加claudin-1 的表达后,肠道黏膜的屏障功能明显增强,因此可以通过claudin-1 的表达量作为评价肠道黏膜屏障功能的指标。本研究结果揭示,与sham 组比较,CCH 组大鼠回肠组织形态学结构显著受损,回肠黏膜上皮间claudin-1 表达量显著降低。这与课题组前期实验结果相符,说明CCH会导致大鼠肠黏膜屏障的损伤。
NF-κB 是细胞内重要的核转录因子,它参与机体的免疫应答,炎症反应,应激反应和细胞凋亡等病理生理过程[17]。NF-κB 通路激活后,会导致下游细胞产生大量炎症因子,如TNF-α 和IL-6 等,这些炎症因子的增加会活化NF-κB 导致炎症级联反应,加重炎症的损害[18]。p65作为NF-κB的一个亚基,细胞在静息状态下,由于抑制性蛋白 IκB 的存在,NF-κB 蛋白二聚体处于失活状态,在氧化应激或者炎症反应条件下,会被磷酸化激活,NF-κB p65活化为p-p65并移至细胞核内,激活通路下游一系列生理反应,导致白细胞浸润,进一步调节炎性细胞释放TNF-α 和IL-6 等炎症因子[19],因此 p-p65/p65 比值可以用来判断NF-κB 信号通路的活化程度。OPN 作为一种机体反应性蛋白,在一般情况下表达量非常低。Ito 等[20]的研究表明,OPN 会激活 αvβ3 和 NF-κB 途径上调基质金属蛋白酶9 的含量,引发机体的炎症反应。研究表明,敲除OPN 后大鼠的炎症介质和细胞因子形成受到抑制,与使用NF-κB 抑制剂的作用相似[21],并且OPN 可能通过NF-κB 信号转导通路参与了骨关节炎的发生与发展[22]。有研究表明[23],在 IBD 动物模型下,通过促进NF-κB p65 的核转位,实验者观察到通路下游炎症因子IL-6 表达量升高,并且引起肠黏膜上皮紧密连接蛋白ZO-1 表达量降低,加重实验动物炎症性肠病的发生和发展。本研究结果表明,与SHAM 组比较,CCH 组大鼠回肠组织结构显著受损,肠黏膜上皮claudin-1 表达量降低,回肠组织OPN 表达量和 p-p65/p65 比值升高,血清 TNF-α 和 IL-6 含量升高。p-p65/p65 比值升高说明NF-κB 通路被激活,导致下游的炎性细胞释放大量炎症因子,而这些炎症因子又可以正反馈增强NF-κB 的活化,出现炎症因子“瀑布样”效应,从而加重回肠黏膜屏障的损伤。
SV 作为 3-羟基-3-甲基-戊二酰辅酶 A 还原酶抑制剂,对心脑血管系统有多种有益作用。本课题组前期实验表明,SV 可以减轻CCH 大鼠的认知行为障碍[10];Zhao 等[24]的研究说明,在烧伤模型中,SV 可通过抑制NF-κB通路减少实验动物的脾细胞凋亡;Han等[25]的实验研究表明,SV 可通过抑制 NF-κB 通路来抑制糖尿病大鼠的心肌肥大;Lee 等[7]的研究表明,SV 可以通过抑制肠道上皮NF-κB 通路减轻小鼠急性结肠炎。以上研究结果表明,SV 可以通过抑制NF-κB 信号通路的激活来调控细胞凋亡和炎症反应。本研究结果表明,与CCH 组和SC 组比较,SV 组大鼠回肠组织结构损伤显著减轻,肠黏膜上皮claudin-1表达量升高,回肠组织OPN 表达量和p-p65/p65比值降低,血清TNF-α 和IL-6 含量降低,说明辛伐他汀对CCH 损伤的大鼠肠黏膜屏障有保护作用,并且进一步说明CCH致大鼠肠黏膜屏障损伤可能是由于NF-κB通路激活所致。
综上所述,CCH 会导致大鼠肠黏膜屏障损伤,可能与通过激活肠道NF-κB 通路导致炎症因子TNF-α和IL-6 表达含量升高有关;SV 对CCH 损伤的肠黏膜屏障有保护作用。这可能为研究慢性脑缺血相关肠道功能损伤提供新的切入点,并且为CCH 所致的认知功能障碍及肠道功能损伤的预防和治疗提供参考资料。

