MRI引导下乳腺病灶导丝定位活检术的临床应用
宋颖,欧阳汉,叶枫,车树楠,李静,周纯武
目前乳腺MRI已广泛运用于乳腺癌诊断、评估、疗效监测等方面,并被美国和欧洲的相关指南推荐作为乳腺X线摄影和超声的补充检查手段,具有较高的敏感度(78%~98%),可发现临床触诊及乳腺X线摄影、超声不能检出的病灶,但特异度相对不高(43%~75%)[1]。尽管部分MR发现的病灶可由第二眼超声检出,且在超声导引下穿刺操作方便、费用低廉,但既往文献报道第二眼超声仅能显示约一半(57.5 %)的MR发现的可疑病灶,而其未能检出的病灶约12.2 %为恶性肿瘤[2]。因此,国外指南将MR导引的穿刺—包括活检和定位作为乳腺MR检查的一项常规和必须具备的技术,且活检大大超过MR导引下的定位手术切除活检[3]。在我国,此项技术的开展尚处于试验阶段,缺乏标准化的操作规程,磁场环境和介入操作设备的制约及高成本是限制其应用的主要原因。现将我院MR引导下乳腺病灶定位经验总结如下。
1 材料与方法
1.1 临床资料
回顾性分析本院2013年11月至2019年12月期间行MR引导下乳腺病灶导丝定位手术活检病例。入组标准:①术前MRI按照美国放射学会乳腺影像和报告数据系统(br east imaging r epor t and dat a syst em,BI-RADS)[4]病灶分类在4类或4类以上,或BI-RADS 3类病灶患者强烈要求手术切除活检;②临床触诊、乳腺X线和超声检查均未能发现此可疑病灶,或不能确定发现的病灶是否与MRI所示一致,行X线或超声引导下定位有困难。选择手术当日术前行MR引导下定位[5]。本研究经本院医学伦理委员会批准(批准文号:2021042810465502)。患者及其家属均知情同意,并签署知情同意书。
1.2 操作设备及方法
采用美国GE Signa HDx 1.5 T磁共振扫描仪,定制的MR活检穿刺定位架,日本八光公司的EV导管针(EV-19 G×90.0 mm),美国巴德公司的定位针(LW0107,20 G×10.7 cm),MRI后处理工 作 站CADSTREAMTM系 统(ver sion 5.2 ,Mer ge CAD Inc.,Bel l evue,WA,USA)。
定位实施前在常规MRI上核实病灶的具体位置[6]。消毒患者进针侧皮肤及带有网格的特殊压迫板。定位时患者俯卧于8通道乳腺相控阵线圈上,用网格压迫板从外侧或内侧压迫患侧乳房的进针侧,一个内角呈150°蝶形压迫板从对侧压迫患侧乳房。将欲定位的部位尽可能放在网格压迫板的中心位置,并保证乳房表面皮肤平整。压迫力度以乳房皮肤有一定张力,同时患者可以耐受为准。将灌有对比剂的定位标记放置于压迫板上的网格内,作为定位时的参照点。应用并行采集的乳腺容积成像(vol ume imaging f or br east assessment,VIBRANT)序列行横断面扫描,TR 3.8 ms,TE 1.8 ms,层厚2.0 mm,无间隔扫描,矩阵512×512,FOV 34 cm×34 cm。注射对比剂前先采集一期平扫图像,初步观察目标病灶是否在网格压迫板的范围内,如未在压迫板的范围内需解除压迫调整位置[7]。对比剂为Gd-DTPA,剂量0.2 mmol/kg,注射流率为2.0 mL/s,注射完毕后追加20 mL生理盐水推注。注射对比剂15 s后开始增强扫描,连续无间隔重复扫描,每期扫描时间50~60 s,对照常规MRI上的可疑病灶处,观察局部是否强化,见强化即停止扫描。将图像传送到后处理工作站,在工作站MR图像上确认病灶及参照点的所在位置,通过计算机计算直接得出相应的进针网格、孔道和深度。部分病灶因增强前T1WI抑脂图像上病灶局部可见高信号,定位时未行增强扫描。
根据计算机所给出的位置在网格内置入带有6×6孔道的穿刺针针导,根据指定的进针孔道和深度进导管针,退出导管鞘内的金属针,留置塑料导管鞘在患者乳房内,再次MR扫描,以导管鞘顶端位于病灶内为定位到位(图1);如导管鞘偏离预定目标超过5 mm,需退出导管重新定位[8]。将带套管的双钩定位针插入导管鞘至顶端,退出导管鞘和定位针外的套管,留置双钩导丝在乳房内,最后将导丝外露部分固定于皮肤。因定位的目标病灶乳腺X线摄影不能够显示,同时为减少导丝移位的可能性,定位后未拍摄乳腺X线图像。
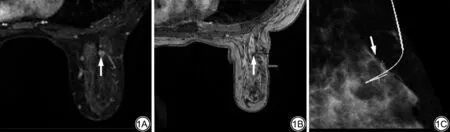
图1 女性,47岁,体检发现左侧乳腺钙化。A:MRI横断面显示右侧乳腺不均匀强化结节(箭)。B:放置导管后扫描提示塑料导管鞘末端位于病灶边缘(箭),术后病理为导管原位癌。C:左侧乳腺细小钙化,X线引导下放置导丝定位(箭),术后病理为腺病
1.3 影像特征及定位操作记录
记录定位前MRI图像上病灶的位置、大小、影像特征及操作时间。病变的位置分为前部或乳头下、后部、浅表(距离皮肤表面2 cm内)或中央部。根据BI-RADS将病灶分为肿块、非肿块强化和点状强化,记录肿块的形状、边缘、内部强化特征,非肿块强化的分布及内部强化特征,并记录所有病灶的时间信号强度曲线。操作时间指第一次扫描MRI三平面定位图像开始至放置塑料导管鞘后采集的最后一幅MR图像所用的时间。本研究中连续资料不服从正态分布,组间比较采用秩和检验。采用χ2检验和Fisher精确检验比较良恶性病灶间的影像特征。如果组间差异有统计学意义,进一步的两两比较采用Bonf err oni法。所有统计分析均采用SPSS 21.0 软件实现,组间比较以双侧P<0.0 5认为差异有统计学意义,χ2检验的两两比较以P<0.0 5/4=0.0 125认为差异有统计学意义。
2 结果
2.1 纳入患者
共133例符合纳入条件,均为女性,年龄29~77岁,中位年龄49.5 岁。其中34例活检已经确诊患有浸润性乳腺癌(包括穿刺活检32例,手术切除活检2例),行MR检查进行分期偶然发现乳房内其他可疑病灶(包括同侧乳房病灶6例,对侧乳房病灶28例);12例为腋窝肿大淋巴结活检提示转移性癌,临床怀疑隐匿性乳腺癌;1例为新辅助化疗后拟行保乳手术治疗;4例为既往乳腺癌患者随诊检出新发可疑病灶,24例为临床有轻微症状(乳房疼痛、扪及局部增厚或乳头溢液、凹陷),其余58例为体检偶然发现。上述患者MRI检查共发现136个病灶,其中134个病灶术前评估为BI-RADS 4类,术前评估为BI-RADS 3类及BI-RADS 5类各1个。
2.2 定位操作完成情况
6例(4.5 %,6/133)取消了定位,其中5例(3.7 %,5/133)因定位时未发现相应的强化病灶;1例因乳房小同时病灶位于外侧腺体边缘后部,经多次尝试无法将病灶摆位到定位野内。最终共有127例130个病灶进行定位(有3例同侧乳腺双病灶同时定位)。54例病灶位于乳腺内侧部分,49例位于外侧部分,24例位于中央区或乳腺正上/下方;其中5例从乳腺内侧进针(图2),其余122例均从外侧进针。130个病灶中有8个位于乳晕下区,30个位于腺体后部,32个位于乳腺浅表位置,60个位于乳腺中心。经反复摆位调整最终完成定位的病灶共15个,其中8个位于腺体后部,1个接近乳头,2个位于乳腺中心,4个位于浅表位置;其余病灶均一次摆位成功。2例患者(2/127,1.6 %)在定位后出现血管迷走神经反应,平卧休息后症状消失;其余患者无并发症出现。
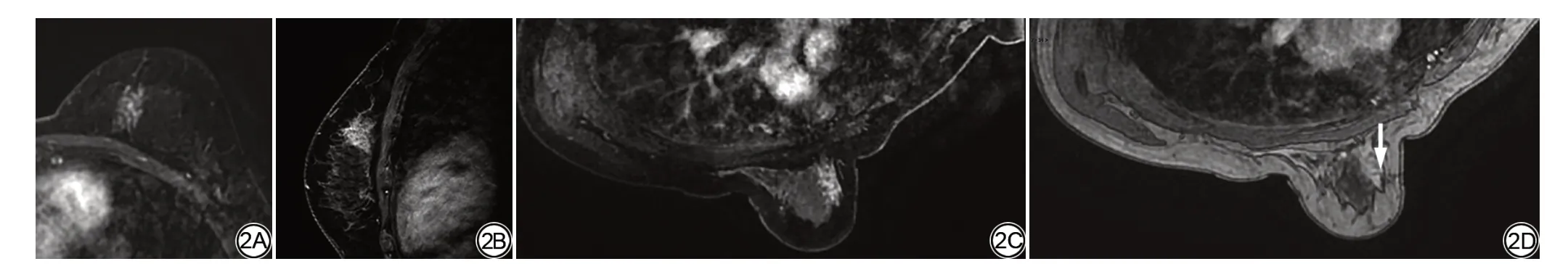
图2 女性,39岁,发现左乳外上象限结节1月。A、B:增强MRI横断面及矢状面提示左侧乳腺内上象限非肿块强化,内部强化不均匀。C、D:采用侧斜俯卧位,将患者左侧乳房移到对侧乳腺检查线圈窗内行MRI引导的导丝定位(箭)。术后病理为乳腺腺病。
定位操作时间为(24±8)min(4~49 min)。其中6例单病灶常规MRI增强前T1WI抑脂图像上病灶局部可见高信号,定位时未行增强扫描,操作时间为(22±12)min(4~35 min)。121例增强扫描后进行定位,其中单病灶操作时间(24±8)min(11~49 min),3例一侧乳腺双病灶操作时间分别为36、31、26 min。
2.3 病理结果
70个病灶位于左乳,60个位于右乳。129个初诊病灶中,术后石蜡病理诊断恶性肿瘤52个(40.3 %,52/129),高危病变(不典型导管增生)6个(4.7 %,6/129),其他良性病变71个(55.0 %,71/129)。在31例MR检查前已确诊乳腺癌患者中,定位病灶32个,共发现恶性病灶11个(34.4%,11/32),包括乳腺导管原位癌8个(25.0 %,8/32)、浸润性导管癌2个(6.3 %,2/32)、导管内乳头状癌1个(3.1%,1/32),其中位于对侧乳腺癌灶10个,同侧不同象限乳腺癌灶1个。11例临床隐匿性乳腺癌患者其中1例乳腺MR可疑恶性病灶病理为乳腺腺病(1/11),其余均为乳腺癌(10/11),包括低级别导管内癌1个、高级别导管内癌伴小灶间质浸润2个、非特殊型浸润性癌6个、神经内分泌癌1个。一个新辅助化疗后病灶行右侧乳腺保乳术,术后病理为非特殊型浸润性癌伴导管内癌,轻度化疗后反应。详见表1。
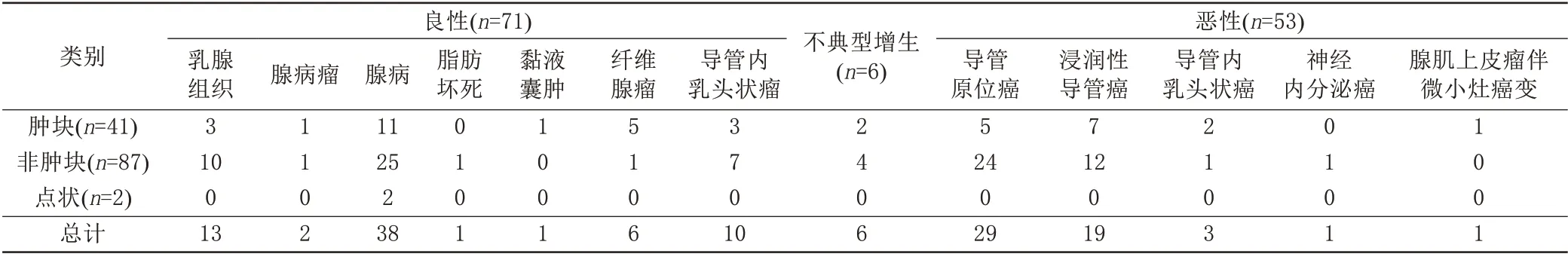
表1 MRI引导下导丝定位的病理结果
2.4 病灶影像特征
2.4 .1 强化形态
除1个新辅助化疗后病灶表现为肿块样强化外,129个初诊病灶在MRI上呈肿块强化40个(31.0%,40/129),非肿块强化87个(67.4 %,87/129),点状强化2个(1.6 %,2/129);病灶的强化形态在良恶性疾病间没有显著性差异(P=0.3 99)。呈肿块强化的初诊病灶较小,长径5~18(9±3)mm,中间值8 mm;包括恶性肿瘤14个(35%,14/40),良性疾病26个(65%,26/40);肿块边缘特征和内部强化方式在良恶性病变中具有显著性差异(P边缘特征=0.0 02,P内部强化方式=0.0 30),对内部强化方式进一步进行两两比较发现内部强化是否均匀可能对良恶性病变的鉴别有一定帮助(P=0.0 14)。非肿块样强化的初诊病灶较大,长径5~55(20±11)mm,中间值17 mm;包括恶性肿瘤38个(43.7 %,38/87),良性疾病49个(56.3 %,49/87);表现为非肿块强化的恶性肿瘤以导管原位癌(63.2%,24/38)居多。非肿块强化的大小、分布及内部强化特征在良恶性病变中具有显著性差异(P长径=0.0 18,P强化分布=0.0 01,P内部强化特征<0.0 01)。段样强化多出现于恶性病灶中(75%,12/16),而局灶强化多见于良性病灶(68.2 %,30/44),6个区域性强化灶病理结果均为良性;与局灶和区域性分布的强化相比,段样分布的病灶高度提示恶性(P值分别为0.0 04、0.0 03)。4个表现为段样强化的良性病灶包括2个导管内乳头状瘤和2个腺病。所有强化均匀的非肿块强化病灶术后病理均为良性,与其他类型的内部强化特征间的差异具有显著性意义(P<0.0 125)。两个点状强化病灶最大径均为4 mm,术后病理均为腺病。所有初诊病灶长径4~55(16±11)mm,相对良性病灶而言,恶性病灶的长径较大(P=0.0 02)。
2.4 .2 动态增强特征
129个初诊病灶中,动态多期增强扫描早期呈速升型强化者共121个(93.8%,121/129),其中延迟期呈持续型者以良性病灶居多(75.7 %,28/37),呈流出型者以恶性病灶居多(61.1 %,22/36),两者差异具有统计学意义(P=0.0 01)。共16个病灶表现离心性强化,其中2个为导管原位癌,2个为纤维腺瘤,其余12个病灶为腺病、乳腺组织或脂肪坏死(P=0.0 15)。
2.5 随访
所有病例的影像学表现与定位切除的病理结果一致。130个病灶中有25个因定位侧乳腺切除而无需随访,共有57个病灶可获得本院影像学随访资料(54.3%,57/105),48个病灶失随。影像随访时间为1~68个月,中位随访时间为17个月。7个良性病变(9.1%,7/77)和9个恶性病变(17%,9/53)共16个病灶术后进行了MRI复查(15.2 %,16/105),发现3个病灶未完整切除,随访时间分别为7、15、16个月,病灶无变化;其余13个病灶完整切除(81.3 %,13/16)。27个良性病变(35.1 %,27/77)和13个恶性病变(24.5 %,13/53)共40个病灶术后进行了超声或超声加乳腺X线摄影复查(38.1 %,40/105),其中1例随访32个月时在同侧乳腺同象限的位置超声检查发现乳腺癌,行乳腺单纯切除加前哨淋巴结活检术,病理提示为非特殊型浸润性癌,肿瘤最大径12 mm。1个恶性病灶行保乳术后仅CT复查(1%,1/105)。
3 讨论
3.1 适应证
美国放射协会和欧洲乳腺影像协会都已将乳腺MRI导引的定位和活检纳入了乳腺MR检查的指南中[9-10]。适应的人群是乳腺MRI发现可疑病灶,且临床触诊和常规影像技术如乳腺X线检查和超声均不能发现异常的患者,这个可疑病灶必须行再次超声靶病灶扫查,仍不能发现确定对应的异常才能纳入,其原因为MRI引导的定位或活检价格昂贵,操作相对繁琐且须应用对比剂,增加了发生对比剂不良反应的风险。本研究中纳入的患者符合以上条件。相对于MRI引导下的活检枪活检,导丝定位后的手术切检取材更加充分,同时可适当降低对定位精确度的要求。另外,在我国,大部分乳腺疾病患者对病情的担忧远过于对外观的重视,且MRI活检为自费项目,费用昂贵,因此更倾向选择外科手术切除活检[11],如手术切检冰冻病理结果为恶性肿瘤,可一期进行根治手术。
在决定进行MRI引导下活检前应对患者乳腺病灶进行多学科讨论,包括乳腺外科、放射科、超声科,对MRI发现的额外异常病变进行综合评估。常规的乳腺MRI检查为俯卧位采集图像,超声则通常在仰卧位进行扫查,而乳腺组织具有高度可移动性,体位的变化会导致乳腺组织发生形变,从而造成乳腺组织空间位移及病灶错位,乳房越大、脂肪成分比例越高,病灶的位移越大[12]。此时,多学科讨论确定MRI引导的定位目标至为重要,尤其当乳腺内存在的多个病灶时,更需要根据两种影像检查上病灶的形态及病灶与乳头、皮肤、胸壁的相对位置进行综合判断。超声与MRI融合虚拟导航技术是近年来的研究热点,与第二眼超声相比可显著提高病灶的检出率,但技术尚未成熟,且其对非肿块强化病灶的检出效能存在争议[13-15]。
3.2 技术可行性
MRI引导下导丝定位技术主要分为三大类:徒手操作、外部格栅系统及支柱系统,其中以笔者使用的外部格栅系统应用较多。定位所使用的定位针及导丝国外基本上采用MR完全兼容的产品,放置定位针后图像可有直径约8 mm的伪影[8],因而可能会掩盖小的病灶。笔者团队采用的定位针及导丝为纯不锈钢材质,MR扫描会产生较大的金属伪影,故而在放置定位针前先放置一塑料导管鞘,确认塑料导管鞘到达病变位置后再放置金属定位针,可减少小病灶被MR兼容定位针产生的伪影掩盖的可能,但缺点是释放导丝后不能再次进行扫描[16]。
目前乳腺MRI诊断主要基于多期动态增强扫描序列,拟定位的目标一般为可疑恶性的异常强化灶,因此定位时一般需再次注射钆类对比剂方能确定目标病灶的存在及其位置。定位前应再次确认患者是否有钆类对比剂过敏史和其他禁忌证。如常规MRI上增强前平扫图像上病灶内或边缘可见明确的高信号,且乳腺内没有与该高信号类似的其他异常信号,定位时可以将该异常高信号作为病灶标志,不再注射对比剂。有文献报道可在DWI图像引导下进行活检定位,但仅适合较大的表现为肿块强化的病灶[17]。
3.3 病灶影像特征分析
由于MRI引导定位的目标是一类临床体检和其他常规影像技术均不能发现的病灶,本研究中病灶相对较小,且病灶呈肿块样强化时较非肿块样强化的病灶更小,与文献报道基本一致[16,18-19]。尽管良恶性病灶的MRI表现有重叠,但对于表现为段样分布的非肿块强化,尤其是内部表现集簇状的强化,要给予高度的重视。Gao等[18]发现该团队所行MRI引导的导丝定位活检中点状强化的恶性率高(9/10),这可能与其定位的恶性点状强化病灶均位于有已知乳腺癌的同侧乳腺有关。而本研究中仅有2个病灶表现为点状强化,1例为近期诊断对侧乳腺癌患者,1例为体检发现病灶患者,术前MRI报告BI-RADS分类为3类,应患者强烈要求而行导丝定位后手术切检,病理全部为良性,提示在没有既往影像资料比较的情况下,表现点状强化侧的乳腺如果没有明确的乳腺癌,则该点状强化可短期内随访。
3.4 定位注意事项
3.4 .1 扫描前仔细复阅常规MRI图像,尽快完成定位操作
相对于常规的X线立体定位和超声导引下定位,MRI导引的定位耗时更长。根据笔者的经验,虽然背景强化随时间延长逐渐明显,可造成病灶与背景间的对比消失,但在大部分情况下这种现象对导丝定位的影响较小,可以根据病灶所在图像层面、坐标及周围的解剖特征来判断定位是否到位,这就需要医师在定位前熟悉病灶的部位、特征及其周围解剖标志。尽管如此,注入对比剂后仍应用最短时间发现目标病灶,尽快完成操作,降低因为患者不适而导致定位失败的可能性。
3.4 .2 摆位困难者的处理
本研究中共15个病灶经两次以上摆位最终完成定位,其中8个病灶位于腺体后部,技巧就是尽可能将预定位的乳房侧往下垂,必要时可以通过旋转身体同时垫高病变的乳房对侧面来完成摆位;1个位于腺体后部的病灶最终定位在病灶的前方5 mm处,定位后在图像中进行详细标注,告知临床医师定位针与病灶的关系,以保证病灶被切除。本研究中1个接近乳头的病灶压迫后局部乳腺组织过薄,通过手法旋转乳腺组织并在同一乳腺的对侧面放置软垫,增加局部厚度以方便定位[20]。仅1例因摆位困难而取消定位,该病灶位于外侧腺体边缘后部,同时乳房过小、纤维腺体组织丰富,经多次尝试无法将病灶摆位到定位野内。部分位于乳腺内侧且接近皮肤的病灶,从外侧进针距离过远,此种情况可从内侧进针,具体方法是采用侧斜卧位,将定位侧乳腺移到对侧乳腺检查线圈内,使病灶靠近线圈窗外侧,以方便操作。此种方法对于身材比较瘦小者容易进行,而对于肥胖患者,检查床可能难以进入MR检查架内。本组一例未完整切除者病灶位于乳腺内下象限近皮肤处,因体型原因难以从内侧进针,事后分析未完整切除的原因可能与进针路径过长及后述的手风琴效应有关。
3.4 .3 双病灶的处理
同侧乳腺双病灶定位可行,方法是同时选定2个病灶的穿刺点,同时置入导管针后扫描确认。本研究中3例用单剂量对比剂完成了同乳双病灶的定位。对于双乳的病灶,本院设备目前尚不能做到同时定位。
3.4 .4 适当的乳腺压迫
与X线引导下的乳腺三维立体导丝定位类似,MRI引导下的导丝定位也受到手风琴效应的影响。手风琴效应是指乳腺在被压迫板压缩的过程中,相距较远的结构会相互靠近,而在松开压迫时相距较近的结构会彼此分离[21]。由于释放导丝后方能松开压迫板,手风琴效应难以避免,在深度方向上即进针方向上的任何误差都有可能被夸大。为了尽可能减轻手风琴效应的影响,需要选择适中的乳腺压迫力度,即能够保证定位穿刺全程中乳腺能够被可靠固定的最小力度。另外,过度的压迫可能减弱乳腺的血供从而影响病变的观测,同时可能引起患者严重的不适感导致其不能配合完成定位操作。
3.4.5 定位后注意事项
尽管安排导丝定位在手术当天进行,但通常定位操作与手术时间相隔至少数小时,在这段时间内导丝有可能发生移位,因此定位后应采用医用胶布将导丝固定于皮肤,并嘱患者减少上肢活动,以减少导丝移位的可能性[22]。
3.4.6 定位当日消失病灶的处理
MRI引导的活检可能会被取消,据报道活检取消率在8%~17%,大多数原因为手术当日拟定位目标消失[23-24]。对于此种情况,尽管病灶为恶性的可能性很小,但为避免恶性肿瘤的遗漏,建议在6个月后再行MRI检查。本研究中有5例(5/133,3.7 %)由于在定位当天病灶消失,未成功进行定位,但该比例低于既往报道,至今未发现恶性乳腺肿瘤。
总之,与传统手术相比较,对仅MRI显示的乳腺病灶,MRI引导下的导丝定位手术切检是一项并发症少且可靠、安全的技术手段,患者耐受良好,并可获取更多的组织减少误诊,一次同时完成诊断和治疗,从而有效减少了手术时间和不必要的手术创伤,对于早期发现并成功诊断乳腺癌具有重要意义。
作者利益冲突声明:全体作者均声明无利益冲突。

