基因编辑技术及其水稻中的发展和应用
任俊 曹跃炫 黄勇 董慧荣 刘庆 王克剑
(中国水稻研究所/水稻生物学国家重点实验室,杭州310006;#共同第一作者:82101172206@caas.cn;*通讯作者:wangkejian@caas.cn)
水稻是世界上的主要粮食作物之一,全球大约一半以上的人口以大米为主食[1]。然而,传统育种策略周期长,人力、物力投入多,严重限制了水稻新品种的开发。序列特异性核酸酶(Sequence specific nucleases,SSNs)的出现则大大加快了育种进程,其可以精确地靶向基因组的特定位点。到目前为止,主要的序列特异性核酸酶包括:锌指核酸酶(Zinc finger nucleases, ZFNs)[2]、类转录激活因子效应物核酸酶(Transcription activator-like effector nucleases, TALENs)[3],以及成簇的规律性间隔短回文重复序列(Clustered regularly interspaced short palindromic repeat -associated protein,CRISPR/Cas)[4]。科学家们在对细菌的免疫系统及作用机理有了较深的认识后,开始对系统进行改造并逐步应用到动植物上。其中,CRISPR/Cas 系统因其设计和构建简单、成本低、突变效率高等特点被广泛应用。因此,本文也主要就CRISPR/Cas 系统在水稻中的发展和应用来进行综述讨论。
1 CRISPR/Cas 系统介绍
1.1 依赖DSB 的 CRISPR/Cas 系统
CRISPR/Cas 系统是普遍存在于古细菌及原核生物细菌的一种获得性免疫机制[5],可以在1 个引导RNA(single guide RNA, sgRNA)的引导下特异性地识别外源DNA 或RNA,并对其进行切割以达到沉默外源基因的目的。目前,在水稻中使用最多的是Type II型的 CRISPR/Cas9 系统[6-7],该系统仅需 1 个 Cas9 蛋白和sgRNA 元件参与,机制相对简单。在sgRNA 的引导下,Cas9 蛋白靶向基因组特定位置,并且其2 个核酸酶结构域RuvC 和HNH 分别切割基因组的靶标链(target strand)和非靶标链(non-target strand),产生 DNA 双链断裂(Double strand break,DSB),进而诱发细胞内非同源末端连接(Non-homologous end joining, NHEJ)和同源重组(homologous recombination, HR)修复途径,实现对基因组序列的插入缺失(insertions/deletions, indel)、替换等精准修饰[8](图1a)。然而CRISPR/Cas 系统中靶位点的选取受限于一段短的前间隔临近基序(Protospacer adjacent motif,PAM)序列[4]。CRISPR/Cas9 系统特异性识别 3’端一段 NRG(R=A/G))PAM 序列[6,9]。
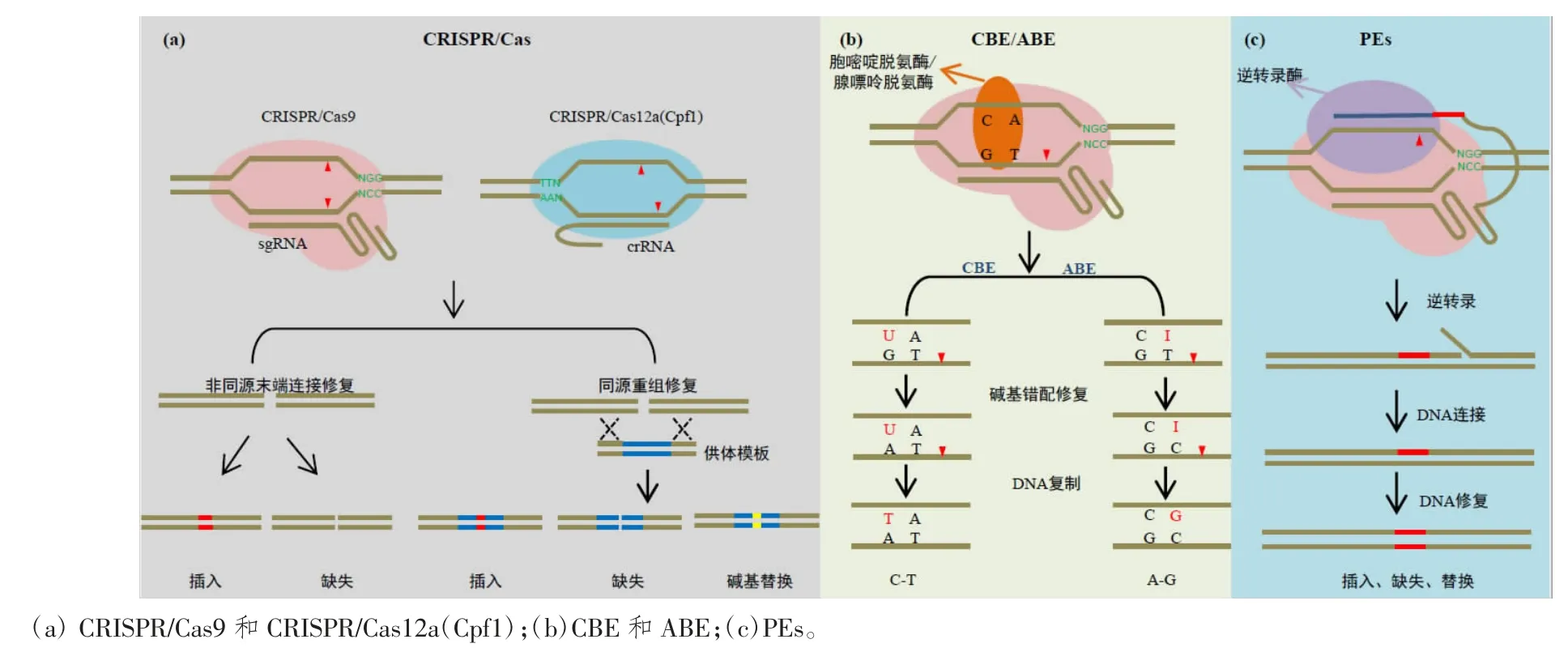
图1 CRISPR/Cas 系统及衍生技术的工作模式
另一个使用广泛的是Type V 型的CRISPR/Cas12a系统(也叫CRISPR/Cpf1),其特异性识别5’端连续2个或3 个胸腺嘧啶(T)的 PAM 序列[10-11]。并且与CRISPR/Cas9 系统相比,CRISPR/Cas12a[12]系统只需在crRNA(CRISPR RNA)引导下即可对DNA 双链进行切割,无需反式激活crRNA(trans-activating CRISPR RNA, tracrRNA) 参与;Cpf1 的 crRNA 较 sgRNA 更短,且其蛋白也比Cas9 蛋白更小,有助于构建装载量小和多基因编辑的载体;Cas9 蛋白切割基因组产生平末端,而Cas12a 切割目标序列产生粘性末端。Cas9 和Cas12a均是靶向 DNA 序列,而 VI 型CRISPR/Cas 效应体Cas13a(亦称 C2c2)[13]在一个 crRNA 引导下,可以切割与crRNA 互补配对的RNA 靶标。并且C2c2 还具有临近效应(collateral effect),即当 C2c2 特异性靶向 RNA靶标时,也会切割临近的RNA 单链。
CRISPR/Cas 系统靶向基因组受限于一段短的PAM 序列,通过开发SpCas9 蛋白的同源蛋白,例如SaCas9(NNGRRT PAM)[14]、ScCas9(NNG PAM)[15];以及人工改造变体,如 VQR(NGA PAM)[16-17]、VRER(NGCG PAM)[17]、xCas9 (NG, GAA 和 GTA PAM)[18-19]、SpCas9-NG(NG PAM)[18,20-21]、SpG(NG PAM)[22-23]等,CRISPR/Cas系统的编辑范围获得了极大地拓展,甚至几乎没有PAM 序列的限制,如 SpRY 变体[22-23]。
1.2 不依赖DSB 的CRISPR/Cas 系统
1.2.1 碱基编辑器
除DSB 介导的基因编辑外,基于CRISPR/Cas 系统发展起来的碱基编辑技术成为动植物精准基因修饰的重要支撑。目前水稻中常用的碱基编辑系统主要有两类:胞嘧啶碱基编辑器(cytosine base editor, CBE)和腺嘌呤碱基编辑器(adenine base editor, ABE)(图 1b)。这两类碱基编辑系统利用胞嘧啶脱氨酶或人工进化的腺嘌呤脱氨酶与Cas9 缺口酶(nicking Cas9, nCas9)进行融合,融合蛋白在sgRNA 介导下对靶位点进行精准的碱基编辑,最终可以分别实现C-T(G-A)或A-G(TC)的碱基转换[24-31]。虽然CBEs 和ABEs 能够精确的实现基因组编辑,但是,这两种碱基编辑器只能实现嘧啶对嘧啶、嘌呤对嘌呤的转换,即C-T、T-C、G-A 和A-G的改变,而不能实现碱基之间的颠换,如C-G、C-A、AT 和A-C 的转变。最近,有研究报道了一种能同时编辑C 和A 两种碱基的双碱基编辑器,它是由nCas9(D10A)与胞嘧啶脱氨酶和腺嘌呤脱氨酶融合而成,能同时使C-G 和A-T 转变为T-A 和G-C[32-33]。双碱基编辑器的开发能够进一步实现复杂的碱基编辑,解决了同时表达两个单碱基编辑器效率低的问题,也进一步拓宽了碱基编辑器的功能。
1.2.2 引导编辑器
为了实现碱基间的任意颠换和短片段的精准插入和缺失,ANZALONE 等[34]开发了引导编辑器(prime editors,Pes),可以实现全部12 种类别的碱基替换和小片段的插入缺失突变。PEs 系统由nSpCas9(H840A)、pegRNA(prime editing extended guide RNA)和逆转录酶 M-MLV(moloney murine leukemia virus reverse transcriptase)组成,其中 pegRNA 是在 gRNA 序列的 3’末端添加引物结合位点(prime binding sites,PBS)和携带编辑信息的逆转录(reverse transcription, RT)模板(图1c)。PEs 系统的主要工作机制是:nSpCas9(H840A)与工程化改造的逆转录酶M-MLV 的融合蛋白在pegRNA 的引导下在非靶标链上引入切口,切口的末端与pegRNA 上的 PBS 结合并在与 nSpCas9(H840A)蛋白融合表达的逆转录酶的作用下将pegRNA 的RT 模板携带的编辑信息直接反转录到目标DNA 链上,随后在生物体内的修复机制的作用下,将编辑信息引入基因组上。nSpCas9 在非编辑链上引入第二切口,诱导细胞以编辑链为模板对非编辑链进行修复,可以进一步提高对靶位点的精准编辑效率。目前,PEs 已经被成功应用于水稻中[35-38],但是由于PEs 的编辑效率受到细胞类型、Cas9 活性以及 pegRNA 等多种因素的影响[39-42],故其在植物中的编辑效率偏低且不稳定,但是PEs 可以实现其他编辑工具无法实现的多种精准突变,因此需要进一步的优化和探索PEs 系统。
2 CRISPR/Cas 系统在水稻品种改良和分子育种中的应用
多种基因编辑体系,包括碱基编辑器、引导编辑等的相继建立,为作物功能基因组研究和品种改良提供了强大的理论基础和技术支撑,可以迅速地在1~2 代内获得稳定的性状改良的水稻材料(图2)。
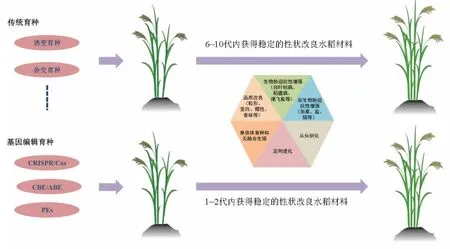
图2 传统育种与基因编辑育种技术比较
2.1 提高水稻产量
水稻是100 多个国家和地区30 多亿人的主要粮食[43]。随着世界人口的急剧增长和生态环境的不断恶化,全球粮食的可持续稳定供应面临巨大的风险,进一步提高水稻产量,保障粮食安全刻不容缓。水稻产量主要由有效穗数、每穗粒数和千粒重决定。近年来利用基因编辑技术已经改善了大量与产量性状相关的调控基因。
近几十年来,水稻中的主效粒形数量性状基因(quantitative trait locus,QTL)已经相继被克隆[44-53],并且通过基因编辑技术靶向这些QTLs 对水稻粒形产生了一定影响。例如,通过CRISPR/Cas9 介导的多重基因组编辑技术,同时编辑日本晴中2 个粒形调控因子GS3和GL3.1,gs3 突变体的T1代种子籽粒较细,而gs3gl3.1双突变体产生的籽粒较大[54]。此外,对另一个调控水稻千粒重的基因TGW6 进行敲除,获得的纯合突变株系的种子粒长粒重增加,水稻千粒重提高约5%[48]。利用CRISPR/Cas9 技术靶向每穗粒数主效基因OsGn1a,其纯和突变株系的每穗粒数增加,单株产量增加[7]。在OsTB1 的多种突变类型中,TGTG 插入的株系,株高、穗长、穗粒数均比野生型十分显著的增加,同时茎秆变粗而且抗折[55]。LV 等[56]利用 CRISPR/Cas9 技术敲除OsPAO5,显著增加了水稻籽粒大小、提高水稻产量,同时也显著地促进了水稻中胚轴伸长,可以促进水稻直播出苗。MIAO 等[57]利用CRISPR/Cas9 靶向一个影响粒型和株型的关键调控因子miR396。在其所有的突变体中,mir396e/f 突变体的籽粒长度和宽度明显增加,穗长和穗分支数目增加。并且mir396e/f 突变体还可以提高植物体的耐低氮逆境胁迫,在低氮条件下仍表现出高产稳产的特性。
在干旱胁迫下,脱落酸(ABA)可以促进根系的生长,但是整体上ABA 对植物的生长具有抑制作用[58]。利用CRISPR/Cas9 靶向ABA 受体蛋白家族成员PYL[pyrabactin resistance 1(PYR1)/PYR1-like]发现 pyl1/4/6 突变体在自然水田条件下水稻长势最好,并且产量提高,同时保持正常的种子休眠[59]。
2.2 改善稻米品质
稻米品质主要包括加工品质、外观品质、蒸煮和食用品质、营养品质和卫生品质等几个方面[60]。其中稻米外观品质在很大程度上影响了市场的接受度,稻米垩白是衡量稻米品质的一个重要性状,垩白率高的稻米会严重影响其外观品质和人们的食用烹调,因此,垩白率高的水稻品种在市场的接受度很小。近年来,利用CRISPR/Cas9 系统生成的纯合gs9 (Grain Shape Gene on Chromosome 9)无义突变体的籽粒垩白率显著降低,并且粒形较野生型细长,但是千粒重与野生型没有明显差异[61]。
水稻食用和蒸煮品质(eating and cooking quality,ECQ)主要由直链淀粉含量(amylose content,AC)、凝胶稠度和糊化温度决定,其中AC 是ECQ 最重要的决定因素[62]。蜡质(Waxy、Wx)基因决定了水稻 AC 含量,该基因编码颗粒结合淀粉合成酶I(granule-bound starch synthase I),控制胚乳中直链淀粉的合成[63-64]。近几十年来,在Wx 位点发现的多个等位基因(如Wxlv、Wxa、Wxb、Wxin、Wxop/hp、Wxmp、Wxmq、Wxmw和 wx)在不同程度上影响了水稻AC 含量,并进一步增加了消费者的选择。FEI 等[65]用 CRISPR/Cas9 技术对水稻Wx 基因进行敲除,培育出了优良的糯稻品种,其AC 含量降到仅为2.6%~3.2%,而稻米其他品质无明显变化。除了直接敲除Wx 基因改良稻米品质外,也有多个研究团队采用了不同的策略编辑Wx 基因,获得了不同AC 含量的新软米种质资源。XU 等[66]利用CBE 单碱基编辑器对水稻品种日本晴Wxb基因N 端结构域进行功能位点突变,获得了AC 含量分布在1.4%~11.9%的水稻新种质。HUANG 等[67]利用 CRISPR/Cas9 系统对 Wxb启动子TATA box 区域进行编辑,AC 含量从野生型的16.80%下降到10.66%~14.85%。ZENG 等[68]则利用CRISPR/Cas9 对Wxa启动子区及其5’UTR 内含子剪接点进行编辑,AC 含量分别下降到 17.0%~18.0%和 9.0%~10.0%。
香稻品种因其独特的香气和口感而越来越受欢迎。香稻中香味的主要成分是2-乙酰基-1-吡咯啉(2-acetyl-1-pyrroline,2AP),而它的合成前体4-氨基丁醛主要被OsBADH2 蛋白氧化失活[69]。利用CRISPR/Cas9技术获得OsBADH2 的功能缺失突变体,其2AP 积累增加,水稻香味增强[70-71]。通过编辑OsBADH2 外显子和内含子交接处而引起外显子的跳跃,从而导致了其阅读框的移位也得到了类似的结果[72]。
2.3 增强对生物胁迫的抗性
植物病原菌和害虫对粮食安全构成严重威胁,据估计,它们每年造成20%~40%的全球粮食生产损失[73]。利用CRISPR/Cas 技术敲除病虫害易感基因可以减少病虫害对水稻发育和产量的影响。
水稻白叶枯病和稻瘟病是稻作生产中的主要病害,会直接影响水稻产量,一般减产10%~20%,严重的达40%~50%,局部田块甚至颗粒无收[74]。水稻白叶枯病是由水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae)引起的。目前对白叶枯病具有广谱抗性的水稻品种就是通过编辑SWEET 基因启动子区域降低其表达而获得的[75]。相同的策略也编辑了白叶枯病抗性基因Xa13,从而提高了水稻白叶枯病抗性[76]。稻瘟病是由稻瘟病原菌引起的。WANG 等[77]在水稻中靶向OsERF922基因,提高了水稻对稻瘟病的抵抗能力。同样,通过CRISPR/Cas9 靶向诱变获得的 OsSEC3A、Pi21 基因的突变体植株,对稻瘟病的抗性也得到一定增强[78-79]。
相较于水稻抗病种质的突破性研究进展,基因编辑技术在抗虫方面的研究进展较为缓慢,这可能与水稻害虫抗性机制更为复杂有关,只有少数的抗虫基因被克隆。并且,已克隆的褐飞虱抗性基因BPHs 正向调控水稻对褐飞虱的抗性,并不能简单的利用CRISPR/Cas 技术获取功能缺失突变体来增强水稻对褐飞虱的抗性。
2.4 增强对非生物胁迫的抗性
近年来,气候的不断恶化使水稻生长面临越来越严重的逆境胁迫。杂草、重金属污染、干旱等逆境胁迫越来越严重,培育抗逆性强的水稻品种越来越迫切。
杂草危害是制约水稻生产的重要因素。除草剂的使用虽然在很大程度上可以抑制杂草的生长,但是也会对水稻生长和生态环境产生一定影响,不适宜直接用于实际生产[80]。因此培育除草剂抗性增强的水稻不仅可以提高除草效率,节约大量人力成本,还可以更好地保护生物稳态。SUN 等[81]利用CRISPR/Cas9 介导的同源重组修复技术将W548L 和S627I 这2 个氨基酸替换,成功引入水稻ALS 基因,获得了耐碘酰脲类和嘧啶羧酸类除草剂水稻新种质。此外,EPSPS 蛋白的T102I 和 P106S 氨基酸突变[82]以及 TubA2 中的 M268T[83]突变,分别赋予水稻对草甘膦和氟乐灵的抗性。综上所述,利用CRISPR/Cas9 系统产生的这些抗除草剂等位基因具有加速水稻种质创新的巨大潜力。
随着工业化进程的不断发展,重金属污染也逐渐加剧。其中镉是一种毒性很大的重金属,且可在生物体内富集。因此,利用CRISPR/Cas9 技术敲除镉摄取相关蛋白(OsNramp5)和镉转运蛋白(OsLCT1)可以减少镉在水稻中的积累[84]。
盐胁迫是影响植物生长非常重要的非生物胁迫因素。目前的研究表明,主要是一些植物转录因子家族基因参与响应盐胁迫反应[85]。利用CRISPR/Cas9 技术敲除NAC 家族转录因子OsNAC041,敲除后植株高度高于野生型并且突变体盐敏感性增加[86]。
2.5 单倍体育种和无融合生殖
1987 年,袁隆平先生提出杂交水稻育种分三个发展阶段的战略:从“三系法”到“两系法”再到“一系法”,朝着程序由繁到简而效率越来越高的方向发展[87]。水稻育种“一系法”即以无融合生殖为遗传基础的杂种优势固定的育种研究。无融合生殖(Apomixis)是一种通过种子进行无性繁殖的生殖方式,由于其不经过减数分裂或受精就可以产生种子,因此不会改变杂交品种的杂合基因型,从而实现杂种优势的固定[88]。虽然无融合生殖在400 多个物种中已经被发现,但是在一些主要农作物中并没有发现这一现象[89]。
近期,有研究表明,精细胞特异表达基因OsBBM1在卵细胞中异位表达可以绕过受精过程产生孤雌生殖,获得单倍体[90]。并且此前有研究报道,利用CRISPR/Cas9 技术同时敲除3 个将减数分裂转换为有丝分裂(Mitosis instead of Meiosis,MiMe) 的相 关基因(O-sPAIR1、OsREC8、OsOSD1),可以消除水稻中的重组事件,使卵细胞加倍[91]。因此,在水稻中同时敲除MiMe 相关基因,并且利用卵细胞特异表达基因的启动子驱动OsBBM1 在卵细胞异位表达,就可以使二倍体卵细胞直接发育成胚进而完成无融合生殖过程[90]。
几乎同时,WANG 等[92]利用基因编辑技术同时编辑 4 个基因(OsPAIR1、OsREC8、OsOSD1、OsMTL),将无融合生殖特性引入到杂交稻中,获得了杂种优势固定的克隆种子。前期研究表明,玉米MTL 基因的无义突变可以诱导产生单倍体[93-94]。WANG 等[92]首先利用CRISPR/Cas9 基因编辑技术敲除了籼粳杂交稻品种春优84 中与玉米MTL 同源的OsMTL 基因,在其F1代成功产生了水稻单倍体。随后继续利用CRISPR/Cas9 基因编辑技术在春优84 中同时敲除MiMe 相关基因和OsMTL 共4 个水稻内源基因,获得了可以发生无融合生殖的杂种优势固定(Fixation of hybrids, Fix)材料。Fix植株在营养生长阶段表现正常,表型也与其F1代杂交稻高度相似。但是上述两种策略单倍体诱导率均较低(5%左右),并且育性也明显下降(10%左右),还不能完全投入实际生产应用。
2.6 人工定向进化
遗传和变异是生物进化的基础。长期以来,研究人员通过物理(例如紫外线)或化学(例如乙基磺酸乙酯,EMS)等方法来创制突变体,进一步改善植物性状。但是这些方法产生的突变是随机的,并且往往会产生大量的植株生长或者某种性状受到抑制的突变体,后续对这些突变体的筛选和鉴定非常耗时耗力。基于CRISPR/Cas 技术的高效性和特异性,研究人员通过创制目标基因的突变文库,并在相应选择压力下,可以快速且定向获得目标性状改良的作物品种。
LI 等[33]设计了200 个独立的sgRNA 靶向水稻乙酰辅酶A 羧化酶(OsACCase)的羧基转移酶结构域(Carboxyltransferase, CT domain)。随后对再生苗喷洒高效氟吡甲禾灵(Haloxyfop)进行筛选,对长势正常的秧苗进行测序以确定突变类型,共发现4 个除草剂抗性突变 位 点 :P1927F、W2125C、S1866F 和 A1884P。 除W2125C 以外,其余3 个抗性位点未曾在植物中有过报道。另外两个研究团队也利用类似的策略分别对水稻ACCase 的CT domain[95]及内源靶标基因OsALS[96]实现近似饱和突变,均发现一些新的有生产应用潜能的除草剂抗性位点,并且研究人员[96]进一步将鉴定到的OsALS 中的P171F 氨基酸替换引入到了水稻生产品种南粳46 中,使南粳46 升级为“洁田稻”。
2.7 野生稻从头驯化
当前种植的所有栽培稻都是经过数千年的时间从野生稻驯化而来的。随着时间的推移,在提高作物产量和获得理想性状的同时,也导致了遗传多样性的减少以及一些抗逆性的减弱。许多主要作物的野生近亲比栽培作物对生物和非生物胁迫的抗性更强,因此野生植物的直接驯化是一个非常有前景的策略[97]。YU 等[98]利用CRISPR/Cas 技术首次建立了野生四倍体水稻快速从头驯化的技术体系,并进一步利用基因编辑技术对异源四倍体水稻基因组与二倍体栽培稻中重要农艺性状的同源基因进行编辑,成功创制了一系列具有不同表型的突变体,为创制和培育新的作物以满足未来的粮食需求和安全提供了一个切实可行的策略。
3 讨论
截至2021 年1 月,全球230 个国家人口总数为75.85 亿。联合国最新发布的《世界人口展望:2015 年修订版》报告预计,世界人口将在2050 年达到97 亿,2100 年达到112 亿。面对如此急剧增长的人口数量和人口压力,如何能够保证未来的粮食生产和安全是我们现在面临的一个巨大挑战。并且随着全球气候环境不断恶化、耕地资源不断缩小等,对农业生产和可持续利用带来了更大压力。因此,迫切需要科技创新来进行作物的性状改善和品种改良,来适应不断恶化的自然环境。
植物基因组编辑技术的发展为植物育种提供了很大的便利。通过基因组编辑的高效和精确的诱变可以在1~2 代内获得性状稳定的作物种质,这是传统育种技术无可比拟的。同时,基因编辑技术也存在两方面的限制。一是其编辑范围受限制,虽然目前CRISPR/Cas系统的编辑范围已经获得极大拓展,甚至于几乎不受PAM 的限制,但是SpRY 变体对PAM 的识别具有偏好性,即 NRN>NYN(Y=C/T),在携带 NYN PAM 的靶位点的编辑活性较低,还需要进一步的优化,使其在这些靶位点的编辑效率都得到进一步提高。另一方面是其突变类型受限制,虽然现在CRISPR/Cas 系统已可以获得多种类型的突变,如基因功能丧失、基因氨基酸替换以及调控基因表达等。但是这些类型的突变均是通过CRISPR/Cas 系统不同类型的衍生技术来实现,不同类型的突变不能通过一种类型的CRISPR/Cas 系统同时获得。PE 系统的出现打破了这些衍生技术之间的鸿沟,其可以产生插入缺失突变以及全部12 种类型的碱基替换,但是其在植物中的编辑效率很低,不能满足基础研究和实际应用的需求。近日,LIN 等[99]通过调整PBS 的熔解温度(Melting Temperature, Tm)为 30℃以及在DNA 位点的正负链上各设计1 个pegRNA,将PEs系统的编辑效率平均提高约3 倍。并且其还发现PE 系统在全基因组范围内具有很高的特异性。进一步将SpRY 变体与PEs 系统相结合,可以使CRISPR/Cas 系统获得极大拓展,为植物品质改良和分子育种提供更简捷高效的工具。
基因编辑技术可以特异地将多个遗传性状组合,从而精确高效地获得多个性状同时改良的作物种质。并且还可以通过设计多个gRNA 同时靶向一个基因,在后期的选择压存在的条件下加速作物的驯化进程。利用基因编辑技术实现了植物的无融合生殖构成,成功实现了杂种优势的固定,避免了繁琐的杂交种制种流程,节省了大量人力物力,减少了农民的种植成本。当前,针对基因编辑产品的安全性问题世界各国的态度也存在一定差别。除了欧盟中部分国家将基因编辑作物视为转基因作物,受转基因生物管理条例规定的约束外,大多数国家,如美国、加拿大、澳大利亚、日本、阿根廷、巴西等已将基因编辑(没有导入外源基因)作物视为非转基因生物,开放了基因编辑产品流入市场。近期开发的一种外源成分检测器(Foreign Element Detector, FED)可在外源成分信息未知的情况下,对全基因组重测序数据进行分析,一次性完成对46 695 种不同外源成分序列的检测,同时FED 还可以精确鉴定出外源成分的片段长度及在基因组上的插入位置,为全球基因组编辑产品的应用和安全监管提供了一个重要工具平台[100]。同时也有望为我国基因编辑产品的开发和应用提供安全保障,将基因编辑技术研发的领先优势尽快地转化为产品优势,以有效应对外来基因编辑产品的冲击,保障国家粮食安全。

