丙炔醇改性硫脲基咪唑啉在CO2/H2S 共存体系中对X65 钢的腐蚀抑制作用
陆原,张国欣,刘保山,刘言霞,张妙玮,赵景茂,樊保民
(1.中海油(天津)油田化工有限公司,天津 300450;2.中海油能源发展股份有限公司工程技术分公司,天津 300452;3.北京化工大学 材料科学与工程学院,北京 100029;4.北京工商大学 材料与机械工程学院,北京 100048)
海上油田的原油含水量不断上升,油田的CO2和H2S 腐蚀问题日益严重[1-4]。咪唑啉及其衍生物类缓蚀剂是一种国内外各油田应用最广泛且效果总体良好的一种有机缓蚀剂[5-10]。当腐蚀介质中不含硫化氢或含少量硫化氢时,咪唑啉衍生物缓蚀剂能很好地控制腐蚀,如硫脲基咪唑啉在我国海上油田得到了较广泛的应用。但在硫化氢含量较高时,硫脲基咪唑啉的缓蚀效果将明显降低,例如我国海上油田部分单井硫化氢含量达到2000 mg/L 以上时,腐蚀问题明显加剧,通过补充加注增效缓蚀剂才能解决,给现场作业带来诸多不便。因此,很有必要通过改性来提高硫脲基咪唑啉缓蚀剂抗硫化氢腐蚀的能力,拓展其作为单剂使用的范围。为了指导有关改性化合物的研发,近年来,针对咪唑啉及其衍生物的构效关系进行了大量的基础研究工作[11-13]。这些研究工作表明,引入新的官能团可以有效地提高咪唑啉类分子的缓蚀性能,同时单分子缓蚀剂的官能团和结构设计可以借鉴不同缓蚀剂分子之间的协同效应,即可将不同缓蚀剂分子上的官能团组合到其中一个分子上。
由于油田生产水中高浓度的硫化氢会极大地促进碳钢腐蚀时的阴极析氢反应[14],也会增加溶液的酸性,因此盐酸缓蚀剂可能有一定的借鉴作用。V.Muralidharan 等[15]对比了丙炔醇、丁炔醇和丁炔二醇在浓度为1.0~8.0 mol/L 的盐酸溶液中的缓蚀效果,认为丙炔醇具有更显著的缓蚀效果。这是因为亚铁离子促进了炔醇的三维螯合,从而形成了多聚体膜。随着时间的增加,聚合物薄膜的厚度逐渐增加。M. Veliev等[16]合成出一种性能优异的抑制盐酸腐蚀的二乙炔醚,并发现起缓蚀作用的主要是两个末端炔键。N.Podobaev 和Y. Avdeev[17-18]的研究发现在盐酸溶液中,丙炔醇能在碳钢表面生成一层聚合物保护膜并提供保护作用。因此,预测利用丙炔醇对硫脲基咪唑啉的侧链氨基进行改性,可能提高咪唑啉抗H2S 腐蚀的性能。故本文研究了一种双炔丙基甲氧基硫脲基咪唑啉(DPFTAI),通过失重试验、量子化学计算和分子相互作用力模拟运算等方法研究其缓蚀性能,发现DPFTAI具有3 个吸附中心和更好的抗硫化氢腐蚀性能。
1 试验
1.1 介质与材料
试验溶液为中国南海某海上油田生产水,其化学组成见表1。
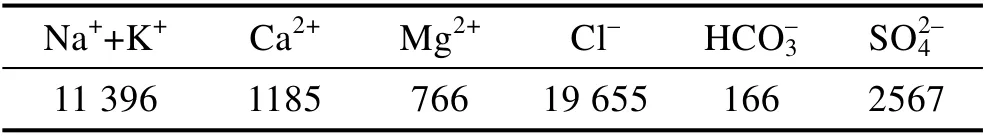
表1 试验用油田生产水化学组分Tab.1 Chemical composition of experimental water mg/L
试验材质为X65 钢,尺寸为40 mm×13 mm×2 mm,化学组分见表2。X65 钢试片用砂纸逐渐打磨至1500目,然后依次用清水、酒精和丙酮清洗,再用冷风吹干,放入干燥器干燥4 h。试验前用梅特勒MS204S型电子分析天平称量。
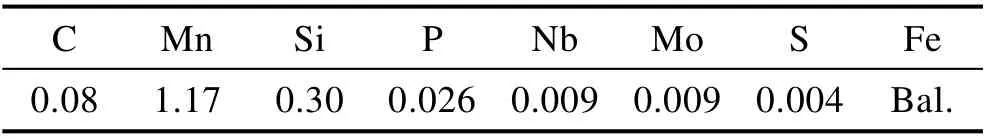
表2 X65 钢的化学组分分析Tab.2 Chemical composition analysis of X65 steel wt/%
硫脲基咪唑啉(TAI)和双炔丙基甲氧基硫脲基咪唑啉(DPFTAI)的分子结构见图1,合成方法参考文献[19]。

图1 TAI 和DPFTAI 的结构式Fig.1 Chemical structures of TAI and DPFTAI
1.2 动态腐蚀试验
将3 个X65 钢平行试样完全浸没于盛有油田现场生产水的高压釜中,加药浓度为50 mg/L,通氮气1 h 除氧后,通入0.7 MPa CO2(含0.2%(体积分数)H2S),再用氮气加压至1 MPa,然后升温至60 ℃,流速为1 m/s,试验时间为72 h。
试验结束后,用酸洗液(10%HCl+1%乌洛托品,质量分数)清洗试片的腐蚀产物后,放入干燥器干燥4 h 后,用梅特勒MS204S 型电子分析天平称量,计算试样的腐蚀速率。腐蚀速率计算公式如式1,缓蚀率的计算公式如式2。

式中:V为均匀腐蚀速率,mm/a;ΔW为腐蚀前后平行试样的平均失重,g;s为试片的面积,cm2;ρ为碳钢的密度,g/cm3;t为试验时间,h。

式中:η为缓蚀率;V、V0分别表示不加缓蚀剂的腐蚀速率和添加缓蚀剂的腐蚀速率(mm/a)。
1.3 电化学测试
仪器为Gamry Interface 1000 电化学测试仪,自制X65 钢电极作为工作电极,铂片为对电极,饱和甘汞电极为参比电极。测试温度为60 ℃,动电位极化电位扫描范围为–200~+200 mV(相对于开路电位),扫描速率为0.5 mV/s。交流阻抗测试的频率范围为100 kHz~0.01 Hz,扰动的电位幅度为±5 mV。
1.4 计算机模拟计算
1.4.1 分子轨道能量计算
使用Materials Studio 软件中的DMol3 模块进行模拟运算,计算分子的轨道能量和电子状态,采用B3LYP 方式进行能量优化。
1.4.2 分子在钢表面的吸附状态模拟计算
利用Materials Studio 软件中的Amorphous cell工具,构建3 层有周期性边界条件的三维模型:上层为全部固定的水分子层;中层含有1 个缓蚀剂分子、1000 个H2O、50 个H3O+、40 个HCO3–和10 个HS–[19-20],该层模型的长宽均设置为2.866 nm;下层是被固定的Fe(001)面的原子层,厚度约为1.15 nm。将3 层完美拼接后,使用discover 模块进行模拟运算。模拟过程使用pcff 力场,温度定为333 K,压力值定为1 MPa,采用Andersen 恒压控制。范德华作用力(vdW)则采用Atom Based 模拟方法。长程库仑力(Coulomb)采用Ewald 模拟方法。模拟过程中截断半径设置为1.25 nm。
1.4.3 缓蚀剂分子与腐蚀离子间的相互作用情况模拟计算
利用Amorphous cell 工具,构建有周期性边界条件的三维模型,在三维模型中放入1 个缓蚀剂单分子,1000 个H2O 分子,50 个H3O+,40 个HCO3–,10个HS–。运算过程和参数设定与1.4.2 节相同。利用Forcite 工具中的径向分布函数(Radial distribution function)对三维模型的终态结构进行解析,得到HS–在缓蚀剂分子或离子周围的浓度分布曲线。
2 结果与讨论
2.1 TAI 和DPFTAI 的缓蚀性能测试
2.1.1 动态失重试验
利用高温高压动态釜评价硫脲基咪唑啉TAI 和DPFTAI 在质量浓度为50 mg/L 时的缓蚀性能,结果见表3。可以看出,DPFTAI 的抗二氧化碳性能优于TAI;同时在2000 mg/L 硫化氢条件下,TAI 的缓蚀性能明显下降,而DPFTAI 的缓蚀性能仍然很优异,达到了91.96%。
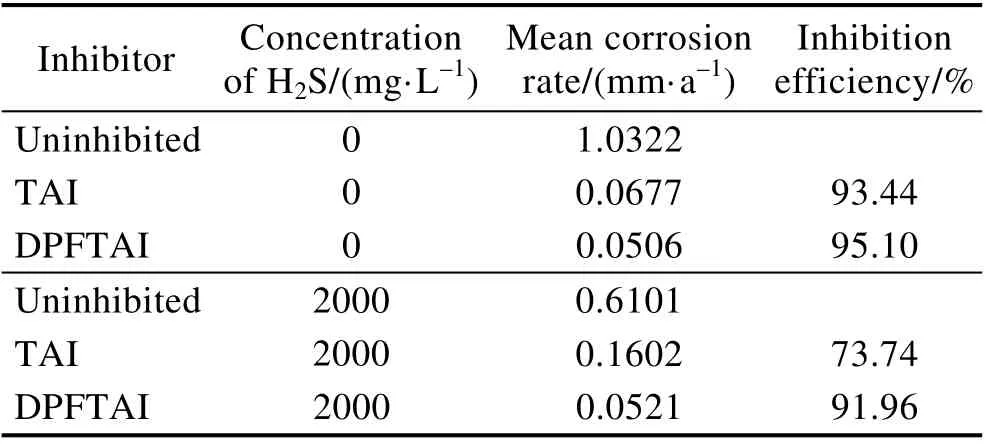
表3 缓蚀剂在含或不含2000 mg/L H2S 的二氧化碳压力为0.7 MPa 溶液中的性能Tab.3 Corrosion inhibition effects of two inhibitors in 0.7 MPa CO2 brine solution with and without 2000 mg/L H2S
2.1.2 极化曲线
图2 为X65 钢在添加TAI 和DPFTAI 前后的腐蚀介质中的极化曲线。可以看出,添加两种缓蚀剂后X65 钢的腐蚀电位均明显正移,自腐蚀电流密度均减小,说明TAI 和DPFTAI 均属于抑制阳极为主的缓蚀剂,对CO2/H2S 腐蚀都有抑制作用。但DPFTAI的自腐蚀电流密度(5.1×10–5A/cm2)小于TAI(8.9×10–5A/cm2),同时阳极极化曲线位于最右侧,说明其抑制效果优于TAI。

图2 X65 钢在添加TAI 和DPFTAI 前后的腐蚀介质中的极化曲线Fig.2 Polarization curves of steel X65 in corrosive media before and after adding TAI and DPFTAI
2.1.3 交流阻抗
图3 为X65 钢在添加TAI 和DPFTAI 前后的腐蚀介质中的EIS 谱图。其中Nyquist 图中容抗弧是个类似压扁的半圆,代表电极表面的电荷转移电阻,反映了腐蚀过程中阻力的大小。从图3 中可以看出,添加TAI 和DPFTAI 后的金属电荷转移电阻要远远大于未添加缓蚀剂的金属电荷转移电阻。这表明添加TAI和DPFTAI 后,电荷转移受到了较大的阻力,且DPFTAI的容抗弧半径明显大于TAI,说明DPFTAI 对CO2/H2S腐蚀的抑制作用明显优于TAI。
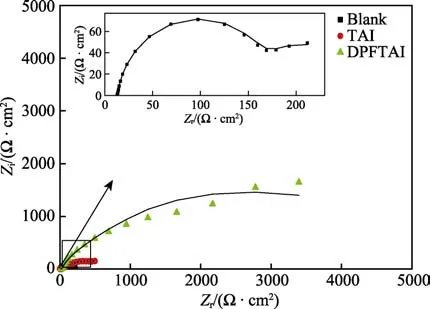
图3 X65 钢在添加TAI 和DPFTAI 前后的腐蚀介质中EIS测试的Nyquist 图Fig.3 EIS of X65 steel in corrosive media before and after adding TAI and DPFTAI
2.2 模拟计算
2.2.1 轨道能量和Fukui 指数
前线分子轨道理论[19-21]认为,最低空轨道能量与最高占有轨道能量之差,即能隙ΔE,其值越小,吸附越稳定,分子的缓蚀效果将会越好。Fukui 指数可用来分析反应活性点位和强弱,以及亲核亲电特性,可以表征缓蚀剂膜的稳定性。
模拟计算得到的分子轨道能量见表4。由表4 可知,DPFTAI 的能隙ΔE小于TAI 的能隙,说明DPFTAI吸附更稳定,缓蚀效果更好。除碳氢原子外的其他原子的Fukui 指数见表5。由表5 可知,TAI 有1 个吸附中心,为TAI 分子上的S 原子,而DPFTAI 有3 个吸附中心,分别为咪唑啉环上的2 个N 原子和一个DPFTAI 侧链分子上的S 原子,因此DPFTAI 与金属基体表面的吸附明显更加稳定,缓蚀效果更优异。该模拟计算结果与动态失重试验和电化学试验结果相吻合。

表4 TAI 和DPFTAI 的轨道能量Tab.4 Orbital energy of TAI and DPFTAI
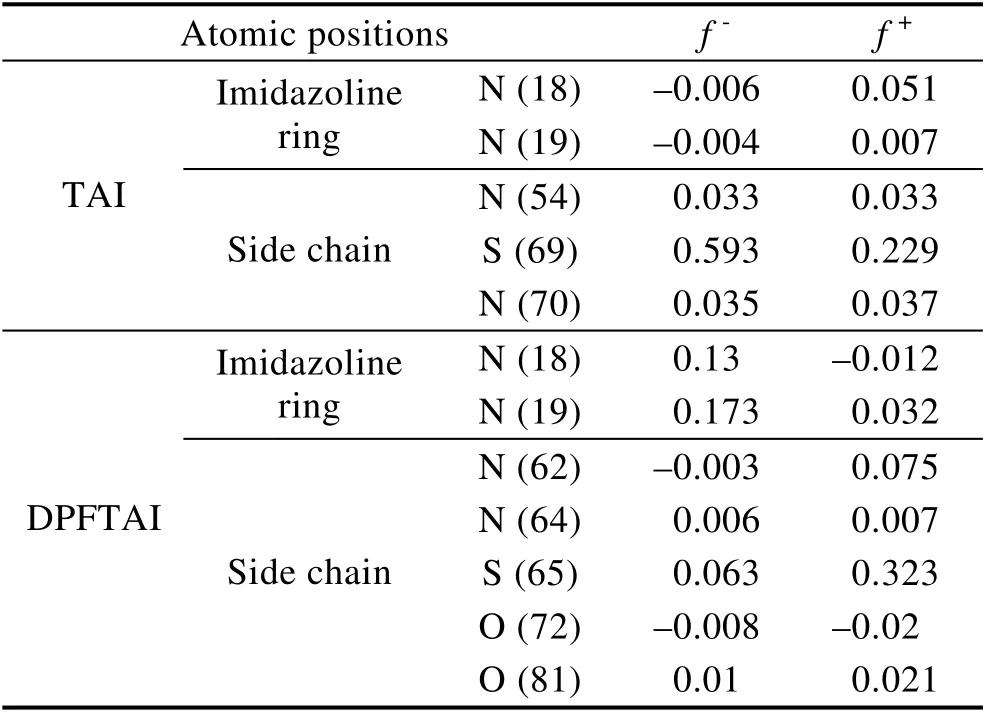
表5 除碳氢原子外其他原子的Fukui 指数值Tab.5 Fukui index of atoms of atoms other than carbon and hydrogen
2.2.2 分子在钢表面的吸附状态模拟计算
图4 是TAI 和DPFTAI 在Fe 的(001)面的吸附平衡结构。从图4 可以看出,TAI 呈现单点吸附的模式,而DPFTAI 是一种多点同时吸附的模式。通过模拟计算,DPFTAI 与铁表面的相互作用能为29.66 kcal/mol,大于TAI 的22.46 kcal/mol。因此,可以推测,当硫化氢引入腐蚀体系后形成HS–,与两种咪唑啉衍生物进行竞争吸附,导致缓蚀性能下降,而DPFTAI 由于有3 个吸附中心,且与表面吸附的能力强,相对TAI而言更不容易受到HS–的影响,具有更好的缓蚀性能。该模拟计算结果与动态失重试验和电化学试验结果相吻合。

图4 缓蚀剂分子TAI 和DPFTAI 在铁表面的吸附平衡构型Fig.4 Balance adsorption structure of (a) TAI and (b) DPFTAI on the surface of iron
2.2.3 缓蚀剂分子与腐蚀离子间的相互作用情况模拟计算

根据以上机理,HS–在界面上的吸附、结合反应和脱离反应对于促进腐蚀过程起到了非常关键的作用,因此缓蚀剂能否有效抑制腐蚀,主要取决于能否阻碍HS–的作用过程。图5 为界面模拟计算得到的TAI和DPFTAI 分子周围HS–浓度随粒子间距的变化曲线。由图5 可以看出,DPFTAI 周围HS–浓度明显大于TAI 周围的HS–浓度。一方面,缓蚀剂分子与HS–发生竞争吸附,部分缓蚀剂分子排挤掉表面吸附的HS–,直接吸附在碳钢表面,被排挤掉的HS–则集中在界面附近;另一方面,缓蚀剂分子也可能与吸附在铁表面的HS–发生相互作用,形成“桥接”作用,促进缓蚀剂分子在界面上的吸附,将水层隔开。因此,如果缓蚀剂周围HS–(忽略HS–在Fe 表面吸附的影响,将也简化为HS–,ads 代表吸附)浓度峰值越大,则表明缓蚀剂分子在界面上的吸附越多,可以推测缓蚀效果越好[20]。以上结果说明在CO2/H2S腐蚀体系中,DPFTAI 在钢材表面的吸附效果明显优于TAI,缓蚀效果明显优于TAI。该模拟计算结果与动态失重试验和电化学试验结果相吻合。
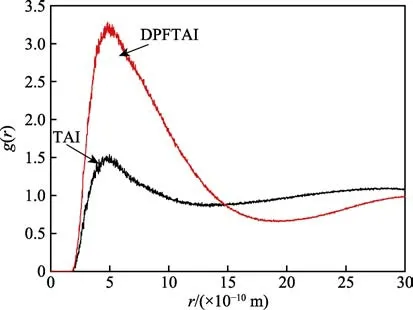
图5 界面模拟计算得到的TAI 和DPFTAI 分子周围HS–浓度随粒子间距的变化曲线Fig.5 Curves of HS– concentration around TAI and DPFTAI molecules with particle spacing
3 结论
1)动态失重试验、电化学试验表明,通过丙炔醇改性TAI 获得的DPFTAI 对X65 管线钢在CO2/H2S中的腐蚀防护性能明显提高。在不含H2S 的条件下,两者的缓蚀效率均高于93%,当含有2000 mg/L H2S后,DPFTAI 的缓蚀效率仍高达91.96%,且比TAI高出18.22%。
2)通过第一性模拟计算发现,TAI 只有1 个吸附中心,与铁表面的相互作用能为22.46 kcal/mol,而DPFTAI 有3 个吸附中心,与铁表面的相互作用能较大,为29.66 kcal/mol,且DPFTAI 周围的HS–浓度明显大于TAI 周围的HS–浓度,说明在CO2/H2S 腐蚀体系中,DPFTAI 在Fe 表面的吸附效果明显优于TAI。因此,吸附能力的提升是DPFTAI 腐蚀抑制性能提高的主要原因。

