纳米金生物传感器的制备及其在汞离子检测中应用
马 静,金葆康
(安徽大学 化学化工学院,安徽 合肥 230601)
地球化学循环和人为生产活动产生的有害重金属离子已经对自然环境与人类健康构成了严重的威胁.其中汞 (Hg)是最普遍的强毒性重金属离子之一,由于它不可自然降解且具有很强的生物富集性,Hg一旦通过食物链进入人体,可与蛋白质和酶结合积累在重要组织和器官中,导致细胞功能异常和各种疾病,损害人体健康,破坏人类的正常生活.因此,开发一种简单快速、高灵敏度、高选择性的Hg检测方法具有重要的实际意义.
为了实现这一目标,人们开发了多种分析方法,如电感耦合等离子体法 (ICP)、原子吸收光谱法 (AAS)、原子荧光光谱法 (AFS).上述方法具有较准确的检测结果,但是通常需要昂贵的精密仪器、烦琐耗时的样品制备步骤和操作熟练的技术人员.近年来,人们发现脱氧核糖核酸 (DNA)上T-T错配可通过N-Hg共价键捕获Hg,且T-Hg-T的金属离子结合常数比天然的A-T碱基对大得多.基于这一原理,人们研发了多种用于Hg检测的新型传感器,如比色传感器、荧光传感器、表面等离子共振传感器、电化学传感器.电化学传感器因其仪器简单便携、检测时间较短、电极易于修饰且可用于检测混浊或有色样品而具有巨大的应用潜力.Wu等基于目标诱导DNA结构转换构建了一种高灵敏度和选择性检测Hg的电化学生物传感器.Hg诱导富T的直链状ssDNA转变为发卡结构,导致与ssDNA相配对的Fc标记的DNA立即释放并降低了氧化还原电流.此外,这种设计简单的高灵敏度和选择性传感器还允许集成到便携式系统中,并使得现场检测Hg成为可能.Zhang等开发了一种快速响应、高灵敏度和高选择性的单步电化学生物传感器.该传感是基于Hg诱导亚甲蓝标记(MB)的直链状DNA通过T-Hg-T配位键形成发卡状结构后,MB和传感器表面之间的碰撞显著增加,导致MB的电流响应增强.因此,它为评估被Hg污染的乳制品的安全性提供了一种有应用前景的方法.
用作构建传感平台的纳米材料在促进信号放大、加快电子转移中起着至关重要的作用,如纳米壳聚糖 (NCs)、石墨烯纳米片和金纳米粒子 (AuNPs).其中AuNPs因其导电性高、生物相容性好、电活性表面积大等独特性能,成为非常有吸引力的生物传感器材料.硫堇 (Th)是一种具有电化学活性的吩噻嗪类阳离子小分子,具有平面刚性芳香结构,因此可以特异性嵌入DNA双螺旋内部.
笔者通过电沉积纳米金电极为工作电极来构建电化学生物传感器,利用差分脉冲伏安法 (DPV)超灵敏检测Hg.首先通过电沉积方法,将金纳米颗粒长在金电极表面,再利用Au-S共价键将ssDNA固定在修饰电极表面.固定在电极表面的ssDNA上T碱基与Hg之间发生特异性识别,直链状ssDNA转变为发卡状.随后,作为电化学信号的硫堇 (Th)选择性嵌入ssDNA的自折叠内部,基于Th的DPV信号响应实现Hg的灵敏检测.
1 实验部分
1.1 试剂和材料
ssDNA(SH-(CH)-5′-TTCTTTCTTCGCGTTGTTTGTT -3′),三羟甲基氨基甲烷 (Tris),牛血清蛋白 (BSA),均购自上海生工生物工程股份有限公司;氯金酸 (HAuCl),硝酸汞(Hg(NO)),国药集团化学试剂有限公司;三(2-羧乙基)磷酸盐 (TCEP),6-巯基-1-乙醇 (CHOS),阿拉丁试剂有限公司;硫堇 (Th),上海麦克林生化科技有限公司;其他试剂均为国产分析纯.实验用水均为超纯水机(购自安徽皖仪科技股份有限公司)制备(18.25 MΩ·cm).
1.2 仪 器
真空干燥箱 (DZF-6020),上海精宏实验设备有限公司;电化学实验采用三电极系统:工作电极为纳米金修饰电极 (购自天津高仕睿联科技有限公司,直径 3.0 mm),对电极为铂丝电极,参比电极为饱和甘汞电极 (SCE);示差脉冲伏安法(DPV)、电化学交流阻抗谱 (EIS)和循环伏安法 (CV)实验均在电化学工作站(AUTOLAB PGSTAT302N,瑞士万通)进行;修饰电极表面在冷场发射扫描电子显微镜(S-4800,日本日立)上观察.
1.3 实验方法
1.3.1 纳米金修饰电极的制备
抛光后的金圆盘电极依次在水、乙醇、水中超声10 min,再用piranha溶液(v
(98%HSO)∶v
(30%HO)=3∶1)处理电极表面,去除可能残留的污染物,随后用二次水冲洗,重复3次,直至电极表面呈现干净光滑的镜面状态.电极置于0.5 mol·L硫酸中循环伏安扫20圈后,氮气吹干.处理干净的金电极置于0.1% HACl的0.1 mol·LHSO中,控制电位和沉积时间,恒电位还原制备纳米金修饰电极,记为AuNPs/Au电极.1.3.2 生物传感器的搭建
取巯基修饰ssDNA溶液 (约100 μmol·L)1 μL,加入TCEP (10 mmol·L)10 μL,反应 1 h以切断ssDNA上的双硫键,使ssDNA为单链游离状,再加入DNA固定液 (10 mmol·LTris HCl,100 mmol·LNaCl,1 mmol·LMgCl,pH 7.4)将ssDNA溶液稀释为1 μmol·L.取10 μL上述溶液滴加在制备的纳米金修饰电极表面,于4 ℃自组装12 h,将电极浸入1 mmol·LMCH溶液1 h,得到ssDNA/AuNPs/Au电极.将20 μL含Hg的待测液滴加在修饰的电极表面,并置于一定温度下孵化一定时间,随后依次用缓冲溶液、二次水冲洗电极,氮气吹干后,滴加10 μL 1% BSA溶液反应1 h以彻底封闭纳米金电极,冲洗干净待用.
1.3.3 电化学检测
将10 μL 1 mmol·LTh溶液滴加在已搭建好的电化学生物传感器表面反应1 h后进行电化学实验.DPV实验条件:缓冲溶液为 6.7 mmol·LPBS (pH=7.4),扫描电位为-0.5~0 V (vs SCE),阶跃电位为25 mV,扫描速率为10 mV· s.EIS的频率范围从0.1 Hz 到 100 kHz,电解质溶液为5 mmol·L[Fe(CN)]/[Fe(CN)],支持电解质为 0.1 mol·LKCl.
2 结果与讨论
2.1 电沉积纳米金条件优化
牛淑妍等对电沉积制备金纳米粒子的生成机理进行了详细的探究.笔者考察了电沉积时间、电位对电极表面形貌的影响,结果如图1,2所示.

图1 不同沉积时间电极的扫描电子显微镜图 ((a),(b),(c),(d),(e)沉积时间分别为480,600,720,840,900 s)

图2 不同沉积电位电极的扫描电子显微镜图 ((a),(b),(c)沉积电位分别为-1.0,-1.5,-2.0 V)
-1.5 V电位下电沉积制备纳米金粒子,在沉积时间相对短时 (480 s,图1(a)),电极表面的金纳米粒子较为松散,颗粒较小,这可能是由于金纳米颗粒是以氢气泡作为模板生长且处于生长初期;沉积时间600 s (图1(b))时,电极表面金颗粒大小基本相同,直径约为100 nm,且均匀分布;当电沉积时间增至720,840 s(图1(c)~(d))时,电极表面的金纳米颗粒随着时间的延长而增密,并趋向形成均匀膜;当时间增至900 s时,从图1 (e)可以明显看出,所形成的致密的金膜完全覆盖在电极表面.另一方面,固定沉积时间为600 s,电位为-1.0 V时 (图2(a)),电极表面金纳米颗粒分布相对密集,这可能是由于施加相对较小的电位,氢气泡过小,因此金纳米粒子也随之较小;当施加-1.5V的电位(图2(b))时,电极表面金纳米颗粒分布明显均匀,且粒子大小基本相似;随着施加的电沉积电位增大至-2.0 V(图2(c)),修饰电极表面上的纳米粒子随之增大,且稀疏松散.
进一步通过金的氧化峰可以考察修饰电极活性面积.利用修饰电极在0.5 mol·LHSO中的线性扫描伏安曲线峰电流来评估相对活性面积,结果如图3所示.
由图3可推断出沉积时间为480,600,720,840 s制备的纳米金修饰电极的比表面积分别是裸金电极的5.5,7.78,6.44,4.37倍.-1.0,-1.5,-2.0 V制备的金纳米粒子修饰电极的表面积与裸金电极相比,分别是其的4.75,7.78,4.49倍(如图4所示).因此,选取-1.5 V电位、沉积时间600 s为最佳实验条件.

图3 不同沉积时间电极的线性扫描伏安曲线

图4 不同沉积电位电极的循环伏安曲线
2.2 Hg2+传感界面构筑
在AuNPs修饰电极表面自组装ssDNA,制备ssDNA/AuNPs/Au界面.Hg存在下,Hg与T碱基之间的特异性结合可以使平行的ssDNA从直线形结构转变为发卡结构.Th具有芳环状平面结构且带有正电荷,Th与DNA相互作用时,两者之间的电子云会发生重叠,形成离域Π键.即便Th可与DNA带负电的磷酸骨架发生小部分的静电吸引,但仍以嵌入DNA双螺旋结构内的模式为主(即发卡结构),因此,利用这种发卡结构可有效捕获电活性分子Th,从而实现Hg的分析检测.
然而当ssDNA构象转变为发卡结构,空间位阻斥力显著增加,导致部分不稳定的ssDNA链从电极表面解析,使得AuNPs暴露在电极表面,如图5所示.基于传感器的灵敏度和选择性的考虑,须采用BSA封闭暴露的AuNPs,避免Th直接吸附在AuNPs上产生干扰.
图6为不同修饰界面吸附Th后,在pH=7.4PBS缓冲溶液中的差分脉冲伏安图.
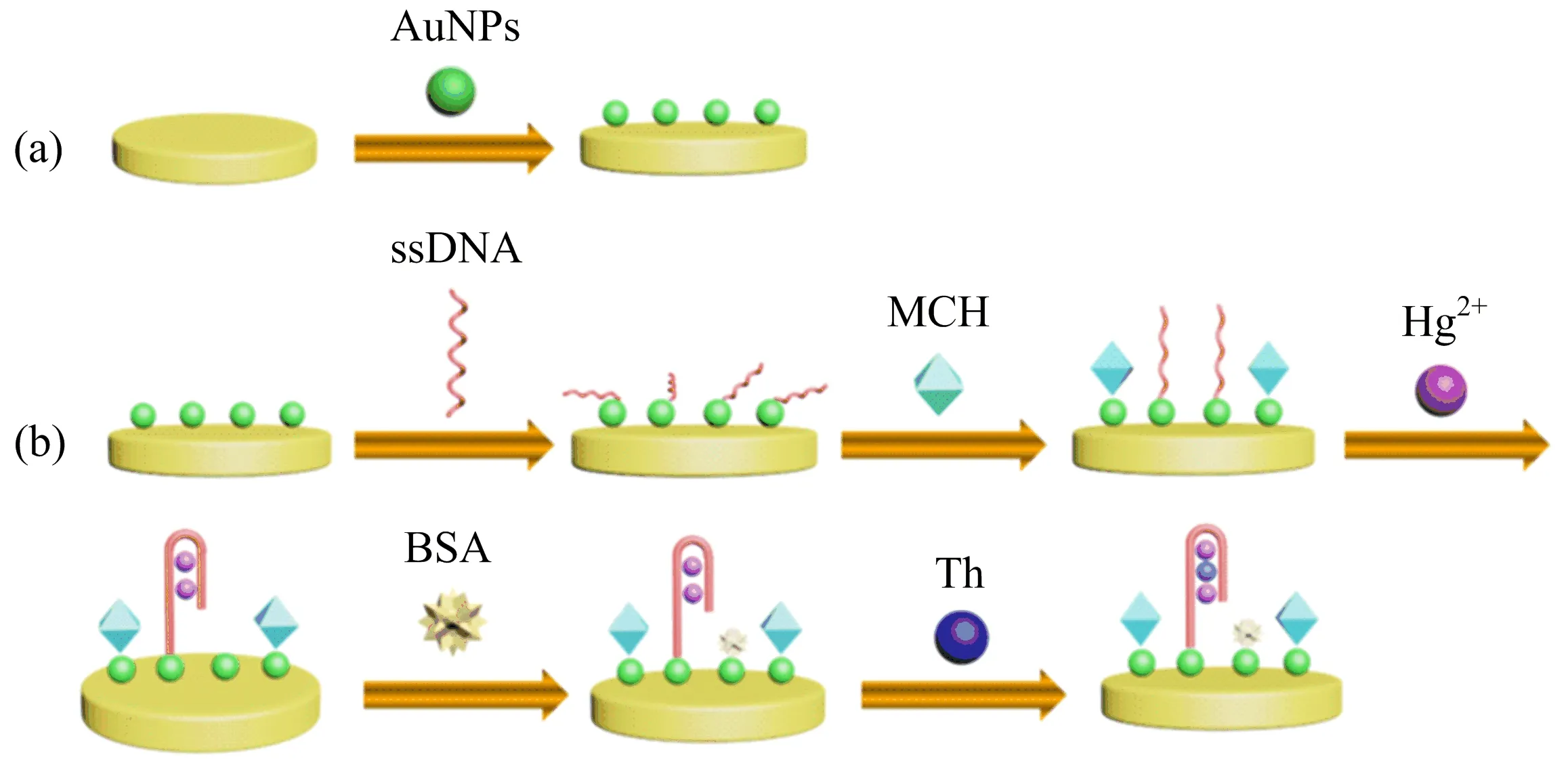
图5 AuNPs/Au 电极的制备(a)及电化学传感器制备过程示意图(b)
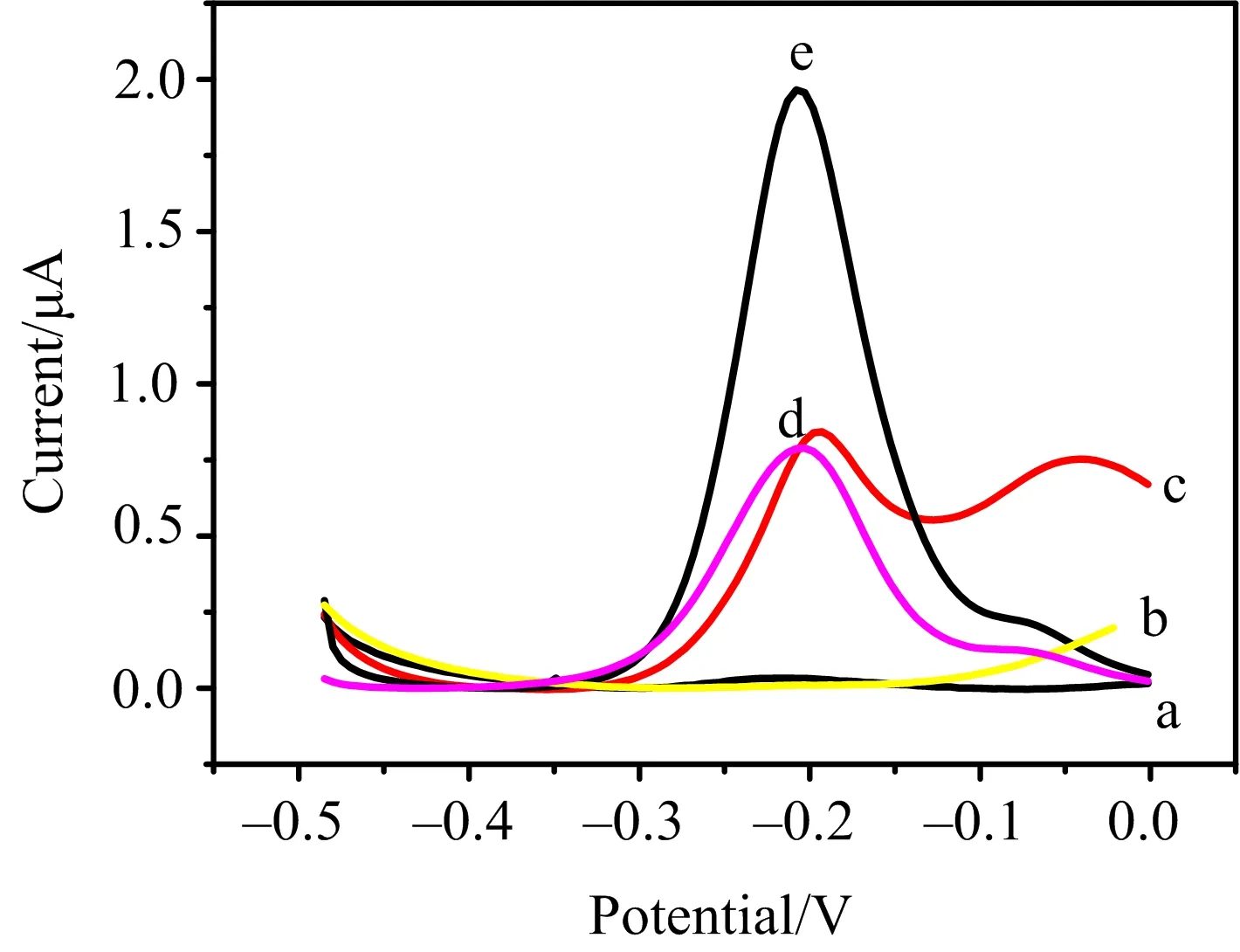
曲线a为AuNPs/Au,b为Th/BSA/AuNPs/Au,c为Th/AuNPs/Au,d为Th/BSA/ssDNA/AuNPsAu,e为Th/BSA/Hg2+/ssDNA/AuNPs/Au.图6 各电极的差分脉冲伏安图
图6中曲线a为AuNPs/Au电极未经吸附Th在缓冲溶液中的实验结果,表明实验条件下,AuNPs/Au电极无电化学信号.对比曲线b与c可以发现,当采用BSA封闭剂,-0.2 V氧化峰(归属于吸附的Th氧化峰)消失,表明BSA可有效抑制AuNPs与Th的相互作用.图6中-0.04 V的氧化峰可能是Th与金纳米粒子之间产生Au-S共价键的特征峰.图6中的曲线d,e分别为Hg加入前后的DPV图,从图中可以看出,Hg加入前ssDNA为直链状,Th只能静电吸附在ssDNA骨架表面,加入Hg后ssDNA发生自折叠,大量的Th嵌入DNA双螺旋结构,峰电流值明显增大.以上结果显示,Th与DNA之间具有两种作用形式,即嵌入和静电吸附作用.
利用EIS监测电极表面修饰过程的阻抗,结果如图7所示.

曲线a为AuNPs/Au,b为ssDNA/AuNPs/Au,c为MCH/ssDNA/AuNPs/Au,d为Hg2+/MCH/ssDNA/AuNPs/Au,e为BSA/Hg2+/MCH/ssDNA/AuNPs/Au.图7 各电极的阻抗图
从图7可以清楚地看出,AuNPs/Au电极的半圆 (曲线a)非常小,这可能是由于修饰后的电极具有更大的比表面积和更多的活性位点,促进了电子的传递和转移.当ssDNA通过5′端修饰的巯基固定在工作电极表面时,电阻变大 (曲线b),这是由于其磷酸骨架上的负电荷阻碍阻抗液中负离子在电极表面的电子转移,使得阻抗值增大到2.3 kΩ,表明ssDNA成功固定到了电极表面.为了使DNA链向溶液表面伸直,便于柔性DNA链结构由直链状向发卡状转变,同时初步封闭可能暴露的金纳米电极表面,吸附MCH于电极表面,电阻值随之变大,约为3.5 kΩ (曲线c),Hg修饰后,电阻值进一步增大至4 kΩ左右(曲线d).这是因为DNA上T碱基可以捕获溶液中Hg形成稳定的T-Hg-T结构,使平行的ssDNA从线形结构变为发卡结构,电极表面的液膜厚度和电阻随之增加.由于ssDNA构象变化,导致空间位阻斥力增强,部分DNA分子从电极表面释放造成AuNPs暴露,滴加BSA溶液于电极表面,电阻值又增大 (曲线e),说明电极表面已经被彻底封闭.
2.3 实验条件优化
为了提高所构建的电化学生物传感器的性能,固定其他实验条件,改变某一变化量,进行一系列的实验条件优化,包括Hg孵化温度、Hg孵化时间及Th滴加量.
Hg孵化温度是影响传感器信号响应的重要因素之一.先将ssDNA固定在电极表面,滴加20 μL的Hg溶液于电极表面后分别置于20,30,40,50,60 ℃ 环境内反应相同的时间,随后用PBS缓冲溶液、二次水反复冲洗电极表面可能残留的Hg,氮气吹干,再滴加相同体积的Th反应1 h后进行DPV实验.从图8 (a)可以看出,实验温度在20 ℃ 至50 ℃ 的范围内,电流随着温度的增加而增加.在孵化温度为50 ℃ 时,电化学生物传感器的峰值电流达到最大值,这可能由于在相对高的温度下DNA上的T碱基更快地捕获溶液中的Hg,生成稳定的T-Hg-T结构,直链DNA更迅速地转变为发卡状.继续增加孵化温度至60 ℃,峰值电流开始下降.这可能是因为过高的温度会影响传感器的结构和性能.以下实验采用50 ℃为孵化温度.
Hg孵化时间是影响电化学生物传感器性能的另一个重要参数.50 ℃条件下Hg孵化时间对峰电流的影响结果如图8(b)所示.在最开始的3~10 min内,峰值电流随着Hg孵化时间的延长而快速增加.并且在接下来的一段时间内峰值基本稳定.综合考虑检测灵敏度和检测速度,选择10 min为最优孵化时间.
进一步考察了Th 用量对电化学生物传感器的特征峰电流影响,如图8 (c)所示.在Hg最佳孵化条件下,分别滴加1.0,1.5,2.0,2.5,3.0 μL Th于已修饰的电极表面并置于4 ℃ 条件下1 h,在-0.5~0 V电位区间内,氧化峰值电流随着Th的体积量从1到2 μL迅速增加,然后在2 μL后达到基本稳定,表明2 μL Th已经基本饱和.

图8 孵化温度(a)、孵化时间(b)及硫堇体积量(c)实验条件的优化图
2.4 电化学生物传感器的灵敏度
随着待测溶液中Hg浓度的增加,DNA上T碱基更多地捕获溶液中Hg,导致柔性的DNA直链发生自折叠,转变为发卡状,有利于Th插入DNA双链内部.在最优实验条件下,利用DPV检测Th的嵌入量进而探究所搭建DNA传感器的灵敏度.如图9,10所示,在10~100 nmol·L范围内,DPV的氧化峰值随Hg浓度的增加而增大,线性拟合方程为ΔI
=0.
919logc
-0.
662(R
=0.991),检出限为7.42 nmol·L(S
/N
=3).
图9 不同浓度(a~f: 0, 10, 25, 50, 75, 100 nmol·L-1)Hg2+电极的差分脉冲伏安图图10 峰电流相对变化率(ic-i0) 与 Hg2+浓度对数(lgc(Hg2+))的关系
将所构建的用于检测金属Hg的DNA传感器的分析性能与先前研究中报道的其他Hg分析方法进行了比较,如表1所示.

表1 搭建的传感器与已报道的分析方法比较
结果表明,笔者所制备的传感器具有较低的检测限.因此,AuNPs是一种作为搭建生物传感器的优良纳米材料,可用于检测饮用水或环境中的重金属离子.
2.7 电化学生物传感器的选择性
为了评估所搭建生物传感器的离子选择性,在电极表面分别滴加20 μL 100 nmol·L的Hg或其他干扰离子(K,Ag,Cd,Pb,Al)溶液,置于相同环境下进行差分脉冲伏安实验,结果如图11所示,加入Hg的电极上氧化峰电流明显大于加入其他干扰离子的.其中,加入Ag的传感器的响应电流稍大于加入其他干扰离子的,这可能由于所设计的ssDNA序列中含有部分C碱基,加入Ag后会少量生成C-Ag-C结构,导致小部分ssDNA链由直线状转变为发卡状,随后少量Th也会相应插入其中,但是其氧化峰电流明显小于加入Hg的传感器.综上表明了笔者所制备的电化学生物传感器具有良好的选择性.

图11 生物传感器对Hg2+的选择性
3.8 电化学生物传感器在实际水样中的应用
通过实际水样的加标回收实验,对池塘水进行分析,以探讨该生物传感器的实际应用性.真实样品取自安徽大学磬苑校区,先静置一夜以除去大颗粒泥沙和浮物,再用0.22 μm过滤膜去除小直径沉积物,随后加入Hg(NO)固体,分别配置为含70,35,15 nmol·LHg的实际水样待测液.实验结果见表2所列,Hg的回收率为98.8%~102.8%,标准偏差为1.42%~7.08%.因此,说明了在实际水样的检测中使用所构建的生物传感器具有可行性.

表2 实际样品的测定结果和回收率
3 结束语
笔者基于特定T-Hg-T配位体的形成,开发了一种灵敏的检测Hg的电化学生物传感器.首先,利用电沉积方法将金纳米颗粒长在平板电极表面,以方便增加DNA单链的引入量,然后在较高温度下加入Hg导致直链DNA更迅速地自折叠,最后通过DPV确定Th嵌入量,以获得Hg含量.与传统的Hg检测传感器相比,所构建的金纳米颗粒传感器可以实现Hg的灵敏检测,具有较好的选择性.

