1株潞党参根部内生细菌的鉴定及促生长指标测定
白变霞 窦旭峰 刘荣 李蓉 任嘉红


摘要:党参[Codonopsis pilosula (Franch.) Nannf.]是我国传统的中药材之一,具有重要的药用价值。潞党参作为山西省的一种重要道地药材,主要产自山西省长治地区。从潞党参根部内部分离出1株内生细菌DS-3菌株,经形态学观察、生理生化指标测定及16S rRNA测序并构建系统发育树,鉴定为Pseudomonas corrugate;对菌株产吲哚乙酸(IAA)、产铁载体、产氢氰酸(HCN)、溶磷及固氮能力进行测定,结果显示该菌株产IAA能力为18.77 μg/mL,产铁载体能力为68%,对有机磷的解磷率为40.2%,同时还具备一定的固氮与产HCN能力。综上可见,菌株DS-3具有一定促生能力,该菌株可作为后续研发微生物菌肥的菌种资源。
关键词:潞党参;内生细菌;鉴定;促生能力
中图分类号: S182文献标志码: A
文章编号:1002-1302(2021)12-0196-05
收稿日期:2021-03-05
基金项目:山西省高等学校大学生创新创业训练计划(编号:2019600)。
作者简介:白变霞(1987—),女,山西汾阳人,博士,讲师,主要从事根际有益微生物的研究。E-mail:baibianxia08@126.com。
通信作者:任嘉红,博士,教授,主要从事微生物学的相关教学与科学研究。E-mail:renjiahong76@hotmail.com。
党参作为常用的大宗药材,药用时间较为悠久,因其具有健脾、益气、补血等补益功效,可作为人参的替用品[1]。根据产地的不同,党参可主要划分为产于甘肃省、四川省西北部、陕西省汉中市一带的素花党参,产于四川省、湖北省、陕西省交界的条党参,产于东北一带的东党参,产于山西省长治市的潞党参。山西省长治市为潞党参的发源地,该地区平顺县产的潞党参被认定为我国农产品地理标志保护产品[2]。目前,为满足市场的需求,潞党参主要通过人工种植。在人工种植过程中,药农通过施用化肥来提高潞党参的产量。长期施用化肥会导致土壤出现酸化、板结等现象,影响植株对营养成分的吸收,同时也影响植株根际土壤的微生物群落结构,最终导致减产[3-4]。近年来,微生物肥料因其能对植株生长起到促进调节作用,同时安全与环保,正逐步成为化学肥料的替代品[5]。
内生细菌能够通过植物的根或地上部分(子叶、叶片、花、茎)进入植物组织内部存活,但是不会导致宿主植物出现明显的病害症状[6-7]。一些内生细菌能够与植物建立互利共生关系,可对植物产生促生作用,并提高抗逆性,这类内生细菌通常被称为有益内生细菌[8]。植株在生长过程中,土壤通常会缺乏足够量的1种或多种养分供植物生长所需,有益内生细菌可以帮助寄主植物获得更多的限制性植物营养物质,包括氮、磷、钾、铁等[9]。近年来的研究表明,有益内生细菌分泌的5种类型植物激素[脫落酸、细胞分裂素、乙烯、赤霉素、吲哚乙酸(IAA)]可加强植物营养物质的积累与代谢[10]。此外,有益内生细菌产生的一些次级代谢产物如抗生素、铁载体、水解类酶、挥发性有机物等可拮抗植物病原菌,部分还可诱导植物产生系统诱导抗性,提升植物的抗病能力,间接地促进宿主植物的生长[11]。综上可知,植物有益内生细菌能够有效地定殖于植物体内,并对植物生长代谢发挥积极作用,因此具有较大的潜能被开发为生物菌肥和生物农药[12]。
本研究以前期试验中从潞党参根内部分离得到的1株内生菌株DS-3为研究对象,首先对其形态特征、生理指标、及16S rRNA序列进行分析与鉴定;其次对该菌株的相关促生指标解磷、固氮、产IAA、产铁载体、产氢氰酸(HCN)等能力进行测定。本研究以期为课题组后续开发应用于党参的微生物肥料提供潜力菌株,为推广微生物菌肥在党参的人工绿色种植提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源
菌株DS-3为笔者所在课题组于2019年从山西省长治市平顺县潞党参根部分离所得,该菌株现保藏于笔者所在实验室。
1.1.2 培养基
LB培养基、King液体培养基、CAS检测平板、MKB培养基、NBRIP培养基、蒙金娜基础培养基、卵磷脂培养基、Ashby固氮培养基[13]。
1.2 试验方法
1.2.1 菌株的鉴定
将活化的菌株DS-3划线接种于LB固体培养基进行培养,参照《常见细菌系统鉴定手册》[14]对菌株的菌落形态及相关的生理生化特征进行观察与分析。
采用修改的十六烷基三甲基溴化铵(CTAB)法提取菌株的基因组DNA,将其作为模板,经细菌16S rRNA基因的通用引物FW(5′-AGAGTTTGATCCTGGCTCAG-3′)和RV (5′-AAGGAGGTGATCCAGCCGCA-3′)进行 25 μL体系的PCR扩增,扩增程序为94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃ 7 min。
PCR扩增产物经1.5%的琼脂糖凝胶电泳进行检测,将大小约 1 600 bp 的条带进行纯化回收,并与pMD-19 T-simple载体连接,转化至大肠杆菌JM-109感受态细胞,挑取阳性克隆送至华大基因完成测序。将所得测序结果经NCBI与EzTaxon server数据库进行比对,使用MEGA 5.0软件构建系统发育树。
1.2.2 溶磷能力的测定
吸取5.0 μL过夜活化的菌液分别点接于蒙金娜基础培养基和NBRIP培养基,30 ℃培养7 d,观察解磷圈,判断其是否具有解磷能力。采用钼锑抗比色法测定有效磷的含量,计算菌株的溶磷率[15]。
1.2.3 产IAA能力的测定
将菌株DS-3接种于LB液体培养基,向其中加入L-色氨酸,终浓度为100 mg/L,30 ℃、180 r/min培养72 h,对菌液的D600 nm进行测定后离心菌液(10 000 r/min、10 min),参照Glickmann等的方法测定上清液中IAA的产量,同時用IAA标准品绘制其浓度与吸光度标准曲线,用以计算样品中的IAA含量[16]。以未接种菌株的培养基作为对照,每组处理重复3次。
1.2.4 产铁载体能力的测定
参照Schwyn等的方法[17],取5 μL菌液点接于CAS 检测平板上,30 ℃ 静置培养72 h,观察菌落周围是否产生黄绿色晕圈,如产生,则表示该菌株可分泌产铁载体,从而对其产铁载体能力进行定量测定。将活化好的菌液接种于MKB液体培养基(30 mL)中,30 ℃、180 r/min 培养 24 h,于10 000 r/min、4 ℃离心 15 min,吸取上清液与等量 CAS 染液混匀,常温条件反应1 h,以未接种的 MKB 液体培养基作为空白对照,计算铁载体的相对产量。
1.2.5 产HCN能力的鉴定
过夜活化后的菌液涂布于含甘氨酸(终浓度4.4 g/L)的PDA固体培养基上,将浸有苦味酸溶液的无菌滤纸贴于培养皿的皿盖上,用封口膜将培养皿封住,30 ℃静置培养48 h,以涂布未接种的培养液作为空白对照组[18]。通过观察空白组与试验组之间无菌滤纸颜色的变化来鉴定菌株是否具有产HCN的能力。
1.2.6 固氮能力的鉴定
将过夜活化的菌株LB液体培养基点接至无氮固体培养基上,30 ℃倒置培养3~5 d,观察菌株能否在培养基上存活生长,若能,则证明该菌具有固氮能力。
2 结果与分析
2.1 菌株DS-3的鉴定
菌株在培养基上形成的菌落为边缘整齐的圆形,表面湿润,有光泽,不透明,颜色为浅黄色。生理生化测定结果显示菌株DS-3为革兰氏阴性菌(G-)。KOH、接触酶、需氧性、氧化酶和卵磷脂酶试验均为阳性,淀粉水解、吲哚、伏普、纤维素分解及甲基红试验均为阴性。
菌株DS-3的16S rRNA基因扩增条带经电泳鉴定,大小正确,约为1 600 bp。将测序所得序列在NCBI和EzBioCloud 2个数据库中比对,比对结果显示菌株DS-3 与菌株Pseudomonas corrugata的同源性达到99.37%。经MEGA-X构建系统发育树,由图1可知,菌株DS-3与模式菌株P. corrugata处于同一分支上,其自展值为94%,说明菌株DS-3为P. corrugata的另外一种亚种,与系统发育树中这2种菌株不完全相同。结合该菌株表现出的形态特征和生理生化试验结果,将其鉴定为P. corrugata。
2.2 菌株的促生能力
2.2.1 解磷能力
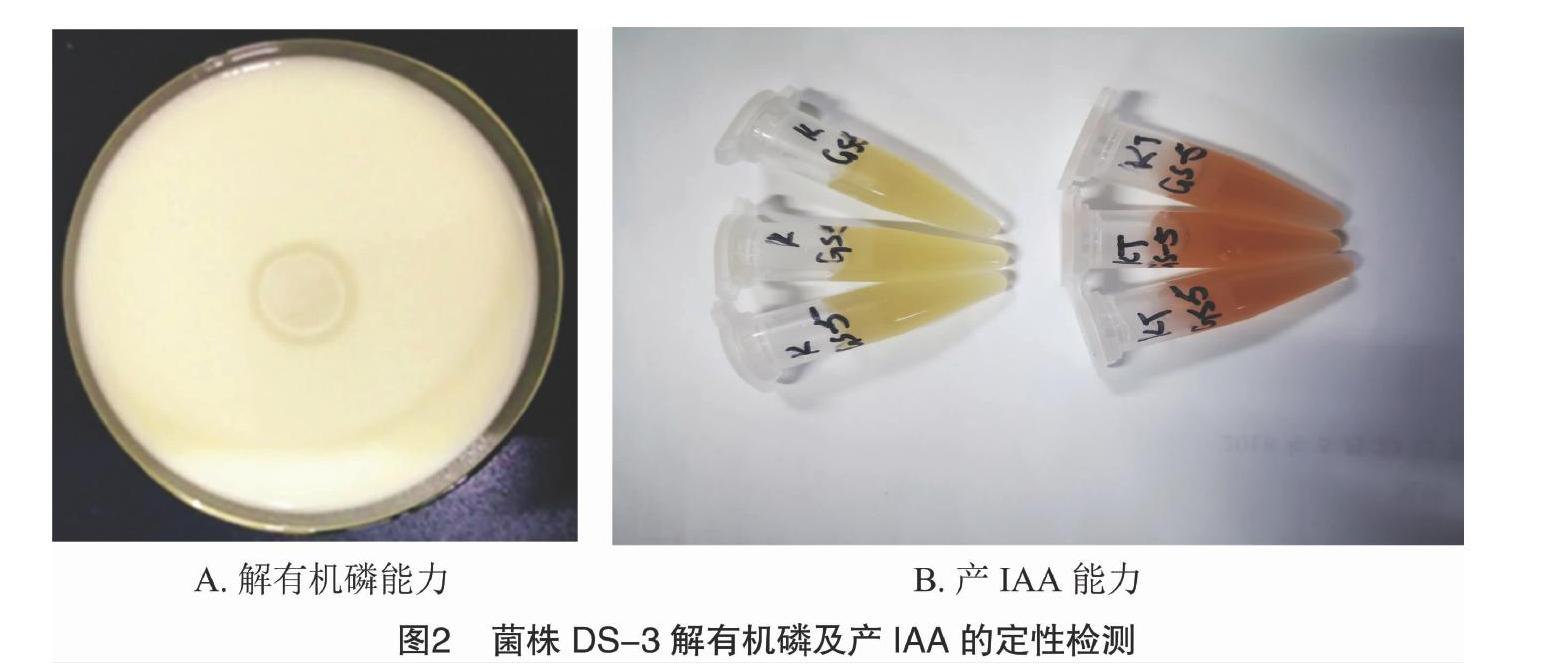
在有机磷平板上点接菌液培养72 h后,由图2-A可知,在菌株DS-3的菌落周围出现了明显的透明圈,说明该菌株具有溶解有机磷的能力。对该菌株的解磷能力进行定量检测,菌株在液体解磷培养基中培养7 d后,解磷率为40.2%。由此可见,该菌株对土壤中的有机磷能发挥一定的解磷能力。
2.2.2 产IAA能力
采用Salkowski比色法对菌株产IAA能力进行定性定量分析,由图2-B可知,该菌株可使反应液变红,可见该菌株在生长过程中可分泌IAA。定量结果表明,该菌株在培养72 h后,IAA的分泌量为18.77 mg/L,可见菌株DS-3具有较强分泌IAA的能力,可能会对潞党参根部的生长起促生调节作用。
2.2.3 产铁载体能力的鉴定
在CAS平板上点接菌株DS-3静置培养72 h后,菌落周围出现明显的橙色晕圈(图3-A),说明该菌株可合成并向外界环境中分泌铁载体,这有利于菌株处于低铁条件时从外界有效获取Fe2+。由图3-B可知,培养24 h后,上清液中的铁载体相对含量可达68%,且在菌株DS-3培养12 h前,铁载体的产量随着培养时间的延长不断积累,培养12 h后,其产量进入稳定状态。可见该菌株具有较强的分泌铁载体能力。
2.2.4 固氮能力的鉴定
土壤中的氮通常约95%都是以有机氮的形式存在,不能被植物直接利用[20]。具有固氮能力的细菌能够将空气中的氮气还原为可被植物直接吸收利用的铵态氮,从而对植物生长起到促进作用[21-22]。将菌株DS-3接种于不含氮源的无氮培养基上,培养3 d后,在培养基上可见明显的菌落(图4-A),可见该菌株可以固定大气中的氮源,具备固氮能力,提升土壤中植物可利用的氮含量,从而发挥促生作用。
2.2.5 产HCN能力的鉴定
HCN能够通过阻断电子传递,干扰需氧呼吸作用,从而抑制病原微生物的正常生长[19]。由图4-B可以看出,接种菌株DS-3的培养皿中,蘸有苦味酸的滤纸由黄色变为浅棕色,说明菌株DS-3能够利用甘氨酸作为底物,将其氧化生成HCN。因此,菌株DS-3可通过生成HCN来拮抗党参根际的病原微生物。
3 结论与讨论
目前,从不同种类植物中分离出的内生细菌种类丰富,已被研究报道的有假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、肠杆菌属(Eterobacter)、克雷伯氏菌属(Klebsiella)、沙雷氏菌属(Serratia)、不动杆菌属(Acinotobacter)等[23]。这些菌属通常也会存在于植物根际土壤中,因此,有学者认为内生细菌可能是植物根际栖息细菌的一个亚种群[24]。植物根际促生细菌(plant growth promoting bacteria,简称PGPB)主要源自内生细菌与根际土壤细菌,但二者之间的主要区别是内生的PGPB,一旦它们在植物组织中共生,便不会受到外界土壤环境变化(温度、pH值、含水量等)的影响,但是这些变化却会影响根际PGPB的功能、增殖以及与寄主植物的结合等[25]。因此,可推断内生的PGPB对宿主植物的促生作用更为稳定。
本研究从药用植物潞党参根部筛选得到的内生促生细菌DS-3,经菌落形态特征、生理生化特征以及16S rRNA基因等进行鉴定后,鉴定结果为P. corrugata。结合已有文献报道,内生的PGPB不仅能够促进宿主植物生长,提高宿主植物的抗逆性,还能够使宿主植物对競争植物产生化感作用[26]。因此本研究对菌株DS-3的促生特性进行了研究,研究结果表明,该菌株具有溶磷、产IAA、产铁载体、产HCN以及固氮多种促生能力。其中菌株的溶磷与固氮能力能够直接帮助植株摄取营养物质,菌株分泌的IAA可以直接调节植物的生长,因此这些机制被认为是菌株对植株的直接促生作用;而通过分泌铁载体与病原微生物竞争有限的铁离子,及通过产生HCN阻断病原微生物的需氧呼吸,从而对病原微生物产生拮抗作用而有利于植株生长的促生机制被认为是对植株的间接促生作用[23]。因此可推断菌株P. corrugate DS-3可对潞党参发挥直接与间接促生作用,可作为后续开发微生物菌肥的优良菌株。Shidore等将水稻根系渗出液作用于其内生细菌,发现内生细菌基因组中与根际竞争作用相关的基因出现表达上调,并对相关功能基因进行了诱导突变,该研究结果推断植物根系分泌物可以诱导内生细菌的定殖[27]。综合课题组前期对潞党参根际促生细菌的分离筛选工作,发现目前筛选得到的潞党参根部内生细菌与根际土壤细菌多为假单胞菌属。因此,后续的研究工作一方面将菌株P. corrugate DS-3接种于潞党参幼苗,对其接种效应进行研究,另一方面可探究潞党参根系分泌物对菌株P. corrugate DS-3及前期分离的其他假单胞菌株在潞党参根部及根际定殖的诱导效应,为开发适用于党参人工种植的微生物菌肥提供研究基础。
参考文献:
[1]杨鹏飞,楚世峰,陈乃宏. 党参的药理学研究进展及其抗脑缺血再灌注损伤的机制[J]. 湖南中医药大学学报,2015,35(12):5-10.
[2]卢燕林,张 强,李彩萍,等. 地道潞党参营养特性与产地土壤特征研究[J]. 山西农业科学,2007,35(5):42-45.
[3]Alami M M,Xue J Q,Ma Y T,et al. Structure,function,diversity,and composition of fungal communities in rhizospheric soil of Coptis chinensis Franch under a successive cropping system[J]. Plants,2020,9(2):244.
[4]王玲玲,韩京龙,李 岩,等. 人参土壤养分含量变化与改良效果研究[J]. 人参研究,2015,27(03):18-21.
[5]Botelho G R,Cristina M H L. Fluorescent pseudomonads associated with the rhizosphere of crops an overview[J]. Brazilian Journal of Microbiology,2006,37(4):401-416.
[6]Christina A,Christapher V,Bhore S J. Endophytic bacteria as a source of novel antibiotics:an overview[J]. Pharmacognosy Reviews,2013,7(13):11-16.
[7]Staniek A,Woerdenbag H J,Kayser O. Endophytes:exploiting biodiversity for the improvement of natural product-based drug discovery[J]. Journal of Plant Interactions,2008,3(2):75-93.
[8]Afzal I,Shinwari Z K,Sikandar S,et al. Plant beneficial endophytic bacteria:mechanisms,diversity,host range and genetic determinants[J]. Microbiological Research,2019,221:36-49.
[9]Gupta G,Panwar J,Jha P N. Natural occurrence of Pseudomonas aeruginosa,a dominant cultivable diazotrophic endophytic bacterium colonizing Pennisetum glaucum (L.) R. Br. [J]. Applied Soil Ecology,2013,64:252-261.
[10]Phetcharat P,Duangpaeng A. Screening of endophytic bacteria from organic rice tissue for indole acetic acid production[J]. Procedia Engineering,2012,32:177-183.
[11]Sheoran N,Nadakkakath A V,Munjal V,et al. Genetic analysis of plant endophytic Pseudomonas putida BP25 and chemo-profiling of its antimicrobial volatile organic compounds[J]. Microbiological Research,2015,173:66-78.
[12]Chebotar V,Malfanova N V,Shcherbakov A V,et al. Endophytic bacteria in microbial preparations that improve plant development (review)[J]. Appllied Biochemistry and Microbiology,2015,51(6):732.
[13]张 烨,廖 怡,陈尚武,等. 文冠果一、二年省植株根系内生菌的分离、鉴定和固氮活性[J]. 植物生态学报,2010,34(7):839-844.
[14]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[15]晋婷婷,任嘉红,刘瑞祥. 南方红豆杉根际解有机磷细菌的鉴定及其解磷特性和促生作用研究[J]. 西北植物学报,2016,36(9):1819-1827.
[16]Glickmann E,Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology,1995,61(2):793-796.
[17]Schwyn B,Nielands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry,1987,160:47-56.
[18]陈庆河,翁启勇,何玉仙,等. 大白菜健、病株根际细菌荧光反应及产HCN能力比较研究[J]. 福建农业学报,1998,13(2):30-32.
[19]Neerincx A H,Mandon J,Ingen J V,et al. Real-time monitoring of hydrogen cyanide (HCN) and ammonia (NH3) emitted by Pseudomonas aeruginosa [J]. Journal of Breath Research,2015,9(2):27102.
[20]吳 凡,张 楠,张莎莎,等. 桑树根际固氮细菌的分离鉴定及固氮酶活力测定[J]. 蚕业科学,2008,34(3):387-392.
[21]郑红丽,李少红,樊明寿,等. 四种牧草根际固氮细菌的分离及固氮活性的研究[J]. 干旱区资源与环境,2007,21(4):164-169.
[22]林标声,陈 意,罗茂春,等. 巨菌草内生固氮菌Klebsiella variicola GN02的毒理性与固氮能力[J]. 江苏农业科学,2019,47(24):258-261.
[23]Santoyo G,Moreno-Hagelsieb G,Orozco-Mosqueda M D C,et al. Plant growth-promoting bacterial endophytes[J]. Microbiological Research,2016,183:92-99.
[24]Marquez-Santacruz H A,Hernández-León R,Orozco-Mosqueda M D C,et al. Diversity of bacterial endophytes in roots of Mexican husk tomato plants (Physalis ixocarpa) and their detection in the rhizosphere[J]. Genetics and Molecular Research,2010,9(4):2372-2380.
[25]Glick B R. Plant growth-promoting bacteria:mechanisms and applications[J]. Scientifica,2012:963401.
[26]Cipollini D,Rigsby C M,Barto E K. Microbes as targets and mediators of allelopathy in plants[J]. Journal of Chemical Ecology,2012,38:714-727.
[27]Shidore T,Dinse T,hrlein J,et al. Transcriptomic analysis of responses to exudates reveal genes required for rhizosphere competence of the endophyte Azoarcus sp. strain BH72[J]. Environmental Microbiology,2012,14(10):2775-2787.

