一种实时荧光定量PCR方法鉴定野鸟中禽流感病毒方法的建立
杨国祥 周豪 朱功良 李勇 蔡华锐 张俊 陈婧 陈光 冯伟 陈全姣

摘 要: 为满足高通量快速检测野鸟中禽流感病毒的需要,本研究针对A型流感病毒M基因保守区域设计了一对引物和探针,建立了一种能够检测A型禽流感病毒的实时荧光定量PCR方法,并对该方法的灵敏性、特异性和稳定性进行了评估。结果显示,该方法相较于传統的鸡胚分离和RT-PCR方法,具有灵敏度高、特异性好和耗时短等优点,可用于检测野鸟中携带的禽流感病毒。
关键词: 禽流感病毒;野鸟;荧光定量RT-PCR
中图分类号:S851.3文献标识码:A文章编号:1004-3020(2021)03-0035-05
野生鸟类作为禽流感病毒(Avian influenza virus,AIV)的天然宿主,在流感病毒的贮存、传播和变异中发挥着重要作用。所有亚型AIV均能从野鸟体内分离,它们携带病毒,但一般不表现出临床症状,并且可以通过迁徙将流感病毒扩散至世界各地。从家禽和哺乳动物体内分离到的流感病毒均直接或间接来自野鸟,对家禽养殖业和公共卫生安全造成了严重威胁,因此建立科学快速的诊断方法显得尤其重要。传统的流感病毒分离鉴定方法面临着耗时长等缺点,因此建立一种更加快速、准确、灵敏的方法来检测野鸟中携带的流感病毒,对于流感病毒的监测与预警显得尤为重要。实时荧光定量PCR (Quantitative Real-time PCR,QPCR)技术以其快速、特异性强、灵敏度高,重复性好,全封闭反应等优点,被广泛应用于各种病原检测中。本研究基于A型AIV中高度保守的M基因作为检测靶点,建立了一种TaqMan探针实时荧光定量PCR方法,用于检测野鸟粪便样本中的流感病毒,既可以作为应急检测技术应对突发疫情,也可以用于对野鸟携带的流感病毒进行常规检测。
1 材料与方法
1.1 试验材料
1.1.1 样品
本实验室鉴定保存的两株禽流感病毒标准株H6N1、H9N2鸡胚尿囊液各一份。100份野鸟粪便样本于2020年1月13日在湖北省黄梅县龙感湖采集,并于-80℃保存。
鸡传染性囊病病毒(IBDV),禽白血病病毒(ALV)来自华中农业大学。
1.1.2 试剂
病毒RNA/DNA提取试剂盒(购自西安天隆科技公司);DNA Marker DL2000(TAKARA);HiScript II One Step qRT-PCR Probe Kit(Vazyme);T7 High Yield RNA Transcription Kit(Vazyme);Endo-Free Plasmid Mini Kit II(Omega);Gel Extraction Kit(Omega);MicroElute RNA Clean Up Kit(Omega)。
1.1.3 仪器设备
荧光定量PCR仪(Bio-RadCFX96);全自动核酸提取仪(天隆GeneRotex96);移液器(德国Eppendorf公司);离心机( Eppendorf );琼脂糖水平电泳仪(DYCP-3ICN);PCR仪(TProfessional);漩涡混合器(VORTEX-2)。
1.2 试验方法
1.2.1 引物和探针的设计与合成
根据本实验室野鸟中分离到的流感病毒毒株序列设计了多对引物探针,并参考世界卫生组织(World Health Organization,WHO 2014)及中国国家流感中心(Chinese National Influenza Center,CNIC 2011)推荐的多对流感病毒引物和探针序列[7],通过比较几组引物和探针之后,从中选择了一组灵敏度最佳的引物探针。引物、探针均由武汉擎科生物有限公司合成,用无核酶水稀释至10 umol/L工作浓度,分装置-20℃保存备用,引物和探针序列见表1。
1.2.2 反应体系和反应条件优化
利用HiScript II One Step qRT-PCR Probe Kit(Vazyme)试剂盒,以A/Chicken/Hunan/8.27 YYGK3W3/2018(简称3W3)毒株核酸为模板对PCR反应体系和反应条件进行优化,选取ct值最小的反应条件。最终确定反应体系如下:2X One step Q probe mix,10 μl;One step Q Probe enzyme mix,1 μl;IAV-F(10 umol/L)和IAV-R(10 umol/L),0.4 μl;IAV-P(10 umol/L),0.2 μl;模板RNA 8 μl,总体系20 μl。反应条件如下:50℃逆转录,15 min;95℃预变性,30 s;95℃,10 s,60℃,30 s,共扩增45个循环。
1.2.3 标准曲线的建立及灵敏度评价
根据3W3毒株M片段基因组序列,在其M基因两端设计了一对引物,扩增M基因片段全长后克隆至PHW-2000载体T7启动子下游形成重组质粒,导入TOP10感受态细胞中进行扩增,使用Endo-Free Plasmid Mini Kit II(Omega)提取质粒并测序鉴定,设计了一段包含T7启动子序列的引物,扩增包含T7启动子及M片段的序列,使用Gel Extraction Kit(Omega)回收目的片段后用T7 High Yield RNA Transcription Kit(Vazyme)合成RNA标准品,用MicroElute RNA Clean Up Kit(Omega)试剂盒纯化RNA标准品,随后用酶标仪测定RNA浓度后计算拷贝数。将RNA标准品进行10倍梯度稀释至0.5×1012-0.5×101copies/μl,采用上述反应体系和条件对各稀释度的RNA标准品进行实时荧光定量PCR扩增。
1.2.4 特异性实验
将IBDV、ALV、H1N1(PR8)、H5N6、H6N1、H7N9、H9N2(3W3)病毒提核酸后作为模板,用已建立的方法对这些不同病毒的核酸进行qPCR扩增,检测该方法的特异性。
1.2.5 野鸟粪便检测
用本实验建立的方法对2020年1月13日在湖北省黄梅县龙感湖采集的100份野鸟样本进行荧光定量PCR检测,野鸟粪便样本保存于含10%甘油的PBS中(含0.25%的BSA和硫酸庆大霉素,10000U青霉素、20000U链霉素)。样品涡旋混匀后,4℃ 12 000 rpm离心5 min,取200 μl上清用病毒RNA/DNA提取试剂盒提取核酸后进行qPCR检测,每个样本设2个复孔。
2 结果与分析
2.1 引物与TaqMan探针的选择及反应体系的确定
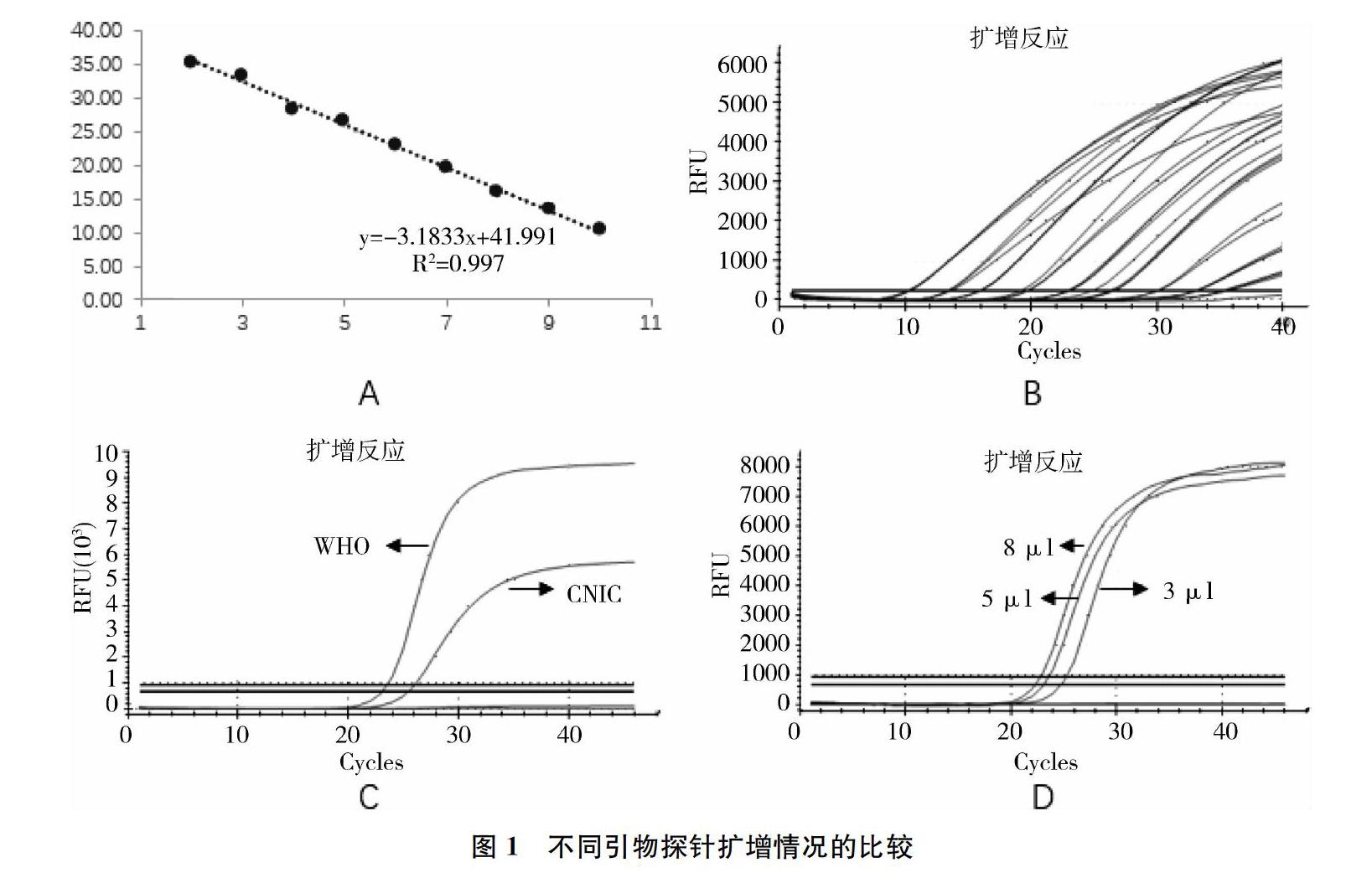
将实验室设计的引物探针(M-F190/M-R407/M-P213)扩增标准质粒后构建标准曲线,回归系数R2=0.997,扩增效率E=106.13%均满足标准曲线的相关参数范围(图1A),但是该引物探针的扩增曲线并不满足标准“S”型曲线,且随着质粒稀释度的增加,荧光信号强度显著降低(图1B),因此不利于后期检测结果的判读。随后将CNIC(M-F170/M-R250/M-P230)和WHO(M-F780/M-R860/M-P800)推荐的引物和探针进行了灵敏度比较,将同一流感病毒核酸分别加入上述两种引物探针所配的体系中进行扩增反应(体系中除了引物探针不同外,其它条件均一致),结果如图1C所示,WHO(M-F780/M-R860/M-P800)推荐的引物和探针的扩增曲线CT值和荧光强度均优于CNIC(M-F170/M-R250/M-P230)所推荐的引物探针。同一模板加入不同量后的扩增曲线如图1D所示,结果表明,当模板加入量为8 μl时,CT值明显低于5 μl和3 μl的模板投入量,因此确定体系中模板加入量为8 μl。
综上实验结果,选择WHO推荐的引物和探针(M-F780/M-R860/M-P800)进行后续实验。
2.2 特异性评价
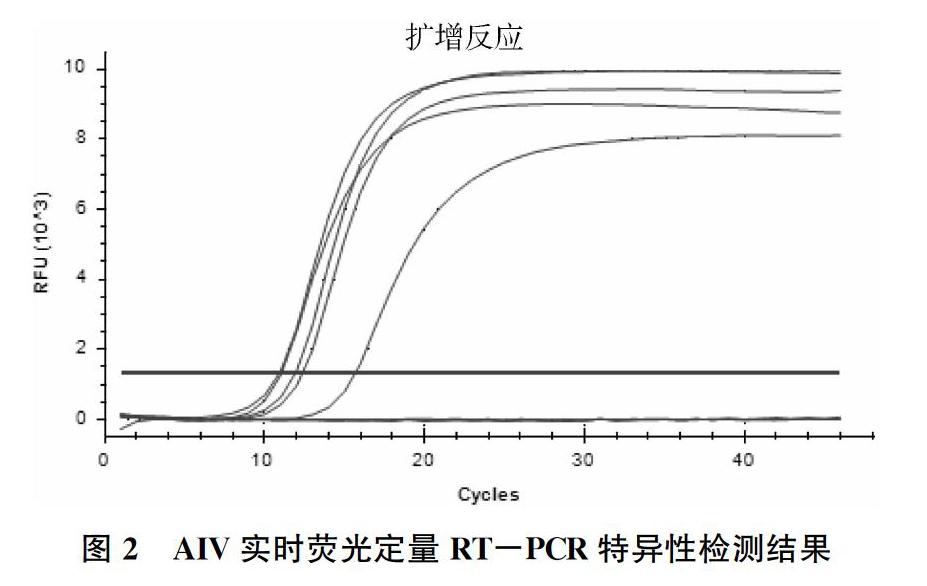
为检测WHO(M-F780/M-R860/M-P800)的特异性,分别用该引物扩增IBDV、ALV、H1N1(PR8)、H5N6、H6N1、H7N9、H9N2(3W3)病毒核酸,结果显示不同亚型的流感病毒均出现扩增曲线,而以IBDV及ALV核酸为模板,则未出现扩增曲线(图2),说明该方法对流感病毒均具有特异性。
2.3 标准曲线的建立
将3W3病毒株不同稀释度的RNA标准品作为模板进行qPCR扩增反应,模板浓度为1×1012-1×107copies/μl,每个稀释度做三个复孔,扩增曲线如图3所示。由标准曲线(图4)可知,标准曲线方程为:y = -3.8594x + 51.563,回归系数R2=0.9997,扩增效率为E=97.45%,扩增效率在90%~110%之间,标准曲线构建成立。
2.4 引物灵敏度评价
将RNA标准品进行10倍梯度稀释,使用WHO(M-F780/M-R860/M-P800)引物,模板浓度分别为1×1012-1×101 copies/μl,用该方法对每个稀释度进行检测,结果显示最低检测核酸拷贝数为100 copies/μl(图5)。
2.5 野鸟粪便样本的检测
将所建立的方法对100份野鸟粪便样本进行检测,将两个复孔CT值均小于40,且出现典型扩增曲线的样本判定为阳性样本。部分样本的检测结果如图6所示。100份野鸟样本中流感病毒核酸阳性样本数为14,因此本次采集样本流感病毒核酸阳性率约为14%。
3 结论与讨论
野鸟禽流感病毒的自然宿主,目前已从25个科100多种野鸟(包括野鸭、大雁、天鹅等)中分离到几乎所有亚型的禽流感病毒。野鸟的流感监测主要采集野鸟粪便,通过传统的鸡胚分离来监测禽流感病毒。由于传统的鸡胚分离法需要传代3次,耗时长且工作强度大,严重限制了野鸟携带AIV的监测效率。本研究拟在本试验建立一种高通量、灵敏度更高的检测方法来提高病毒检测效率。
试验数据表明,本研究建立的基于流感病毒M基因的实时荧光定量PCR检测方法具有良好的特异性,对多种亚型流感病毒均能特异性检出,而与其它病毒无交叉反应,而且该方法可以检测到最低拷贝数为1×102 copies/μl的病毒。建立的标准曲线显示,扩增效率为97.45%,可对野鸟粪便这类低病毒载量的样本进行定量检测。
本试验比较了不同引物对AIV的扩增效率,发现WHO网站公布的引物具有较好的扩增效率。同时,为使建立的荧光定量RT-PCR技术可以替代经典的鸡胚扩增法,对该引物的特异性和灵敏性进行了进一步的测试,对其中的实验细节和条件进行了摸索和优化。建立了标准曲线,方便对粪便中病毒进行绝对定量。与传统的鸡胚分离法相比,该方法具有更高的AIV阳性率,满足替代传统鸡胚分离方法的条件之一。但是否会存在漏检,即鸡胚分离阳性的样本是否全部为荧光定量RT-PCR技术阳性,由于测试的样本只有100份,还需更多数据的支撑。
参 考 文 献
[1]Yehia N,Naguib MM,Li R,et al.Multiple introductions of reassorted highly pathogenic avian influenza viruses (H5N8) clade 2.3.4.4b causing outbreaks in wild birds and poultry in Egypt[J].Infect Genet Evol.2018;58:56-65.doi:10.1016/j.meegid.2017.12.011.
[2]葛葉.2014-2015年间中国安徽省野鸟源禽流感病毒的流行病学监测和致病性评价[D].哈尔滨:东北林业大学,2016.
[3]张兰兰.野鸟源H6N2亚型和H11N9亚型AIV分离株的基因特征及遗传进化分析[D].哈尔滨:东北林业大学,2010.
[4]范胜涛.野鸟禽流感监测及哺乳动物跨种传播能力评估[D].北京:北京协和医学院,2014.
[5]Munster VJ,Baas C,Lexmond P,et al.Practical considerations for high-throughput influenza A virus surveillance studies of wild birds by use of molecular diagnostic tests[J].J ClinMicrobiol.2009;47(3):666-673.
[6]Le TB,Kim HK,Na W,et al.Development of a Multiplex RT-qPCR for the Detection of Different Clades of Avian Influenza in Poultry[J].Viruses.2020;12(1):100.
[7]Hu Z,Peng F,Xiong Z,et al.Genetic and Molecular Characterization of H9N2 Avian Influenza Viruses Isolated from Live Poultry Markets in Hubei Province,Central China,2013-2017 [published online ahead of print,2020 Sep 14].Virol Sin.2020;10.1007/s12250-020-00260-z.doi:10.1007/s12250-020-00260-z.
[8]齊巧玲,李雁冰,施建忠,等.2005年青海湖野鸟H5N1亚型HPAIV的遗传进化分析[C]// 中国畜牧兽医学会动物传染病学分会学术研讨会.2007.
[9]Shortridge KF,Zhou NN,Guan Y,et al.Characterization of avian H5N1 influenza viruses from poultry in Hong Kong.Virology.1998;252(2):331-342.
(责任编辑:唐 岚)

