miR-322-5p通过NOX4调控细胞凋亡抑制大鼠神经管畸形发生
黄琬淇,刘玉思,顾卉,袁正伟
(中国医科大学附属盛京医院,国家卫生健康委员会小儿先天畸形重点实验室,沈阳 110004)
神经管畸形(neural tube defects,NTDs)作为最严重的出生缺陷之一,全球发病率约为1‰~10‰[1]。由于神经管的闭合失败,可出现如无脑儿、脊柱裂、脑脊髓膜膨出等一系列表型[2]。神经上皮细胞的过度凋亡导致神经管闭合异常,产生NTDs[3]。全反式维甲酸(all-trans retinoic acid,ATRA)可通过诱导细胞凋亡活动影响神经管闭合,引起NTDs的发生[4-5],本研究组前期利用ATRA成功制作了NTDs胎鼠模型。
微RNA(microRNAs,miRNA)是一种长度为22~24 nt的内源性小型非编码 RNA 分子,通过与靶基因的3’端非翻译区(3’untranslated regions,3’-UTR)结合,诱导mRNA降解或抑制翻译,从而调控靶基因的转录和表达[6]。miR-322是细胞增殖、分化、凋亡等生物学活动的重要调控因子,对于心血管系统、神经系统及其他器官均有一定的保护作用[7-8]。研究发现,miR-322-5p可抑制高糖诱导的小鼠神经干细胞凋亡和NTDs的发生。本课题组前期研究[9-10]发现,胚胎体外注射miR-322-5p-mimic,对NTDs有治疗作用。但它与ATRA诱导的大鼠NTDs的关系仍有待研究。
烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)是NADPH氧化酶家族的一个亚型成员,它的过表达可导致神经元的自身毒性以及大脑的局部缺血[11]。在高糖诱导的神经病变动物模型中,周围神经系统施旺细胞NOX4表达上调,促进细胞氧化应激参与周围神经损伤[12]。但NOX4在ATRA诱导的大鼠NTDs中的表达及作用尚未见报道。通过TargetScan及starBase生物信息学分析发现,NOX4是miR-322-5p的靶点,在NOX4mRNA的非翻译区存在miR-32-5p的潜在结合位点。本研究拟观察miR-322-5p与NOX4在ATRA诱导的大鼠NTDs模型中的表达及其对凋亡活动的影响,探讨NTDs的发生机制,以为其诊疗提供新靶点。
1 材料与方法
1.1 材料
小鼠神经干细胞(C17.2,贝纳创联生物研究所),ATRA(美国Sigma公司),MEM培养基(美国Gibco公司),MEM NEAA(美国Gibco公司),胎牛血清(美国Gibco公司),青霉素链霉素溶液/双抗(美国Hyclone公 司),miR-322-5p mimics/inhibitor、mimics/inhibitor-NC(上海吉玛制药技术有限公司),NOX4 plasmid(上海吉凯基因化学技术有限公司)。JetPRIME(法国PolyPlus-transfection公司),miRNeasy Mini Kit(美国Qiagen公司),miRNA第一链cDNA合成试剂盒(上海生工生物工程有限公司),SYBR Premix Ex Taq Kit(大连宝生物工程有限公司),BCA蛋白定量试剂盒(北京索莱宝科技有限公司),NOX4兔多克隆抗体(美国Rocklamd公司),Bcl-2鼠多克隆抗体(美国Sigma公司),Bax兔多克隆抗体(美国Cell Signaling Technology公司),β-actin鼠单克隆抗体、辣根过氧化物酶标记的山羊抗兔/抗小鼠IgG(美国Proteintech公司),UltraSensitive SP IHC kit、辣根过氧化氢DAB显色试剂盒(福州迈新生物技术开发有限公司),4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 大鼠NTDs模型制备及组织样本收集:Wistar大鼠(北京华阜康生物技术有限公司)饲养于中国医科大学附属盛京医院SPF级实验动物房,按雌∶雄为2 ∶1于前一晚合笼,第二日早将大鼠分笼,阴道涂片见精子的雌鼠单独放于一笼,记为孕0 d(E0)。于E10将已孕雌性大鼠随机分为2组,NTDs组灌胃140 mg/kg橄榄油溶解的ATRA,对照组给予同体积的橄榄油灌胃。于E11剖宫取出胎鼠,获取脊髓组织。
1.2.2 免疫组织化学染色:将胚鼠脊髓固定于4%多聚甲醛中,石蜡包埋,制4 μm厚切片,二甲苯脱蜡,梯度乙醇脱水,于去离子水中水化。抗原修复后,使用UltraSensitive SP IHC试剂盒处理切片,滴加一抗anti-NOX4(1 ∶800),4 ℃孵育过夜,第二日DAB显色,苏木素复染,流水返蓝1 h除去余色,封片拍照。
1.2.3 免疫荧光染色:切片在二甲苯中脱蜡,梯度乙醇脱水,去离子水水化,0.1% Triton X-100处理。动物血清封闭后,加入anti-NOX4抗体(1 ∶1 000),4℃孵育过夜。PBS冲洗3次,室温荧光标记的二抗孵育(1 ∶200)2 h。DAPI染色,荧光显微镜观察。
1.2.4 细胞的培养和转染:用含10%胎牛血清、1%MEM NEAA、100 μg/mL青霉素、100 μg/mL链霉素的MEM培养液在37 ℃、5%CO2培养箱中培养小鼠神经干细胞C17.2。接种细胞至6孔板,转染前培养24 h。以JetPRIME为转染试剂,转染miRNA-空白对照(miRNC)、miR-322-5p mimic、miR-322-5p inhibitor以 及NOX4高表达质粒至C17.2细胞。
1.2.5 实时定量PCR:用miRNeasy Mini试剂盒从胚胎脊髓组织和C17.2中提取总RNA,用miRNA First Strand cDNA Synthesis反转录RNA。以U6为内参,用SYBR Premix Ex Taq试剂盒行实时定量PCR。引物序列如下:miR-322-5p F链为AGCAGCAATTCATGTTT TGGAA,R链为GCTGTCAACGATACGCTACGTAAC;U6F链为CTCGCTTCGGCAGCACA,R链为AACGCT TCACGAATTTGCGT;β-actinF链为GGAGATTACTGC CCTGGCTCCTA,R链为GACTCATCGTACTCCTGCTT GCTG。
1.2.6 Western blotting:自胚胎脊髓和C17.2细胞中提取蛋白质。SDS-PAGE电泳分离,电转印至PVDF膜,5%脱脂牛奶封闭2 h。加入一抗 NOX4(1 ∶1 000),Bax(1 ∶1 000),Bcl-2(1 ∶1 000),4 ℃孵育过夜。次日用TBST洗膜3次(10 min/次),室温下与HRP兔和鼠二抗(1 ∶5 000)孵育2 h,ECL发光。
1.3 统计学分析
采用SPSS 26.0软件进行统计分析,并用 GraphPad 8.0统计软件作图。计量资料以表示,采用独立样本t检验进行比较。P< 0.05为差异有统计学意义。
2 结果
2.1 miR-322-5p和NOX4在大鼠NTDs形成中的表达
2.1.1 ATRA诱导的NTDs胎鼠脊髓组织神经管形态及NOX4定位表达情况:免疫组织化学染色和组织免疫荧光结果显示,NTDs组神经管形态明显异常,且胚胎脊髓中NOX4表达显著高于对照组,见图1。

图1 E11对照组和NTDs组大鼠胚胎脊髓组织神经管的形态和NOX4表达情况 ×200Fig.1 Morphology and NOX4 expression of spinal cord neural tube between E11 control and NTDs rats ×200
2.1.2 miR-322-5p和NOX4在NTDs胎鼠脊髓组织中的表达情况:实时定量PCR和Western blotting结果显示,与对照组相比,NTDs组脊髓组织中miR-322-5p mRNA和蛋白表达水平明显下调(均P< 0.05),见图2。提示miR-322-5p的表达对NTDs可能有抑制作用,而NOX4可能促进NTDs的形成。
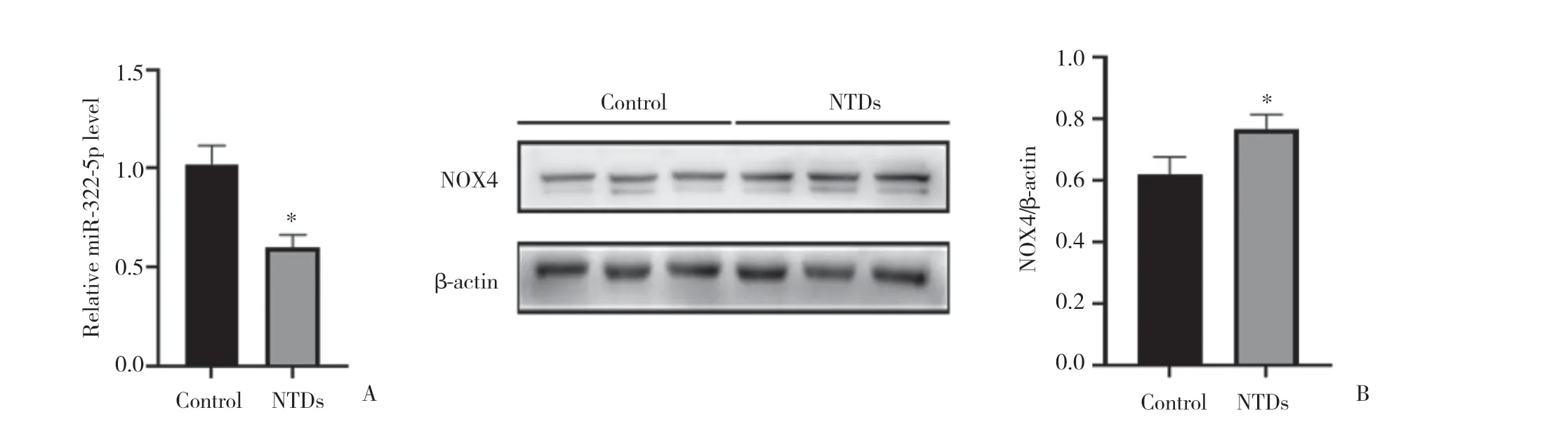
图2 E11对照组和NTDs组大鼠胚胎脊髓组织miR-322-5p和NOX4表达情况Fig.2 Comprison of miR-322-5p mRNA and NOX4 protein expression in the embryonic rat spinal cord tissues between control and NTDs groups
2.2 ATRA致畸胎鼠脊髓中凋亡蛋白的表达情况
Western blotting结果显示,ATRA诱导的NTDs组中,NOX4蛋白表达显著上调,促凋亡蛋白Bax表达增强,抗凋亡蛋白Bcl-2表达减弱(P< 0.05),见图3。表明NTDs胎鼠脊髓中细胞凋亡增加,提示NOX4可能促进凋亡的发生。
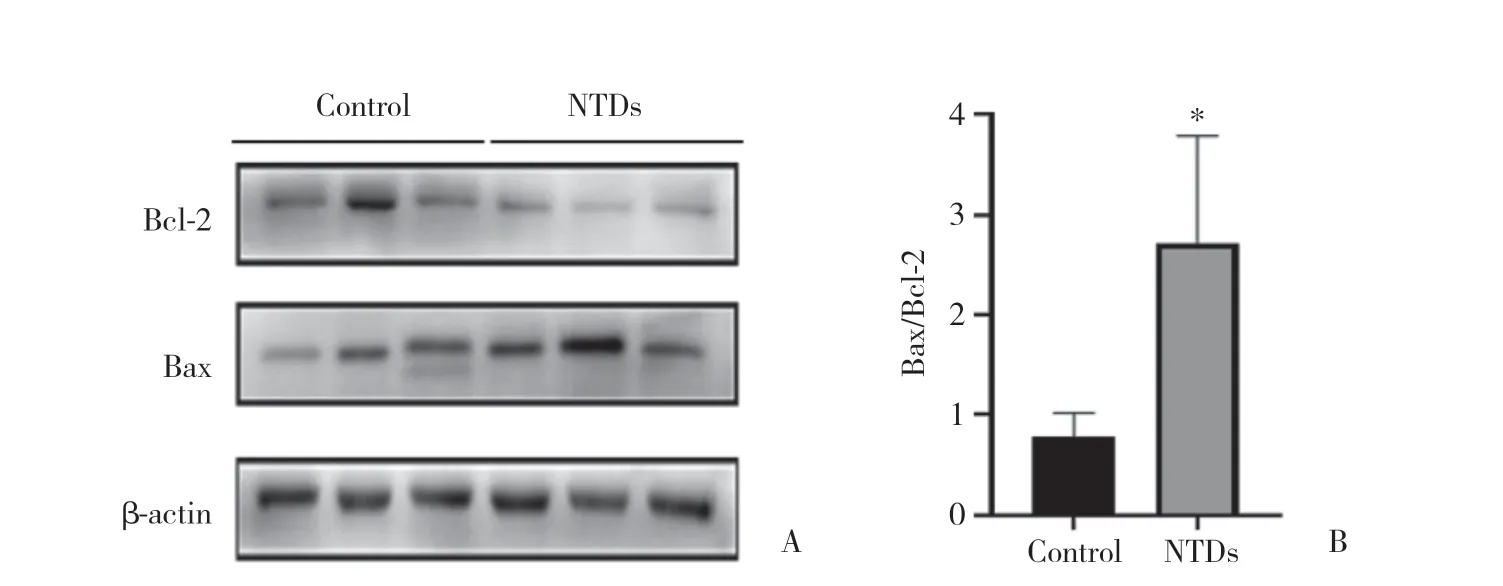
图3 凋亡相关蛋白在对照组和NTDs组胎鼠脊髓组织中的表达情况Fig.3 The expression of apoptosis-related proteins in the embryonic rat spinal cord of control and NTDs groups
2.3 miR-322-5p负调控NOX4的表达并减少细胞凋亡
2.3.1 转 染miR-322-5p mimics和inhibitor后C17.2神经干细胞中NOX4的表达:Western blotting结果显示,C17.2细胞中转染miR-322-5p mimic 48 h后,miR-322-5p表达水平显著上调(图4 A,P< 0.05),NOX4蛋白表达下调(图4B、4C,P< 0.05);转染miR-322-5p inhibitor后,miR-322-5p表达水平下调(图4D,P<0.05),NOX4表达下调(图4E、4F,P< 0.05)
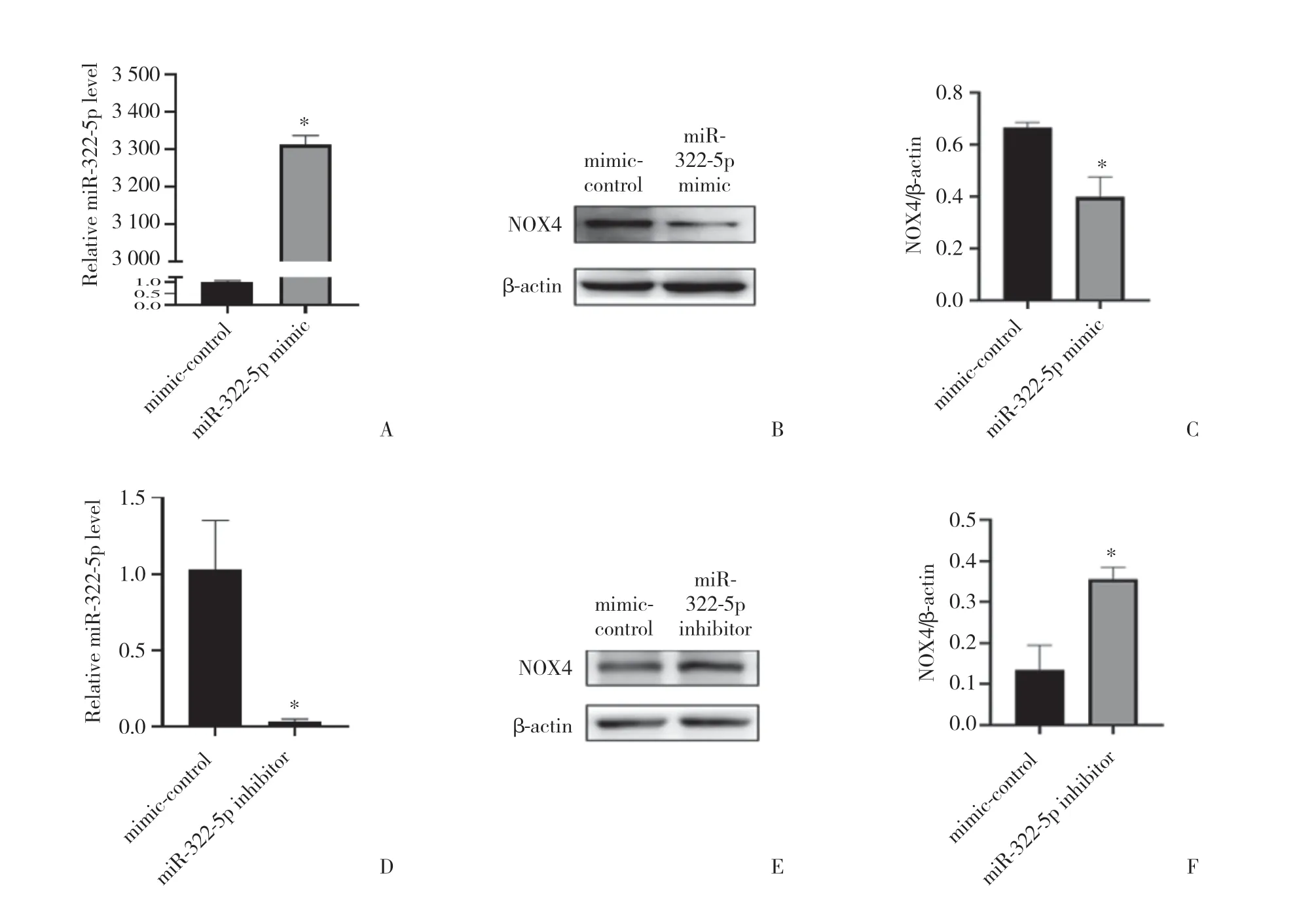
图4 转染miR-322 mimic/inhibitor对C17.2细胞中NOX4表达的影响Fig.4 Regulation of NOX4 after transfection of miR-322 mimic/inhibitor
2.3.2 miR-322/NOX4对神经干细胞的凋亡的影响:Western blotting结果显示,转染NOX4高表达质粒的神经干细胞中,NOX4过表达,促凋亡基因Bax蛋白表达上调,抗凋亡基因Bcl-2蛋白表达下调。miR-322-5p mimic与NOX4过表达载体共转染细胞后,miR-322-5p mimic抑制NOX4表达的同时,也抑制了Bax表达,促进了Bcl-2表达(P< 0.05),见图5。提示miR-322-5p能够通过抑制NOX4表达抑制神经干细胞的凋亡。

图5 C17.2细胞转染miR-322-5p mimic和NOX4后NOX4和凋亡蛋白的表达水平Fig.5 Expression of NOX4 and apoptotic proteins after transfection miR-322-5p mimic and NOX4 of C17.2
3 讨论
NTDs作为一种多因素疾病,对于其发病机制的了解仍较局限。本研究利用ATRA诱导大鼠NTDs模型,发现NOX4作为miR-322-5p的靶标,可以通过参与细胞凋亡调控大鼠神经管闭合的过程,在大鼠NTDs发生中扮演重要角色。
细胞凋亡对于维持胚胎的正常发育具有重要作用,在神经管闭合进程中,中线细胞的过度凋亡导致神经管的闭合失败以及一系列NTDs表型的形成[13]。研究[14]发现,miRNA对NTDs具有调控作用。在高糖环境下,miR-129-2通过抑制细胞自噬可诱导NTDs发生[15]。本课题组前期研究[16]发现,孕产妇糖尿病或体外高血糖会增加miR-200b的水平,CITED2是miR-200b的靶标,被高糖下调。由此可见,miR-200b抑制剂可逆转培养的胚胎中高葡萄糖诱导的CITED2下调,内质网应激,进而改善胚胎发育中的NTDs。miR-322也参与了细胞凋亡活动的调控[17]。缺氧条件可引起心肌细胞出现凋亡,并伴随miR-322明显上调[18]。本研究组前期还发现miR-322-5p可以通过抑制TRAF3减少高糖诱导的神经干细胞凋亡[9]。但miR-322-5p是否参与ATRA诱导的大鼠NTDs尚无报道。
NOX4作为NOX酶家族成员是细胞超氧阴离子的来源,参与中枢神经系统的发育、神经干细胞生物学以及成熟神经元的功能[19],并可通过产生活性氧(reactive oxygen species,ROS)来诱导细胞发生氧化应激,进而导致细胞凋亡。研究[20-21]显示,糖皮质激素可通过NOX4/ROS/p38 MAPK途径诱导软骨细胞凋亡,心肌细胞NOX4高表达,凋亡也随之增加。由于神经元的抗氧化性较弱,ROS的产生是神经系统疾病和细胞凋亡的主要因素。NOX4对神经元的凋亡也具有相似作用,它参与大鼠缺血再灌注过程中ROS诱导的神经元凋亡和脑损伤[22]。此外,慢性氟暴露会诱导中枢神经系统发生氧化应激,诱导NOX4的表达,而NOX4高表达会导致血脑屏障损害,小胶质细胞活化和神经元丧失,从而导致脑功能受损[23]。但关于大鼠NTDs胚胎中脊髓NOX4的表达尚无研究。本研究结果显示,在NTDs胎鼠模型脊髓中,NOX4表达水平上调,且伴随促凋亡相关蛋白表达增加,抗凋亡相关蛋白减少。结合生物信息学分析的结果,NOX4是miR-322-5p的靶基因,当神经干细胞C17.2在转染NOX4高表达质粒的同时转染miR-322模拟物,可降低NOX4的表达水平,且伴随抗凋亡相关蛋白增加,促凋亡蛋白减少。由此可见,miR-322-5p能够抑制NOX4的表达,抑制神经管发育过程神经细胞的过度凋亡。
综上所述,miR-322-5p能够下调NOX4的表达,减少大鼠胚胎神经管闭合过程中细胞凋亡,减少NTDs的发生,因此,miR-322-5p可能成为NTDs治疗的新靶点。

