大脑中动脉M1段亚急性闭塞血管内再通治疗的评价及影像评估的应用价值
匡祖颖 王培明 薛冬圳 黄绪鑫 李波 潘梦秋 叶锦龙 成丽娜 王展航
1广东三九脑科医院神经内一科,广州 510510;2广东三九脑科医院神经介入治疗中心,广州 510510;3广东三九脑科医院影像科,广州 510510
颅内动脉亚急性闭塞会导致供血区域的慢性缺血,虽然不会造成肢体瘫痪的急性加重,但会逐渐出现皮层高级功能如智力、记忆力及语言功能的慢性减退,同时也是不良预后和卒中复发的独立预测因素[1]。颅内动脉的闭塞再通治疗多在颈内动脉颅外段进行,颈内动脉颅内段及大脑中动脉M1段开展较少,而且国内外对其报道较少,因此有关手术技术、病例选择、围手术期风险、短期内预后等经验不足[2]。本文连续回顾性分析2018年1月至2019年12月期间本院神经介入治疗中心对26例颅内大脑中动脉M1段亚急性闭塞患者进行血管内再通治疗的临床资料,旨在评估颅内大脑中动脉M1段亚急性闭塞血管内再通治疗的可行性、安全性及有效性以及影像评估与手术并发症的风险及预后的相关性。现将本研究的初步治疗经验和治疗效果报道如下。
1 资料与方法
1.1 临床资料回顾性纳入选取2018年1月至2019年12月本院采用介入开通治疗的大脑中动脉M1段亚急性闭塞患者26例。临床症状为偏瘫、偏身感觉障碍、构音障碍、记忆力减退、失语等以及非特异性症状如头晕头痛、视力下降等。所有患者术前完善改良Rankin评分(mRS),磁共振检查包括MR弥散(DWI)及MR动脉自旋标记成像(ASL),脑血管造影。所有患者在进行介入干预之前,均已经过规范的内科治疗(抗血小板聚集、降脂稳斑、控制血压血糖等高危因素)及康复治疗,但在3周后仍有明显的神经功能障碍。本研究方案经本院医学伦理委员会批准,同时患者或家属均签署知情同意书。
1.1.1 入选标准(1)全脑血管造影证实一侧的大脑中动脉M1主干闭塞,且血管闭塞时间在3周~6个月;(2)患者有至少一项脑血管病高危因素,数字减影血管造影(DSA)判断动脉粥样硬化性闭塞;(3)术前头部CT平扫排除出血,DWI提示3周内未见新发梗死灶;(4)有与闭塞动脉相关的脑缺血或者脑梗死症状;(5)内科治疗效果3周以上不佳、6个月内反复短暂性脑缺血发作(TIA)或存在血流动力学障碍,如直立位或者血压低时症状加重、ASL提示存在明显的低灌注区域;(6)生活部分自理,mRS评分0~3分。
1.1.2 排除标准(1)非动脉粥样硬化性闭塞,包括动脉夹层、烟雾病、其他血管炎性反应疾病和血管痉挛等;(2)纳入前3周内接受过同侧球囊扩张、支架植入术或颅内外动脉旁路移植术;(3)有抗血小板聚集药物禁忌证;(4)闭塞部分太长,大于10 mm;(5)病变近端或者远端伴发动脉瘤,合并颅内占位、出血;(6)对术中及术后药物如麻醉药物、阿司匹林、氯吡格雷等过敏;(7)合并其他严重疾病,预计生存期小于1年。
1.2 影像资料采集所有患者在术前均需完善ASL、血管壁高分辨磁共振成像(VM-HRMRI)和全脑DSA检查。
1.2.1 ASL检查采用美国GE Signa HDX3.0T磁共振,8通道头线圈。扫描序列包括:轴位T2WI(加权成像,weighted imaging)、T2Flair(液体衰减反转恢复序列,fluid attenuated inversion recovery)、T1Flair、DWI、3D-ASL、矢状面T1WI。DWI:TR(重复时间)6 000 ms,TE(回波时间)74.6 ms,FOV(视场角)24 cm×24 cm,层厚5.5 mm,层间距1.0 mm,矩阵=160×160,NEX(激励次数)2次,b值1 000 s/mm2。3D-ASL:TR 4 619 ms,TE 9.8 ms,FOV 24 cm×24 cm,层厚4 mm,层间距1.5 mm,矩阵=512×8、NEX 3次,PLD(标记延迟时间)1.5 s/2.5 s。将3D-ASL原始图像传输至美国GE ADW4.6工作站,使用Function Tool软件中自带3D pCASL后处理软件,选择阈值后生成PLD=1.5 s/2.5 s全脑血流量(CBF)伪彩图像,通过伪彩图像阈值选取CBF<20 ml/(100 g·min)认为低灌注区域。由1名副主任医师和1名主治医师(要求从事MRI诊断≥5年)分别对DWI和ASL-CBF图像进行判读,对判断有分歧的患者重新协商后决定。
1.2.2 VM-HRMRI检查采用美国GE Signa HDX 3.0T磁共振,选用8通道头线圈进行大脑中血管斑块高分辨检查。扫描序列包括:三维时间飞跃法磁共振血管成像(3D-TOF-MRA)、小FOV垂直于大脑中M1段的T2 sag、Double IR sag、T1 sag及增 强的3D Cube cor、Double IR sag。HRMRI:层厚2 mm,层间距0,NEX 4~6次,分辨率为0.54 mm×0.54 mm×2 mm,其T2WI-sag的TR 3 200 ms、TE 90 ms,T1WI的TR 550 ms、TE 11 ms,DIR的TR 812~953 ms、TE 7.3 ms。由1名副主任医师和1名主治医师(要求从事MRI诊断≥5年)分别对HRMRI图像进行判读,对判断有分歧的患者重新协商后决定。
1.2.3 术前DSA检查局麻下进行手术,控制血压100~130/60~90 mmHg(1 mmHg=0.133 kPa),在全身肝素化后选右侧股动脉行Seldinger技术置入5F导管鞘,选5F单弯管分别行双侧颈总动脉、双侧颈内动脉、双侧锁骨下动脉、双侧椎动脉造影。造影确认闭塞血管的部位、长度、近端直径、远端血管床存在情况。
1.2.4 血管内再通术术前所有患者均口服抗血小板聚集药物[美国国立卫生研究院卒中量表(NIHSS)评分≤4分联合使用阿司匹林100 mg/d和氢氯吡格雷75 mg/d,NIHSS评分>4分单用氢氯吡格雷75mg/d],降脂稳斑(阿托伐他汀40 mg/d),控制血压和血糖等高危因素。术前8 h禁食。
全身麻醉下进行手术,控制血压100~130/60~90 mmHg,在全身肝素化后选右侧股动脉行Seldinger技术置入6F动脉鞘,将6F指引导管送至颈内动脉岩段。路图下在微导丝引导下将微导管超旋入闭塞大脑中动脉远端分支,并超选造影后证实大脑中动脉M1段局限性闭塞且M1分叉远端血管通畅,同时评估闭塞段血管的长度、形态以及预估闭塞段的血管直径,选择合适规格的球囊沿交换导丝将其置于闭塞段预扩。根据预扩后复查血管造影的情况而选择不同的再通策略,包括单纯球囊扩张以及球囊扩张后支架置入。
术后即刻造影评估血管残余狭窄程度,根据脑梗死溶栓(thrombolysis in cerebral infarction,TICI)分级评估再通血管远端血流灌注。残余狭窄<30%,且TICI分级≥2b,定义为再通成功;TICI分级未改变或未达到2b,定义为再通失败。所有患者术后复查CT观察手术并发症(血栓脱落、造影剂外渗、脑出血等),排除后视术前脑梗死病灶情况及NIHSS评分决定是否给予替罗非班(2 ml/h)微泵注射维持24 h。术后维持双联抗血小板聚集药物治疗,严格监测生命体征,控制血压100~130/60~90 mmHg。术后给予阿司匹林100 mg/d和氢氯吡格雷75 mg/d口服3个月,之后单用抗血小板聚集药物维持终生。
1.3 随访与预后评估采用电话、门诊或住院的方式定期随访(术后3~6个月),记录患者的手术血管的情况以及有无卒中再发事件,并采用NIHSS评分及mRS评分评估预后。
1.4 统计学方法采用SPSS 22.0软件对数据进行统计学分析。计量资料若符合正态分布以()表示,组间比较采用独立样本t检验;不符合正态分布的计量资料用M(P25,P75)表示,比较采用Wilcoxon符号秩检验。计数资料以例数和百分比表示,比较用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料入组患者26例,男性20例(77%),女性6例(23%);年龄为61.00(55.00,65.50)岁,其中男性61.00(55.00,66.50)岁,女性60.50(54.75,69.75)岁。合并原发性高血压17例,其中男性12例(80%)、女性5例(86%);颈部动脉粥样硬化14例,其中男性10例(50%)、女性4例(66%);糖尿病8例,其中男性6例(30%)、女性2例(33%);高脂血症8例,均为男性(40%);高同型半胱氨酸血症3例,有吸烟史18例,吸食冰毒史1例。闭塞部位位于左侧16例,位于右侧10例。发病至手术时间为25(17,36)d,术前mRS评分3(2,4)分,NIHSS评分6.00(4.00,9.25)分。
2.2 手术结果26例患者中有24例成功开通,2例因术中微导丝不能通过而介入再通手术失败。24例血管再通的患者中,10例行单纯球囊扩张手术,14例行球囊扩张及支架植入手术。术中发生并发症9例:4例为造影剂外渗,2例为严重脑出血,2例为血栓形成,1例为症状性末梢栓塞事件。其中2例出现严重脑出血转至神经外科清除水肿并症状恶化继而失访,其他22例患者在术后3~6个月完善血管检查和临床随访,见表1。

表1 26例大脑中动脉M1段亚急性闭塞患者的再通手术情况及术后评分
2.3 手术并发症的相关性
2.3.1 手术并发症与血管形态及术式的相关性2例严重脑出血并发症的患者的HRMRI均可见烟雾状血管形成,血管无环形强化;4例造影剂外渗的患者,其中3例为支架植入、1例为球囊扩张;1例症状性末梢栓塞事件的患者行支架植入术后出现。
2.3.2 手术并发症与ASL的相关性ASL中主要观察局部脑血流量(rCBF)指标。2例严重脑出血并发症的患者的rCBF为(18.9±0.1)%,其他22例无严重并发症的患者的rCBF为(42.1±15.6)%;4例出现造影剂外渗的患者的rCBF为(64.5±11.8)%,18例无造影剂外渗的患者的rCBF为(37.9±11.9)%。
2.4 随访结果随访22例患者,其中2例患者支架置入后并发血栓形成而出现血管再闭,症状恶化,其余20例成功再通的患者中,4例术中仅采用球囊扩张治疗在术后6个月复查发现手术血管的轻微再狭窄,其余的3例球囊扩张治疗和13例球囊扩张后支架植入的患者血管检查随访均无出现血流动力学上的再狭窄,所有患者均无再发卒中和TIA。2例再闭塞的患者术后90 d的NIHSS和mRS评分均加重,7例术后NIHSS和mRS评分无明显改善,其余13例NIHSS和mRS评分均有不同程度改善。22例患者随访时mRS评分为2(1,3)分,与手术前mRS评分[3(2,4)分]比较差异有统计学意义(Z=-3.052,P=0.002);NIHSS评分为3.00(1.00,6.25)分,与手术前NIHSS评分[4.00(6.00,9.25)分]比较差异有统计学意义(Z=-3.310,P=0.001)。
2.5 典型介入病例治疗前后表现
病例1:患者中年男性,56岁,主因“右侧肢体无力1周”入院。既往高血压病,混合型高脂血症,高尿酸血症病史。完善血管检查提示左侧大脑中动脉闭塞,行左侧大脑中动脉血管闭塞介入再通治疗,术中仅行球囊扩张治疗后DSA复查血管复流通畅,术后患者未出现并发症,半年后复查血管存在残余狭窄(图1)。
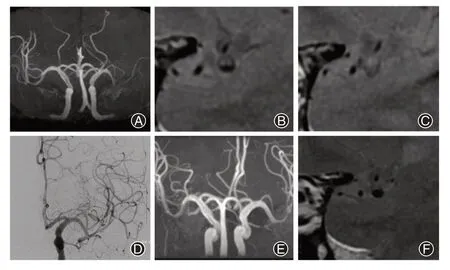
图1 病例1行左侧大脑中动脉血管闭塞介入再通治疗。A:磁共振血管造影(MRA)提示左侧大脑中动脉闭塞;B~C:高分辨磁共振成像(HRMRI)提示左侧大脑中动脉血管斑块形成后堵塞导致闭塞;D:数字减影血管造影(DSA)下球囊扩张术后左侧大脑中动脉血管闭塞段开通复流,无明显狭窄,各分支显影通畅;E~F:半年后复查MRA提示左侧大脑中动脉局限性狭窄,HRMRI提示斑块较前稳定且体积缩小
病例2:患者老年男性,61岁,主因“右侧肢体无力及反应迟钝10 d”入院,既往高血压、糖尿病及血管动脉粥样硬化病史。完善血管检查提示左侧大脑中动脉闭塞,HRMRI检查提示烟雾样血管生成,行左侧大脑中动脉血管闭塞介入再通治疗,术中行球囊扩张后支架植入治疗,DSA复查血管再通,复流通畅,但术后患者出现严重的出血并发症,并转外科进一步治疗(图2)。

图2 病例2行左侧大脑中动脉血管闭塞介入再通治疗。A:磁共振血管造影(MRA)提示左侧大脑中动脉闭塞;B:高分辨磁共振成像(HRMRI)提示左侧大脑中动脉闭塞,周围出现新生血管;C:数字减影血管造影(DSA)检查左侧大脑中动脉闭塞,大脑中动脉远端血管网仍存在;D~E:DSA介入手术球囊扩张后支架植入,左侧大脑中动脉M1段管腔恢复,显影通畅,远端分支血流速度明显改善;F:CT检查术后患者出现严重的出血并发症
3 讨 论
随着介入手段的快速发展,亚急性期的颅内大血管颅内动脉闭塞的血管内治疗逐步认可,但目前颈内动脉床突段以下进行的闭塞血管再通治疗的相关研究较多,对于颈内动脉床突段以上及大脑中动脉M1段的研究少。既往认为闭塞远端在颈内动脉床突段以上及大脑中动脉动脉的闭塞再通成功率低,并发症多,远期再闭塞率高,不建议尝试血管再通[3]。早期SAMMPRIS和VISSIT试验均证实在颅内动脉的血管成形术和支架置入术失败,主要是考虑到手术的安全性[4-5]。Chen等[6]报道16例亚急性期闭塞介入再通的患者,其中12例经过严格筛选手术的大脑中动脉M1段闭塞的患者,围手术期风险仅为6.25%。因此随着介入技术发展及新材料的应用,在经过严格的术前评估及手术适应证的选择后,可以避免颈内动脉颅内段及大脑中动脉M1段血管闭塞再通手术的并发症及远期风险。
术前评估包括闭塞血管的状态、血栓及斑块的特征、闭塞的位置及节段、闭塞远端侧支循环情况,可以帮助制订治疗方案,预测并发症的发生率和提高再通治疗的成功率以及预判患者的获益[7]。大脑中动脉闭塞的原因复杂,动脉粥样硬化最为常见,还有夹层,心脏及近端血管来源血栓,烟雾病,血管炎,血小板增多症等。VM-HRMRI可以观察闭塞近端血管壁的特征性变化,分析附壁斑块的位置及形态学[2]。本研究分析了26例大脑中动脉M1段亚急性闭塞介入再通治疗的患者,其中2例患者术前HRMRI检查均发现烟雾状血管生成,术后出现严重的脑出血并发症继而死亡,这可能与大脑中动脉失去正常形态、烟雾样血管生成后通透性增加及术后高灌注综合征有关,因此对于此类患者,如果药物保守治疗仍有症状性发作或者反复脑梗死,建议可以行颞肌贴敷联合/或者动脉搭桥手术[8-9]。
血管支架植入后,异物的炎性反应、支架本身对血管壁的损伤以及对血管的扩张可导致血管内膜增生,导致血栓形成,进而出现支架内再狭窄及再闭塞的发生。Wasser等[10]的研究表明置入支架越窄,长度越长,则支架再狭窄及再闭塞发生率越高。Lee等[11]报道了41例慢性颈动脉闭塞患者予血管内治疗的经验,DSA检查发现反流至床突段及以上患者的开通成功率和术后1年再闭塞率分别为52%、91%,反流至床突段以下者的开通成功率和术后1年再闭塞率分别为89%、0%。本研究2例介入再通6个月内出现血管再闭,其中1例为支架植入术,再闭塞率为4.1%(1/24),发生率明显高于颈内动脉床突段以下行介入再通术,这可能与大脑中动脉血管管径较小、置入支架较窄、血流动力学改变明显有关,故而增加了支架再闭塞的发生率。
大血管闭塞后,责任侧大脑半球会出现低灌注及侧支循环代偿,血管成形术及支架置入后血管再通,远端区域血流灌注增加,可能会出现再灌注损伤,因此评估术前闭塞远端的灌注情况对再灌注损伤可能有意义。DSA发现再灌注后静脉充盈早现现象对症状性颅内出血有较强的预测价值,对死亡风险有中等强度的预测价值。温宏峰等[12]报道30例脑梗死大血管闭塞急性再通的患者(30/98,30.6%)在梗死核心区或其周边出现了静脉充盈早现,其中26例患者(86.7%)出现了造影剂外渗,16例患者发生了出血转化(53.3%),提示不可逆的脑缺血性损伤且伴有血管内皮细胞受损可以作为再灌注后出血转化及并发症的预测征象。Yu等[13]认为早期高灌注可以预测神经功能的恢复,但是晚期的高灌注和高级别的脑出血有关。本研究严重出血并发症2例、造影剂外渗4例,rCBF分别为(18.9±0.1)%、(64.5±11.8)%,无造影剂外渗的患者的rCBF为(37.9±11.9)%,因此我们认为血管开通前的病灶侧大脑半球的低灌注(rCBF<20%)与严重的脑出血并发症相关,而开通前的偏低灌注或等灌注(80%<rCBF<100%)与造影剂外渗有关,但是本研究上述两类并发症例数太少,需要纳入更多的研究才能证实。
Bivard等[14]认为在急性脑梗死患者发病短期内出现病灶周围高灌注者结局和临床预后较好。同样Abumiya等[15]的研究结果提示高灌注患者的NIHSS评分较对照组患者改善明显。Chen等[6]报道12例大脑中动脉M1段闭塞的患者,3个月短期神经功能评估预后改善93.75%。本研究进行了为期半年的随访,在剔除2例再通失败及2例严重出血并发症的患者后,22例患者的术后NIHSS评分、mRS评分与术前相比均有不同程度的改善,这与再通术后闭塞血管供血区域恢复血供、灌注改善继而缺损的神经功能恢复有关,同时对于部分亚急性大脑中动脉闭塞的患者,通过介入再通治疗短期内可以获得满意的临床效果。
对于血管急性闭塞的患者,超早期的静脉溶栓和介入取栓治疗可减轻神经功能障碍程度,提高日常生活活动能力,且血管再通率较高[16]。但是对于亚急性闭塞的大脑中动脉是否不要再通、何时再通,如果成功再通后有无功能的改善或出现并发症的概率如何,这是目前大家关注及具有争议性的焦点。对于有功能缺损或者发作性症状的患者而言,若能实现闭塞血管的再通,可以对其生活和工作有积极作用。但是何时及能否再通和如何减少并发症仍需要更多的多中心和大规模的研究。
利益冲突:作者已申明文章无相关利益冲突。

