TACE联合阿帕替尼对比单独TACE治疗中晚期原发性肝癌的倾向性匹配分析
顾 杰, 许 晨, 周卫忠, 刘 圣, 施海彬
中晚期原发性肝癌的治疗仍是临床的一大难点,TACE是经典且有效的一种局部微创治疗方法[1-2]。TACE的原理是利用栓塞剂封堵肿瘤的主要供血血管,减少或阻断肿瘤血供,使肿瘤组织缺血缺氧而发生坏死,同时配合局部动脉灌注化疗药物,更有效地杀伤肿瘤细胞。另外HCC是富血供肿瘤,且主要由肝动脉等供血,而正常肝组织的血的75%由门静脉供血,因此与其他保守治疗相比,TACE不仅能够更显著地抑制肿瘤的进展,延长患者生存期,还减少了全身静脉用药的不良反应。TACE治疗过程中,肿瘤组织因血供阻断,造成缺血缺氧状态,进而刺激肿瘤细胞调节,改变缺氧诱导因子(HIF)和血管内皮生长因子(VEGF)的表达量,最终导致肿瘤新生血管生成也增加,并形成侧支循环,导致原有病灶的复发或转移[3-5]。目前多学科诊疗(MDT)是肝癌的主要治疗模式,TACE联合靶向药物治疗是目前重要的MDT治疗模式之一。因此,TACE联合抗血管生成药物可能是中晚期原发性肝细胞癌更理想的治疗手段[6-7]。近年来,有学者采用TACE联合索拉非尼的方法来抑制肿瘤坏死后血管再生,但肿瘤应答率低,且对于伴有门静脉癌栓的患者效果有限[8]。
阿帕替尼是一种新型小分子靶向抗血管生成药物,其能够在阻断VEGF与VEGFR-2结合的同时也可对酪氨酸激酶产生轻度抑制作用,是我国自主研发的抗血管生成药物。其作用主要包括以下3点:①抑制新生血管形成,这是通过抑制血管内皮细胞增殖来实现的;②促使免疫系统攻击肿瘤,由于VEGF会抑制树突状细胞的分泌功能,而阿帕替尼可以阻断VEGF的作用,因此可以解除VEGF对树突状细胞的 抑制;③增加肿瘤细胞对铂类药物的敏感性,这与阿帕替尼抑制血管内皮生长因子受体-2(VEGFR-2)下游的磷酸化激酶有关。目前阿帕替尼已应用于胃癌、乳腺癌等多种肿瘤的治疗,且效果显著。此外肝癌的Ⅱ期临床研究也明确了阿帕替尼在中晚期肝细胞癌的临床价值,另外肝癌Ⅲ期临床研究结果令人期待[9-10]。在本研究中,我们回顾性分析TACE联合阿帕替尼治疗中晚期HCC患者的疗效,为了得出更加确定的研究结论,我们运用了倾向性得分匹配(PSM),以缩小组间差异,综合分析了两组疗法在生存期和无进展生存期、肿瘤应答率及阿帕替尼相关不良反应的情况[11]。
1 材料与方法
1.1 一般资料
收集2016年6月至2017年12月我科治疗的265例中晚期HCC患者临床资料,主要包括性别、年龄、乙肝病毒感染(HBV)、抗病毒治疗、肿瘤最大径、肿瘤数目、甲胎蛋白(AFP)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、白蛋白、Child-Pugh分级、是否肝外转移及有无大血管侵犯。患者入组标准为:①患者拒绝或不能外科切除;②巴塞罗那分期B或C期;③Child-Pugh评分A或B级;④仅接受单独TACE或TACE联合阿帕替尼;⑤联合组服用阿帕替尼≥4周;⑥影像或病理证实为肝细胞癌;排除标准:①弥漫性肝癌;②除HCC外存在其他恶性肿瘤病史;③接受过除TACE和服用阿帕替尼外其他疗法;④失访;⑤缺乏影像学及血液学指标。依据入组及排除标准,纳入具有完整随访资料的115例,其中TACE联合阿帕替尼29例,86例仅接受TACE。
1.2 方法
1.2.1 TACE组 常规术区消毒铺巾,局部麻醉后,采用改良的Seldinger法经股动脉穿刺插管,经股动脉穿刺置入5 F鞘(泰尔茂,日本),送入5 F的RH导管(泰尔茂,日本),选择性进入肠系膜上动脉及腹腔干行DSA造影。明确肿瘤供血动脉后,用2.7 F微导管(泰尔茂,日本)超选进入肿瘤供血动脉,并经造影证实。然后根据术前评估的肝功能状态和术中肿瘤情况,先于肝固有动脉注入雷替曲塞4 mg和洛铂20 mg,再注入10~20 mL碘化油与上述化疗药混悬乳液进行栓塞,最后明胶海绵加强栓塞至造影明确肿瘤供血基本阻断,最后拔除导管及鞘管,加压包扎止血,下肢伸直制动。
1.2.2 服用阿帕替尼组 同期接受常规TACE,患者在行TACE治疗后3~7 d口服小剂量阿帕替尼,首次剂量250 mg/d,服用4周为1个疗程,如不能耐受药物不良反应,根据患者自身状况及医师决定是否减量为125 mg/d,不良反应恢复后继续原剂量给药,直至肿瘤再次进展或随访结束。
1.2.3 随访或观察指标 治疗后每6~12周复查上腹部CT或MR平扫加增强、血常规、尿常规及肿瘤指标等,当复查发现肿瘤仍有活性时,需再次TACE巩固;当证实肿瘤无活性时,继续随访观察,间隔8~12周。利用改良的实体瘤评判标准(mRECIST)对治疗6和12周后的靶病灶进行评估,评估分为完全缓解(CR),部分缓解(PR),疾病稳定(SD)和疾病进展(PD)[12]。总生存期(OS)定义为从患者入组开始,直至死亡或随访截止日期。无进展生存期(PFS)定义为患者入组到疾病进展,直至死亡或随访截至2019年9月1日。本研究中,客观缓解率(ORR)=(CR+PR)/总病例数,疾病控制率(DCR)=(CR+PR+SD)/总病例数。阿帕替尼相关不良反应按美国癌症研究所事件通用术语标准4.0进行判定。
1.3 统计学分析
使用倾向性匹配分析法,采用1∶1比例来匹配两个治疗组的部分基线资料,卡钳值设定为0.05。配对完成后的两组资料采用SPSS 19.0(SPSS,Chicago IL,USA)处理。计量资料用均数±标准差描述,比较用t检验;计数资料比较用卡方检验。使用Kaplan-Meier法和log-rank检验来分析两组生存期,P<0.05表示差异有统计学意义。
2 结果
2.1 患者基线资料
2016年6月至2017年12月共纳入115例具有完整临床资料的中晚期HCC患者,其中联合组29例,对照组86例,入组病例匹配过程见图1,经1∶1匹配后,共50例患者纳入分析,联合组25例,对照组25例。115例患者匹配前后的部分临床基线资料见表1。

表1 两组匹配前后临床资料
2.2 患者生存分析
匹配前后,联合组与对照组的中位OS(mOS)分别为为19个月比12个月(P=0.011)、18个月比9个月(P=0.046);中位PFS(mPFS)分别为14个月比4个月(P=0.002)、10个月比5个月(P=0.019)。匹配后,联合组1年、2年、3年生存率分别为68%、32%及8%,明显高于对照组的44%、20%及0%(χ2=3.983,P=0.046)。匹配前后两组的OS及PFS曲线见图2。
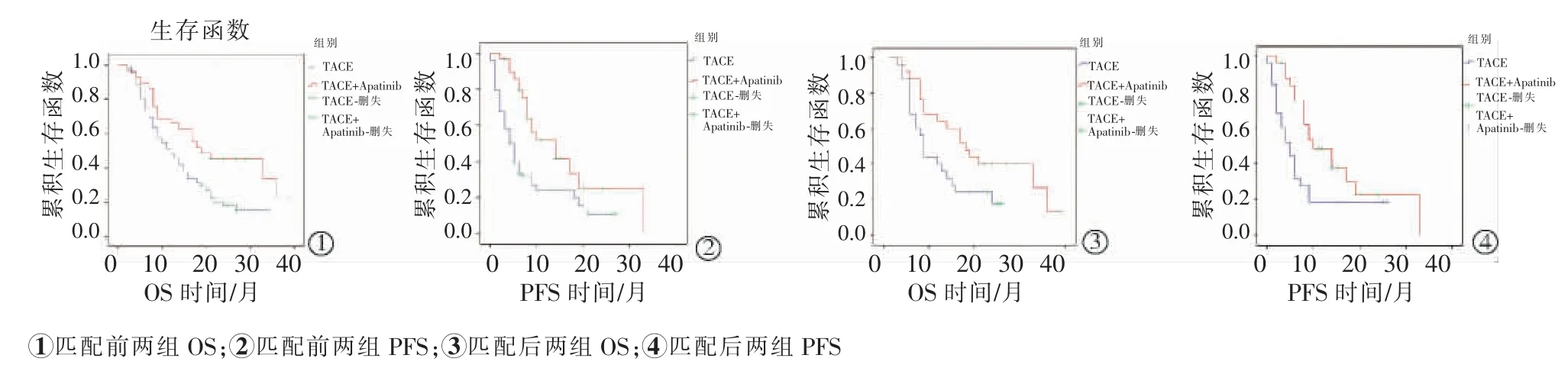
图2 匹配前/后联合组和对照组的OS和PFS曲线
2.3 6周、12周肿瘤应答反应
利用mRECIST分别对治疗后6周和12周的靶病灶进行评估,其中治疗6周后,联合组25例中,CR、PR、SD及PD分别为3例、14例、6例及2例,对照组分别为0例、10例、7例及8例。两组客观缓解率(ORR)分别为68%和40%;(χ2=3.945,P=0.047)疾病控制率(DCR)分别为92%和68%。(χ2=4.500,P=0.034);治疗12周后,联合组25例中,CR、PR、SD及PD分别为4例、11例、5例及5例,对照组为1例、6例、6例及12例。两组ORR分别为60%和28%;(χ2=5.195,P=0.023)DCR分 别 为80%和52%。(χ2=4.367,P=0.037)见表2。联合组典型病例见图3。
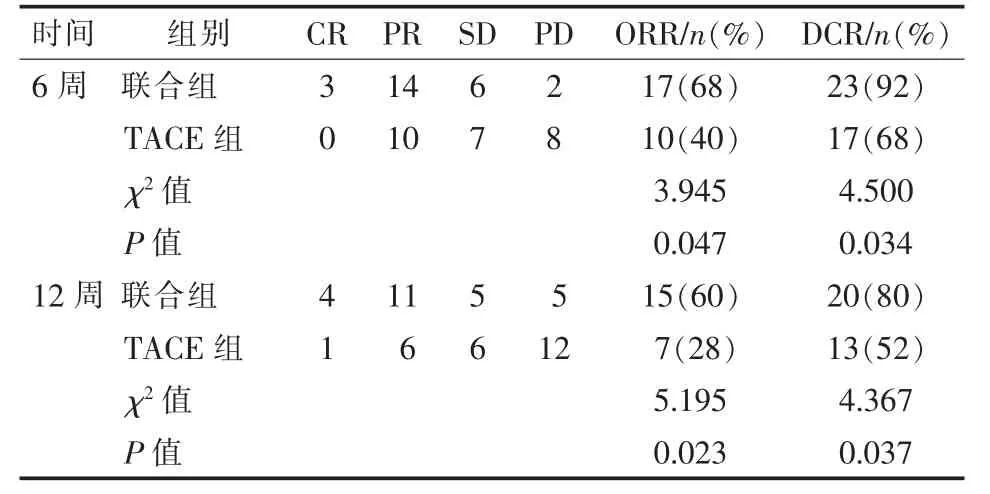
表2 治疗6周和12周后肿瘤应答情况(mRECIST)

图3 TACE联合阿帕替尼患者长期随访结果:根据mRECIST评估为CR
2.4 阿帕替尼相关不良反应事件
匹配后的联合组中,25例患者中出现高血压12例(48%),手足综合征10例(40%),蛋白尿4例(16%),腹泻1例(4%)及4例(16%)无明显阿帕替尼相关不良反应。25例均未出现3/4级严重不良反应事件,1/2级不良反应经对症治疗后均有好转,未出现因不能耐药而停药或减量的情况。
3 讨论
倾向得分匹配分析法(PSM)被证明是观察性研究中运用较多,且新颖和富有创造性的统计学方法。本研究的主要目为比较两种不同的治疗方法在中晚期肝癌患者治疗效果上的差别。我们运用了PSM对两组相关临床基线变量的分布进行了均衡,经匹配改善两组基线资料的一致性,进而增加可比性。
中晚期肝癌的治疗仍是临床的一大难点,研究表明索拉菲尼联合TACE能明显改善患者预后[7-8]。然而,由于索拉菲尼的耐药和低应答率,使得临床治疗缺少相应的策略。近年来,阿帕替尼的抗肿瘤活性作用已在部分临床试验中得到证实,单药或TACE联合阿帕替尼均可延长患者总OS[13]。Chen等[14]报道,对于BCLC C期肝癌患者,TACE联合阿帕替尼治疗相较于单纯TACE,能够显著延长患者的生存期(中位OS:13.0个月比9.9个月,P=0.041)。Lu等[15]进行了随机对照试验,评估TACE联合阿帕替尼治疗不能切除的肝癌的疗效,认为联合治疗可显著延长巴塞罗那B期和C期肝癌患者的(mPFS:12.5个月比6个月)。本研究中,匹配前,联合组与对照组的mOS分别为19个月和12个月(P=0.011);匹配后,联合组与对照组的mOS分别为18个月和9个月(P=0.046),跟既往文献结果相似[15-16]。本研究中,联合组与对照组匹配后的mPFS分别为10个月和5个月(P=0.019),联合组能明显改善患者的PFS。然而,Qiu等[17]研究中结果显示,对于BCLC C期和B期患者,接受TACE联合阿帕替尼治疗的患者OS和PFS中均有明显延长(mOS:17.0个月比8.5个月,mPFS:7.0个月比2.5个月),虽然mOS基本相符,但mPFS还是存在差异,本研究的PFS较Qiu等[17]研究结果的PFS稍长,可能的原因是患者肝癌的BCLC分期占比不同,本研究中B期患者15例,C期10例,而Qiu等[17]研究中C期患者22例,B期7例,所以导致患者的整体mPFS稍短,但mOS与本研究基本相似。
同时,本研究治疗后6周和12周,联合组的客观缓解率和疾病控制率均明显优于单纯TACE组,亦优于TACE联合索拉菲尼的ORR和DCR[16],提示阿帕替尼可能比索拉菲尼更能有效抑制肿瘤进展,这也符合阿帕替尼对VEGFR2靶点具有超强亲和性。既往研究提示,大剂量阿帕替尼患者出现严重不良反应的概率较大,本研究中患者常规服用低剂量阿帕替尼(首剂量为250 mg),联合组25例患者不良反应主要包括手足综合征、蛋白尿、高血压及腹泻等,与以往文献[18-21]差异不大,未出现3/4级的严重不良反应。本研究提示TACE联合低剂量阿帕替尼,在控制肿瘤进展的同时,能一定程度降低患者严重不良反应的发生率。
虽然本研究显示两组在OS和PFS方面有统计学意义,但也应考虑本研究的几个局限性。首先,本研究为单中心临床回顾性研究,尽管实施了PSM,但可能存在一定的选择性偏倚。其次,我们的结果可能会受到患者回忆偏差的影响,再者,联合组样本量较小不可回避,有必要在大样本和多中心进行前瞻性随机对照试验。我们的下一步研究将是扩大联合组样本量或是比较TACE联合其他靶向药物或免疫抑制剂对肝癌的疗效。
综上所述,对中晚期原发性肝癌患者,TACE联合阿帕替尼的治疗效果优于单纯TACE,体现在OS、PFS及肿瘤控制上。另外,服用小剂量阿帕替尼后相关的严重不良反应事件发生率低,可作为索拉菲尼的替代靶向药,值得临床推广。
——评《卵巢恶性肿瘤诊疗手册》

