MRI特征对预测儿童髓母细胞瘤分子亚型的价值
赵 江,郑 慧,张征委,金 彪
上海交通大学医学院附属新华医院放射科,上海 200092
髓母细胞瘤(medulloblastoma,MB)是儿童最常见的高级别小脑胚胎性肿瘤,占儿童中枢神经系统恶性肿瘤的15%~25%,好发于后颅窝,常侵犯小脑半球、第四脑室及脑干[1-2],世界卫生组织(World Health Organization,WHO)将其划分为Ⅳ级。WHO将MB的病理学类型分为经典型MB、大细胞/间变型MB、促纤维增生/结节型MB和MB伴广泛结节;随着分子生物学技术的快速发展,利用基因检测技术,又进一步将其分为4种分子亚型,包括WNT型、SHH型、Group 3型及Group 4型[3]。每种分子亚型都有特定的年龄分布、遗传变异,以及临床表现和预后,这在MB术后辅助治疗方案的选择上有着重要的价值[4]。
本研究回顾经手术后病理学检查证实为MB的患儿资料,经随访获得患儿基因检测分子分型报告,将符合条件的55例MB患儿纳入本次研究中,并按照分子亚型将患儿分为4组,通过整理各分子亚型患儿的临床资料、磁共振成像(magnetic resonance imaging,MRI)特征,测量弥散加权成像(diffusion-weighted imaging,DWI)参数值,并进行对照研究,为基于MRI特征预测MB分子亚型提供重要线索,以期利于临床治疗方案的调整及预后评估。
1 资料和方法
1.1 一般资料
收集2017年5月—2020年5月上海交通大学医学院附属新华医院经手术后病理学检查证实的MB患儿55例,其中男性患儿32例(58.2%),女性患儿23例(41.8%),年龄1~13岁,平均年龄(5.44±3.19)岁。依据基因检测报告将55例不同分子亚型的MB患儿分为4组。纳入标准:年龄<18岁;检查前未接受任何相关治疗;配合检查,影像学资料齐全;均经手术后病理学检查及基因检测确定分子亚型。所有患儿均行MRI平扫、MRI增强扫描和DWI检查。
1.2 仪器与方法
1.2.1 仪器
采用荷兰Philips公司的Achieva/Interal 3.0 T和美国GE公司Signal HDxt 3.0 T MRI扫描仪,使用8通道头颅线圈。所有患者均行MRI平扫及MRI增强扫描,平扫序列包括T1液体衰减反转恢复(fluid-attenuated inversion-recovery,FLAIR)序列[重复时间(repetition time,TR)为1 800 ms,回波时间(echo time,TE)为20 ms,层厚4 mm,层间距1 mm];T2-FLAIR(TR 7 000 ms,TE 120 ms,层厚4 mm,层间距1 mm);DWI(TR 5 000 ms,TE 70 ms,b=0、1 000 s/mm2)。增强扫描对比剂采用钆喷替酸葡甲胺(Gd-DTPA),剂量为0.1 mmol/kg,使用高压注射器经手背静脉留置针注入,流率为2.0 mL/s,然后再注射15 mL生理盐水,行横断面、冠状面及矢状面增强扫描,扫描参数与平扫T1-FLAIR相同。不能配合的患儿给予5%水合氯醛溶液(0.5 mg/kg)诱导入睡。根据DWI图像和MRI增强扫描图像,判定实性成分范围。
1.2.2 影像学分析方法
由2名放射科医师在未知肿瘤分子亚型结果的情况下阅片,观察肿瘤的位置、T1WI及T2-FLAIR信号特点、最大径、与脑干的关系、肿瘤边缘情况、播散与否、实性成分中囊变情况、瘤周水肿程度、实性成分的DWI信号及强化表现方式。其中瘤周水肿以水肿最大径(D)为标准,将水肿程度分为无、轻微水肿、轻度水肿、明显水肿这4个等级(无:D=0 cm;轻微水肿:0 cm<D≤0.5 cm;轻度水肿:0.5 cm<D≤1.5 cm; 明显水肿:1.5 cm<D)。与脑干关系将其分为无接触/压迫、接触/压迫、浸润这3种表现形式;按照强化区域所占整个肿瘤比例(E)划分,强化表现方式分为轻微/无强化、中度强化、明显强化(E<0.2归为轻微/无强化,0.2≤E≤0.8为中度强化,0.8<E为明显强化)。对各项观察指标进行评估,意见分歧时2名医师通过商议达成一致,如仍有异议,则进行双盲重新测量,直到结果一致。
1.2.3 数据采集与处理
将不同分子亚型MB患儿分为4组:WNT型、SHH型、Group 3型及Group 4型。DWI的图像在HD XAWI工作站上进行处理。在肿瘤实质区随机勾取5个感兴趣区(region of interest,ROI)测量其表观弥散系数(apparent diffusion coefficient,ADC)值,每1个ROI均获得一组最大ADC值(ADCmax)、最小ADC值(ADCmin)及平均ADC值(ADCmean),取其平均值得到1组新数据,记为ADC1max、ADC1min及ADC1mean。同时在健侧小脑半球脑实质勾画ROI得到正常脑组织的ADC2max、ADC2min、ADC2mean;rADC=ADC1mean/ADC2mean。ROI范围为20~50 mm2。
1.3 统计学处理
采用SPSS 25.0软件进行统计学分析,计量资料以x±s表示。分析MB MRI的特征与各分子亚型之间的关系,肿瘤MRI特征(肿瘤的位置、T1WI及T2-FLAIR信号特点、与脑干的关系、肿瘤边缘情况、播散与否、实性成分中囊变情况、瘤周水肿程度及强化表现方式)均采用χ2检验。肿瘤最大径及各分子亚型之间ADCmax、ADCmean、ADCmin及rADC比较,先行正态检验和方差齐性检验,如果数据为正态分布且方差齐性,采用单因素方差分析(One-way ANOVA)进行检验;若存在差异,再采用最小显著差异法(least-significant difference,LSD)进行组内两两比较;若正态假设和方差齐性不能满足时,采用Kruskal-Wallis秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 分子亚型
通过整理临床资料,发现本研究患儿的临床表现以头晕头痛、恶心呕吐、行走不稳、肌力减退、厌食为主。55例MB患儿中,WNT型7例(12.7%)、SHH型17例(30.9%)、Group 3型9例(16.4%)及Group 4型22例(40.0%),不同MB分子亚型的性别差异详见表1。
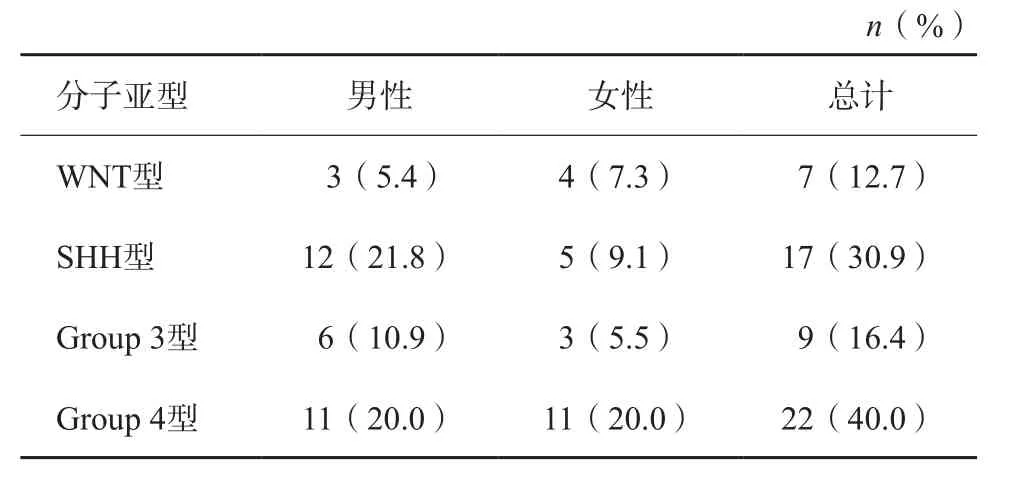
表1 55例MB患儿分子亚型性别分布
2.2 常规MRI特征表现
MB在T1WI上常呈等-低信号;在T2-FLAIR上常呈等、稍高或混杂信号;MRI增强扫描表现多样性,多呈不均质明显强化,无明显强化者少见。本研究所有患者均符合上述影像学特征,4种不同分子分型的MB如图1~4所示。在本研究中,WNT型、SHH型、Group 3型及Group 4型MB的最大径均值分别为(3.94±1.04)、(5.3 2±1.1 2)、(4.8 2±0.5 4)、(4.61±0.64)cm;经方差齐性检验,采用单因素方差分析所得,最大径差异有统计学意义(P=0.005),进一步通过LSD对肿瘤最大径的多重两两比较显示(表2),MB WNT型与SHH型及Group 3型差异有统计学意义,SHH型与Group 4型差异有统计学意义,而SHH型与Group 3型之间差异无统计学意义。常规MRI反映的其他征象表明(表3),肿瘤位置对MB分子亚型的预测较为重要,WNT型、Group 3型及Group 4型主要位于中线区,所占比例分别为71.4%、100.0%及86.4%,与47.1%的SHH型差异有统计学意义(P=0.010)。
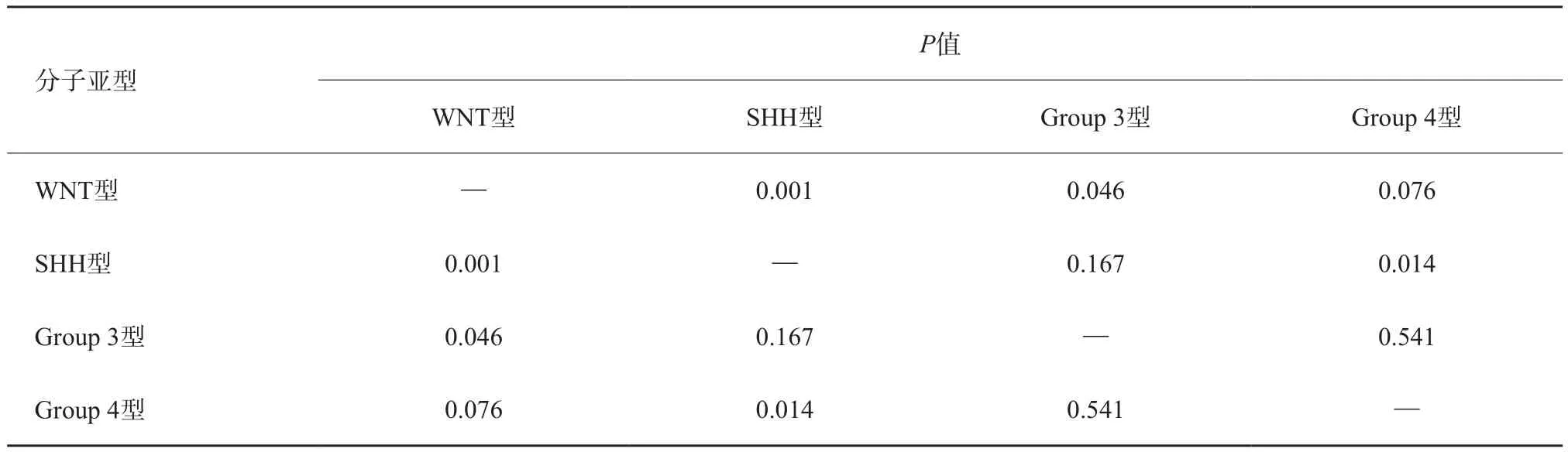
表2 肿瘤最大径与MB分子亚型间多重两两比较
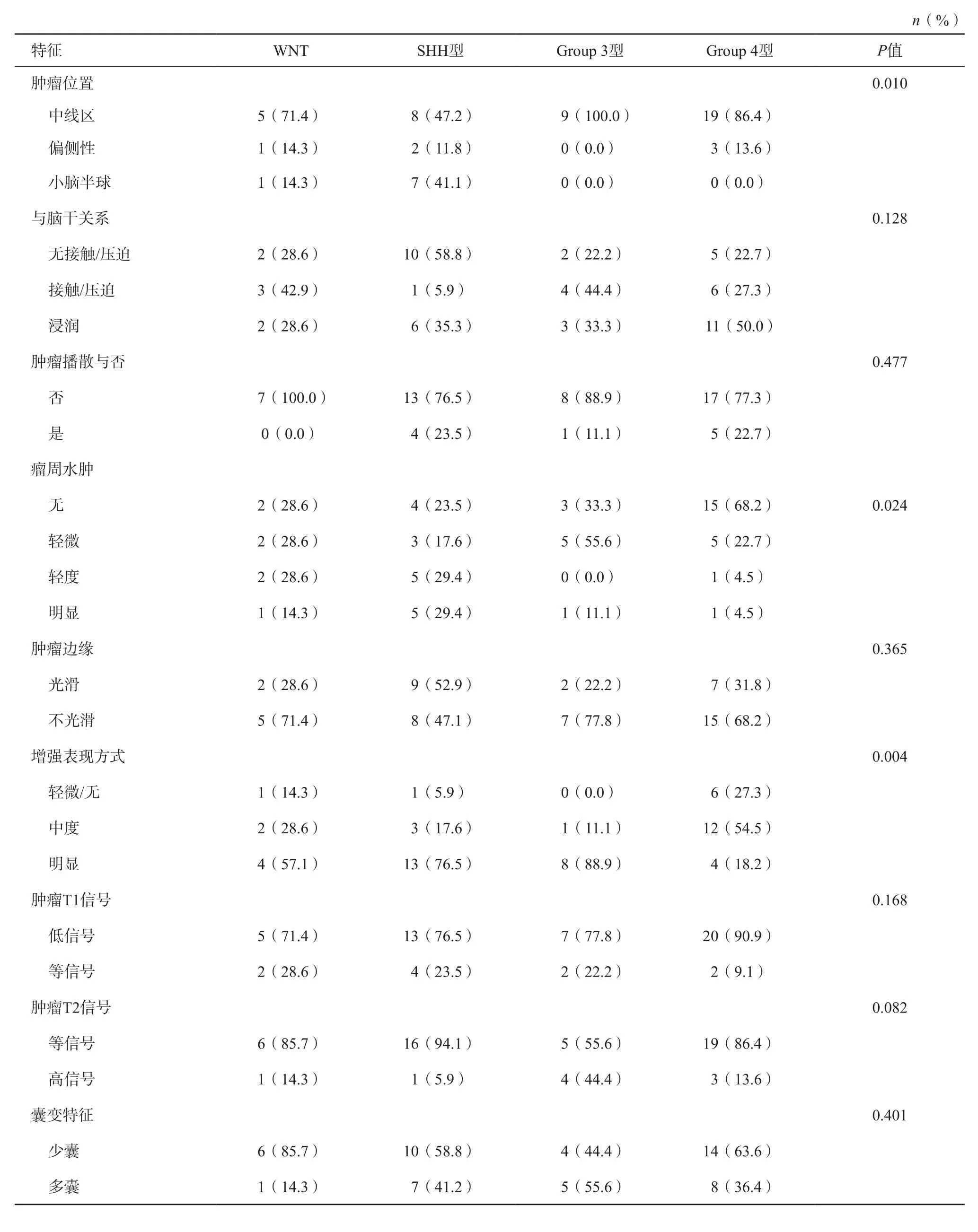
表3 常规MRI特征与MB分子亚型的关系
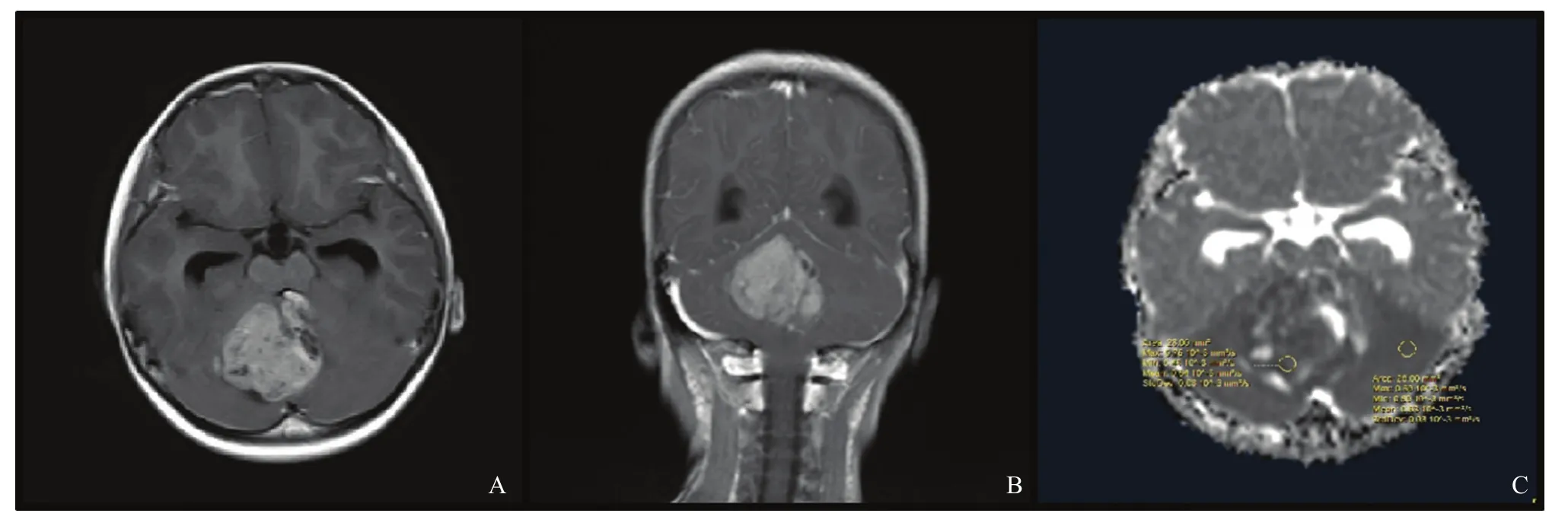
图1 典型病例1(患者,女性,5岁,WNT型MB)MRI图像
本研究显示不同分子亚型MB的瘤周水肿程度不同,差异有统计学意义(P=0.024),Group 4型约68.3%无瘤周水肿,22.7%为轻微瘤周水肿;Group 3型约33.3%无瘤周水肿,55.6%轻微瘤周水肿;而SHH型则更多地表现为轻度和明显的瘤周水肿(分别为29.4%和29.4%)。
同样,就肿瘤明显强化表现而言,Group 3型(88.9%)占据主导地位,明显高于WNT型(57.1%)、SHH型(76.5%)及Group 4型(18.2%),值得注意的是,有较大比例(27.3%)的Group 4型增强呈轻微或无强化,这与其他分子亚型MB强化方式截然不同。在本次研究中,仍有一些特征(包括肿瘤与脑干关系、播散与否、肿瘤边缘、T1WI信号特点、T2-FLAIR信号特点及肿瘤囊变特征)对MB分子亚型的预测无法提供有效帮助。
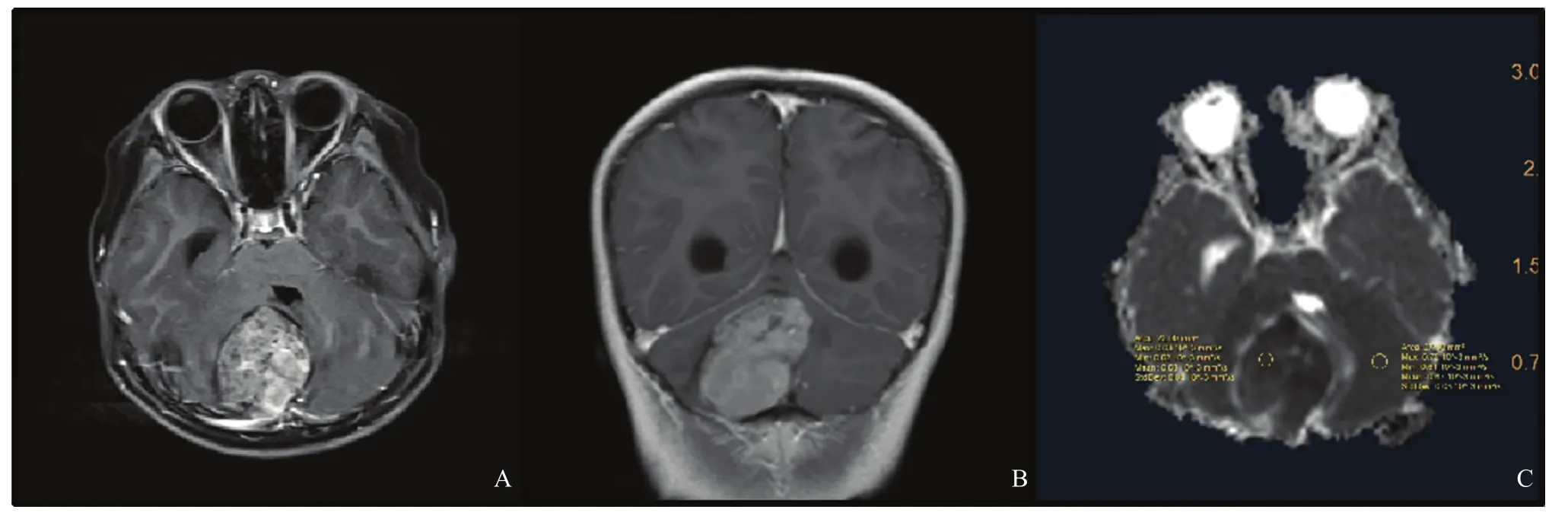
图2 典型病例2(患者,女性,6岁,SHH型MB)MRI图像
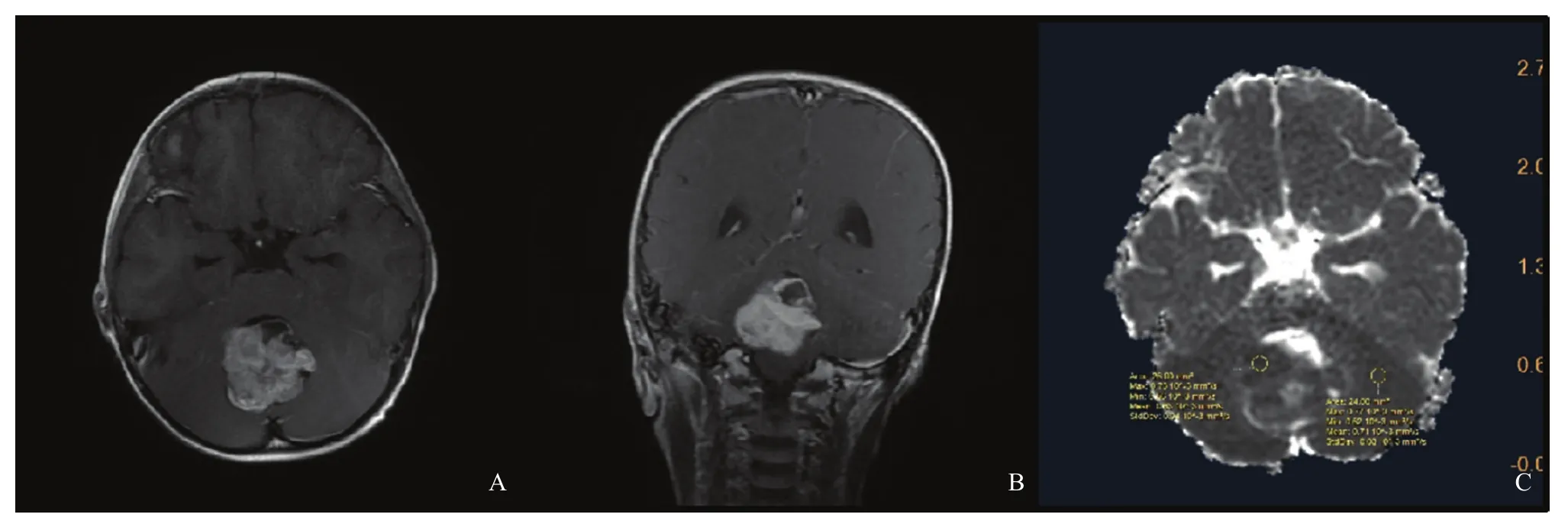
图3 典型病例3(患者,女性,2岁,Group 3型MB)MRI图像
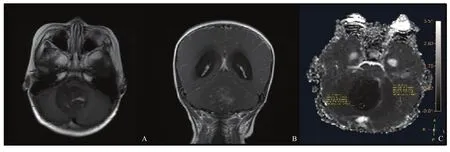
图4 典型病例4(患者,女性,4岁,Group 4型MB)MRI图像
2.3 功能MRI特征表现
55例不同分子亚型的MB患儿全部进行DWI检查,不同分子亚型ADCmax、ADCmin、ADCmean及rADC之间比较显示(表4),不同分子亚型MB的ADCmax差异有统计学意义(P<0.05),而ADCmin、ADCmean及rADC差异无统计学意义(P>0.05)。而对差异有统计学意义的ADCmax,又进一步用LSD进行多重两两比较(表5),结果显示WNT型与其他分子亚型MB差异有统计学意义。
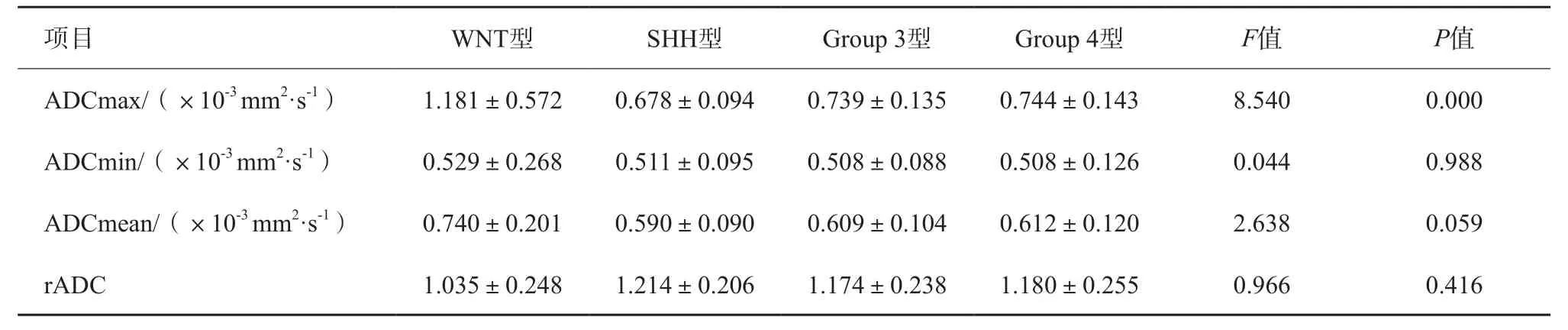
表4 不同亚型MB ADC的比较
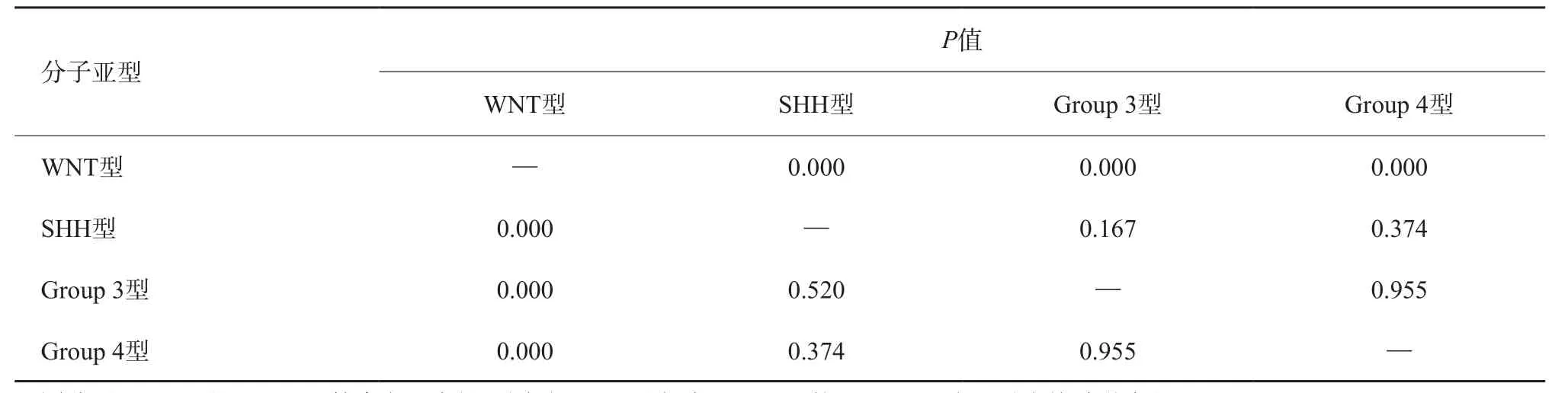
表5 不同亚型MB间ADCmax的多重两两比较
3 讨 论
MB是高度恶性的神经上皮肿瘤,是儿童最常见的后颅窝肿瘤;具有恶性程度高、预后差等特点。55例MB中,男女比例约1.4∶1.0,与相关文献[1-2]报道一致。同时,在本研究中,WNT型、SHH型、Group 3型及Group 4型4种分型所占比例也与Zhao等[5]和Kool等[6]的研究报道相符。
多项研究[7-11]表明,不同分子亚型MB的起源细胞不同;WNT型起源于脑干背侧细胞核,而SHH型起源于颗粒神经元前体细胞;Group 3型及Group 4型MB的细胞起源尚未明确。不同分子亚型的肿瘤生长位置不尽相同,也预示肿瘤位置可以预测MB不同分子亚型[12]。本研究结果也证明了肿瘤生长位置对儿童MB分子亚型的预测有一定价值:41.7% SHH型的MB位于小脑半球,与其他类型(位于中线区)差异有统计学意义。本研究中,100.0%的Group 3型和86.4%的Group 4型MB位于中线区,这与相关文献[7-8,11,13]所述一致;但其中有1例位于桥小脑角区(C-P角区),基因检测诊断为Group 4型,而在Iv等[14]研究中有1例位于C-P角区的WNT型MB,与本文分子亚型不一致,因此,C-P角区的MB分子亚型值得进一步关注与探究。在Perreault等[8]的研究中,WNT型MB表现出独特的好发位置,即小脑脚/小脑桥脑角区(CP/CPA),然而,在Zhao等[5]的研究中,大多数成人及儿童WNT型MB好发于后颅窝中线部位,在本研究中约71.4%的WNT型位于中线区,而偏侧性生长仅占总数的14.3%;Wefers等[13]曾解释,WNT型MB似乎以Luschka孔为中心的三角形区域生长,一方面沿腹侧向外生长至CP角池,另一方面向后内侧生长至枕大池,最后则延伸至第四脑室生长。
肿瘤增强表现方式同样值得关注,本研究中,按照增强所占比例将强化表现方式分为轻微/无强化、中度强化和明显强化,经统计学分析肿瘤增强表现方式有利于不同分子亚型的预测。76.5%的SHH型与88.9%的Group 3型表现为明显强化,而在Group 4型中,约81.8%呈现中度及以下的强化方式,其中突出的是,约27.3%的Group 4型表现出轻微/无强化,较其他分子分型存在明显差异(WNT型:14.3%;SHH型:5.9%;Group 3型:0.0%),这与先前的文献报道[8,15-16]所述一致。Dasgupta等[15]的研究表明,59%的WNT型表现出较均质的显著增强特征,而本研究中约占57.1%,与其结果相似。
本次研究中,4种不同分型的肿瘤最大径从小到大分别为WNT型、Group 4型、Group 3型、SHH型;通过LSD的多重两两比较显示,WNT型与SHH型及Group 3型差异有统计学意义,Group 4型与Group 3型之间差异无统计学意义;这表明WNT型MB通常是4种亚型中体积最小的。既往研究[16]中瘤周水肿表现并不突出,而本研究发现,SHH型MB主要表现为轻度或明显水肿表现,而Group 3型及Group 4型MB主要表现为无或者轻微瘤周水肿,这似乎与肿瘤的位置有着密切关系,Group 3型及Group 4型常生长在中线区,向第四脑室生长,第四脑室为其提供生长空间,因而表现出瘤周水肿程度较小;这也与Dasgupta等[16]的研究结果相一致。
本次研究对功能MRI的研究仅表现在ADC值的推测方面,鉴于不同组织学分型的MB的ADC值有明显差异[15,17],不同分子亚型的MB对应相应的组织学分型[10],因此,ADC值的探究有重要意义。本研究利用不同分子亚型MB存在弥散受限程度不同表现,随机勾画ROI获得最小的ADCmax、ADCmin及ADCmean,同时计算rADC,利用方差分析及LSD进行多重两两比较,在不同分子亚型中,只有ADCmax差异有统计学意义。在Reddy等[18]的研究中,Group 3/4型的rADC最高,而WNT型的rADC最低,且不同亚型间差异有统计学意义,提示rADC对MB分子亚型的预测有一定的潜在价值;本研究中,Group 3型与Group 4型的rADC相仿,其平均值分别为1.174和1.180,而WNT型的rADC为1.035,SHH型的rADC为1.214,与上述结果一致。但不同的是,不同亚型之间的rADC差异无统计学意义,或许这表明rADC预测MB的分子亚型的价值有限,需要更多的研究论证。
同时,本研究表明许多MRI征象不具有预测MB分子亚型的价值,例如肿瘤与脑干关系、T1WI特点、T2-FLAIR特点、肿瘤边缘及囊变等;但是总结MB的不同特征,有利于全面认识儿童MB的影像学表现及空间定位,从而更快、更准确地作出定位定性诊断。
综上,本研究显示,肿瘤位置及增强表现方式对儿童MB的预测具有重要价值,而肿瘤最大径、瘤周水肿具有一定的辅助价值。值得深思的是,关于ADC值是否有价值仍存在争议,在本研究中,不同分型间的ADCmax差异有统计学意义,证明ADCmax对预测MB的分子亚型有一定意义,但未找到相关文献明确支持该结论,同时,因ROI选取受限,无法代表整个肿瘤,所以ADCmax的价值存在一定局限性,需进一步探究。同时,本研究认为,rADC值不能区分4种分子亚型,而在Reddy等[18]表示rADC值可以区分分子亚型,这需要收集更多数据进一步研究。

