肌肽对高糖诱导的大鼠H9C2心肌细胞损伤的保护作用及其机制
张丹妮,王洪新
锦州医科大学心脑血管药物研究重点实验室,辽宁 锦州 121001
糖尿病(diabetes mellitus,DM)是影响人类健康的一种代谢紊乱疾病,已成为肿瘤和心血管病之后最重要的非传染病。专家预测2030年全球糖尿病患者可达4亿[1]。DM可从3个方面影响心血管健康,心自主神经性病变,加速冠状动脉疾病进展和糖尿病心肌病[2]。心血管疾病是DM最常见的并发症,占糖尿病患者死亡率和发病率的2/3以上,糖尿病患者心力衰竭的发病率达19%~26%[3]。因此,对糖尿病患者延缓和减轻心血管疾病的发生是十分必要且迫切的。高血糖是糖尿病心肌病(diabetic cardiomyopathy,DCM)发生的主要诱因。DCM的发展过程中,高糖和血脂异常可以通过直接调节心肌细胞内信号通路诱导细胞中粘附分子,细胞因子和趋化因子分泌增多[4],导致心肌出现低度慢性炎症。炎症在DCM起着很大的作用;控制炎症以及调控相关的炎症通路或许能改善或者预防DCM发生。肌肽(caenosine,Car)是由β-丙氨酸和L-组氨酸构成由酶促合成的内源二肽[5],具有抗衰老、抗氧化和抗糖基化作用[6]。肌肽是一种直接作用的低分子量亲水抗氧化剂,研究证明,在接近生理浓度(20~50 mmol/L)的培养基中加入肌肽可以延长细胞的寿命[7]。这些肽含有L-组氨酸的具缓冲作用的咪唑环,还含有高反应性亲核胺,赋予它们与多种脂质过氧化产物(如HNE和丙烯醛)结合的能力[8]。肌肽在心肌表达水平较高,然而糖尿病大鼠心肌肽含量降低[9],提示肌肽对大鼠心具有保护作用,但是具体分子机制不清楚。本实验通过高糖诱导建立心肌细胞损伤模型,观察肌肽对H9C2心肌细胞的保护作用以及潜在的作用机制。
1 材料与方法
1.1 实验材料
H9C2心肌细胞系由实验室保存,购自上海桑戈生物科技有限公司。肌肽(纯度>98%,苏州富士莱医药股份有限公司);二氢乙锭(南京百鑫德诺生物科技有限公);二甲基亚砜(DMSO)、噻唑蓝(MTT)、胰蛋白酶(美国Sigma公司);低糖DMEM 培养基(Hyclone公司);胎牛血清(Gbico公司);青链霉素混合液(Solarbio公司);IL-1β、IL-6、TNF-αELISA试剂盒(美国R&D公司);细胞核蛋白与细胞浆蛋白抽提试剂盒(万类生物公司);MDA、SOD测定试剂盒(南京建成生物工程有限公司);LDH、AST测定试剂盒(万类生物公司);bcl-2、bax、p65、IκB-α、lamin B、GAPDH一抗、Goat anti-Rabbit(Proteintech公司)。
1.2 实验方法
1.2.1 H9C2心肌细胞培养 将H9C2心肌细胞用添加了10%胎牛血清,青霉素(100 U/L)和链霉素(100 U/L)的低糖DMEM培养基,置于37℃、5%CO2、95%O2的无菌孵箱中培养。当细胞占培养瓶80%~90%时,进行细胞传代或收集细胞以及培养液作为对照组。细胞传代,用0.25%胰酶消化5~10 min,镜下观察大约80%的细胞形状变成近乎圆形时,加入完全培养基终止胰酶消化,用移液管轻轻吹打,将细胞从培养瓶壁上吹下来,并使其成为单细胞悬液,将细胞悬液放置离心管中离心5 min,弃上清,加入培养基,吹打混匀,接种至培养瓶中,放置于37℃、5%CO2、95%O2的无菌孵箱中培养。次日换液。根据细胞的生长情况,每2~3 d进行传代。
1.2.2 H9C2心肌细胞分组 将H9C2心肌细胞随机分为:正常低糖对照组(5.5 mmol/L葡萄糖);高糖模型组(50 mmol/L葡萄糖);甘露醇组(甘露醇15 mmol/L);(肌肽5 mmol/L+50 mmol/L葡萄糖)组;(肌肽15 mmol/L+50 mmol/L葡萄糖)组。对数生长期的细胞,换用无血清的培养基培养24 h后,按各实验组条件更换培养基培养48 h后进行后续实验。
1.2.3 MTT法 各实验组按条件持续培养,每孔加入20μl MTT(0.5 mg/ml),37℃培养箱中孵育4 h,吸出含MTT的培养液,每孔加150μl DMSO,摇床反应10 min,酶标仪测定490 nm波长处吸光度A。与空白对照组的百分比表示细胞活力。
1.2.3 二氢乙锭检测H9C2心肌细胞ROS 各实验组按条件持续培养48 h后,吸出96孔板里的培养液,用PBS冲洗3遍,加入溶于PBS的二氢乙锭(10 mol/L),37℃孵箱中避光反应1 h,荧光显微镜观察。之后迅速在荧光酶标仪上将96孔板于530 nm波长处检测吸光度。
1.2.4 试剂盒检测 取细胞上清液,按照说明书步骤进行ELISA操作。取细胞上清液,按照厂家说明书在96孔板上进行乳酸脱氢酶(LDH)及天门冬氨酸氨基转移酶(AST)含量检测。取细胞上清液,按照说明书进行丙二醛(MDA)及超氧化物歧化酶(SOD)活性检测。
1.2.5 Western-blot 提取H9C2心肌细胞全蛋白。收集细胞沉淀,将收集的细胞沉淀中加入200μl含1%PMSF的RIPA强裂解液,离心取上清。采取BCA法测定提取到的蛋白浓度,用TBST配平,将配平好的蛋白煮沸5 min,上样进行SDS-PAGE凝胶电泳,半干法进行转膜,用BSA封闭液封闭,用TBST洗膜,裁膜后分别加入稀释好的bcl-2、bax、IκB-α、p65、GAPDH一抗,4℃孵育杂交过夜,次日,二抗孵育1.5 h,滴加显影液,上机显影检测。
1.2.6 高效液相色谱法检测H9C2心肌细胞肌肽含量 按照实验分组给予细胞相应条件因素持续刺激48 h后,各组细胞上清液弃去,将细胞刮下,用PBS冲洗并离心得细胞沉淀,加入三氟乙酸溶解,离心分离,保留上清液,再加入NaOH(1 mm)调节至9。将1 ml邻苯二甲醛(OPA)溶液(10 mg/ml,溶于甲醇)、2 ml硼酸缓冲液和20μl 2-巯基乙醇混合制备衍生化试剂。OPA衍生试剂与样品按1:1混合。采用高效液相色谱-荧光检测法测定细胞中肌肽的含量。
1.3 统计学分析
2 结果
2.1 肌肽对H9C2心肌细胞活力的影响
与对照组H9C2心肌细胞存活率(100%)相比,甘露醇组细胞活力无明显差异,高糖诱导组细胞的存活率显著降低;与高糖组细胞存活率比较,肌肽(5、15 mmol/L)处理组的细胞存活率明显升高。表明肌肽对高糖引起的细胞活力降低具有改善作用(图1)。
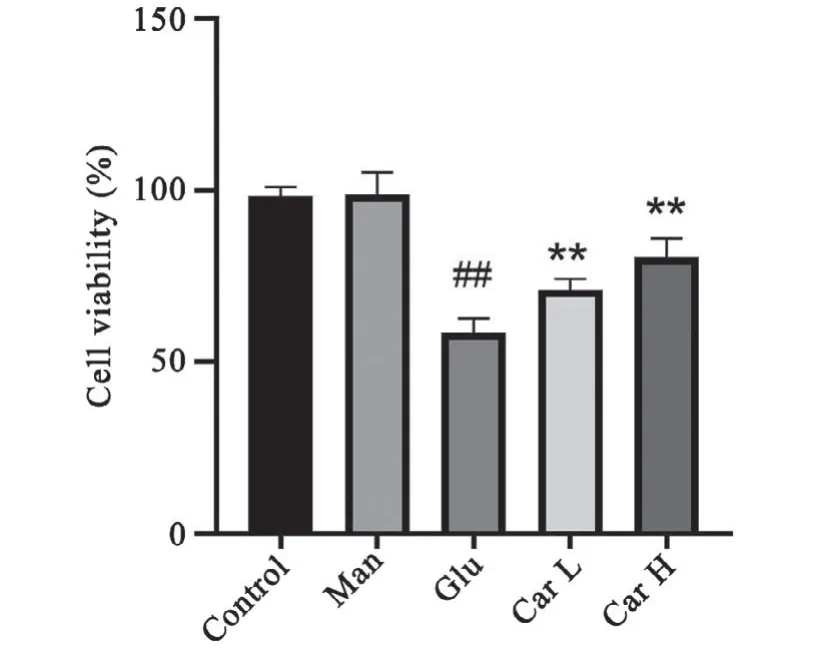
图1 MTT法测定H9C2心肌细胞活力Control:正常低糖对照组(5.5 mmol/L葡萄糖)Man:甘露醇组(甘露醇15 mmol/L)Glu:高糖模型组(50 mmol/L葡萄糖)Car L:(肌肽5 mmol/L+50 mmol/L葡萄糖)组Car H:(肌肽15 mmol/L+50 mmol/L葡萄糖)组 n=6##P<0.01与对照组比较*P<0.05,**P<0.01与高糖组比较Fig.1 Cell viability of H9C2 assayed by MTTControl:normal low glucose group(5.5 mmol/L glucose);Man:mannitol group(mannitol 15 mmol/L);Glu:high glucose group(50 mmol/L glucose);Car L:(carnosine5 mmol/L+50 mmol/L glucose)group;Car H:(carnosine 15 mmol/L+50 mmol/L glucose)group n=6,##P<0.01 vs.control group;*P<0.05,**P<0.01 vs.high glucosegroup
2.2 肌肽对H9C2心肌细胞凋亡影响
与正常对照组相比,甘露醇组H9C2心肌细胞bax、bcl-2的表达水平,bax/bcl-2比值无明显变化;高糖组H9C2心肌细胞bax蛋白表达水平,bax/bcl-2比值明显增高,bcl-2表达水平明显下降;与高糖组比较,肌肽(5、15 mmol/L)处理组H9C2细胞bax、bax/bcl-2比值明显降低,bcl-2蛋白表达水平升高。表明肌肽能够抑制H9C2心肌细胞的凋亡(图2)。
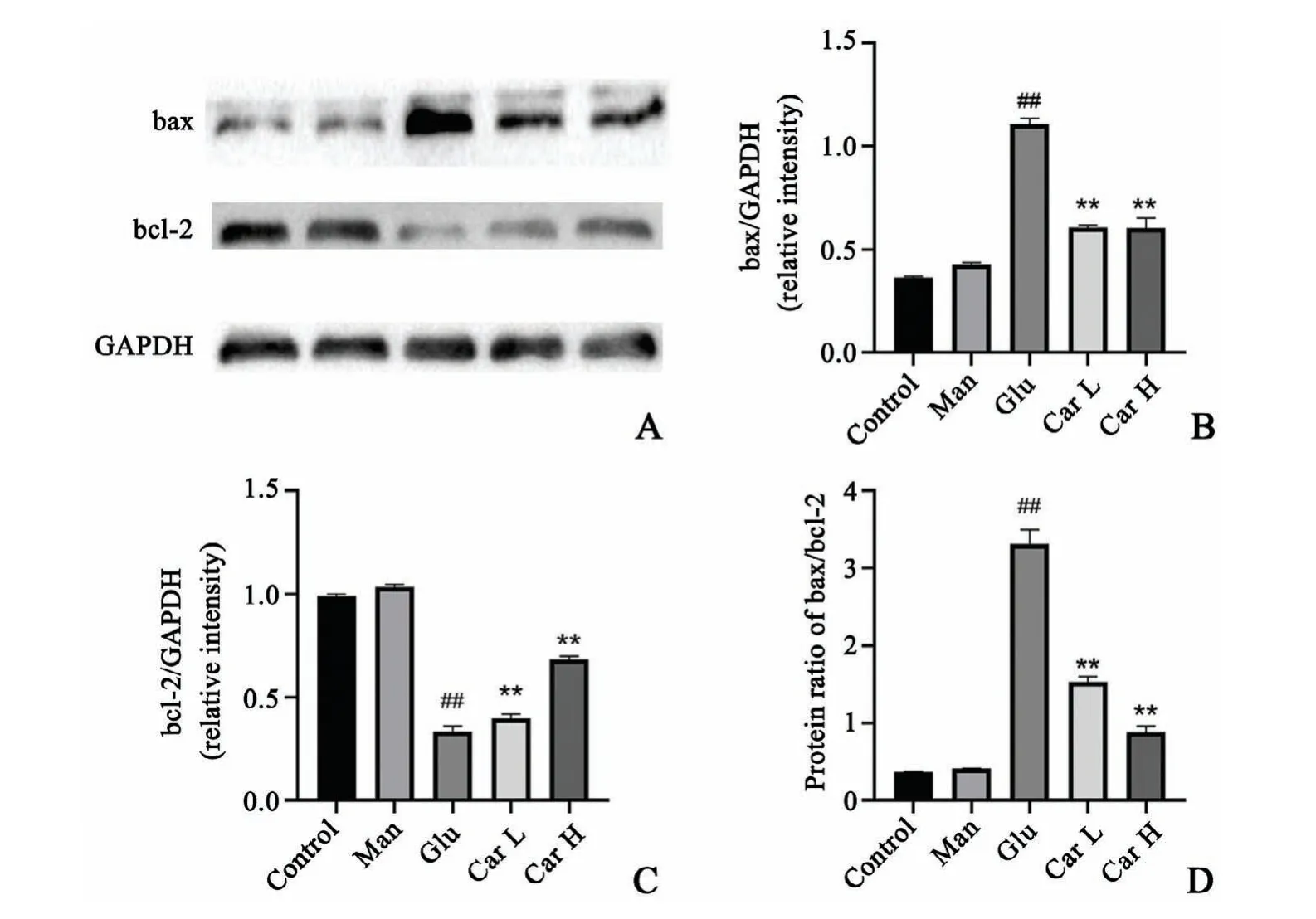
图2 肌肽对H9C2心肌细胞凋亡的影响Western blot检测bax和bcl-2在H9C2心肌细胞的表达(A)H9C2心肌细胞中bax(B)、bcl-2(C)的表达及bax/bcl-2比值(D)统计图n=4##P<0.01与对照组比较**P<0.01与高糖组比较Fig.2 Effects of carnosineon apoptosis of H9C2 cardiac myocytesA:Western blot detected bax and bcl-2 expression in H9C2 cardiomyocytes;B:Diagram of bax expression in H9C2 cardiomyocytes;C:Diagram of bcl-2 expression in H9C2 cardiomyocytes;D:Diagram of bax/bcl-2 ratio in H9C2 cardiomyocytes statistics n=4,##P<0.01 vs.control group;**P<0.01 vs.high glucose group
2.3 肌肽对H9C2心肌细胞毒性损伤的影响
与对照组相比,甘露醇组细胞上清液中LDH、AST的含量变化不明显,高糖组细胞上清培养液中LDH、AST含量明显升高;与高糖组相比,肌肽(5、15 mmol/L)处理组的上清液中LDH、AST含量有所降低。表明肌肽能减轻高糖诱导的细胞毒性,减弱细胞损害,改善细胞状态,且与剂量浓度有关(图3)。
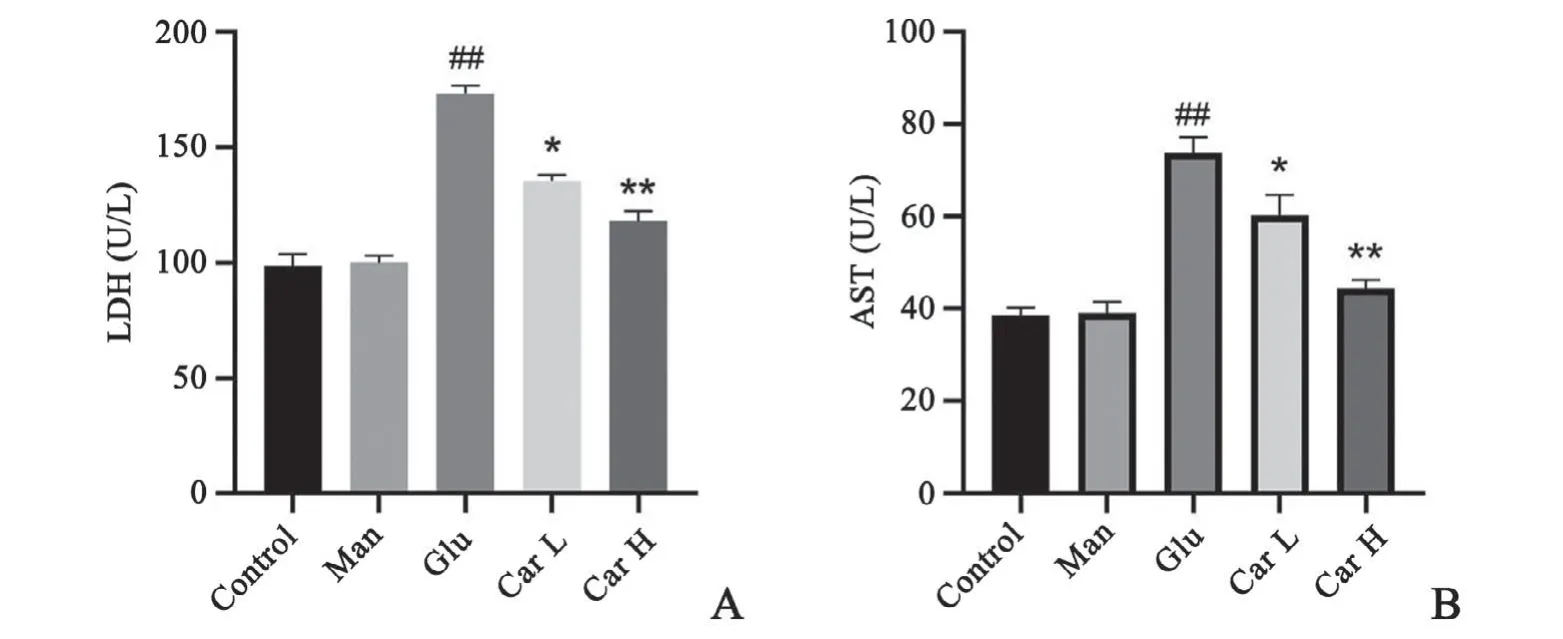
图3 H9C2心肌细胞中LDH(A)及AST(B)含量统计图n=8##P<0.01与对照组比较*P<0.05,**P<0.01与高糖组比较Fig.3 Diagram of LDH and ASTcontent in H9C2 cardiac myocytesn=8,##P<0.01 vs.control group;*P<0.05,**P<0.01 vs.high glucose group
2.4 肌肽对H9C2细胞炎症反应的影响
与对照组相比,甘露醇组细胞上清液中IL-1β,IL-6与TNF-α的含量变化不明显,高糖组细胞上清培养液中IL-1β,IL-6与TNF-α含量明显升高;与高糖组相比,肌肽(5、15 mmol/L)处理组的上清液中IL-1β,IL-6与TNF-α含量有所降低。表明肌肽能减轻高糖诱导的细胞炎症反应,且与剂量浓度有关(图4)。
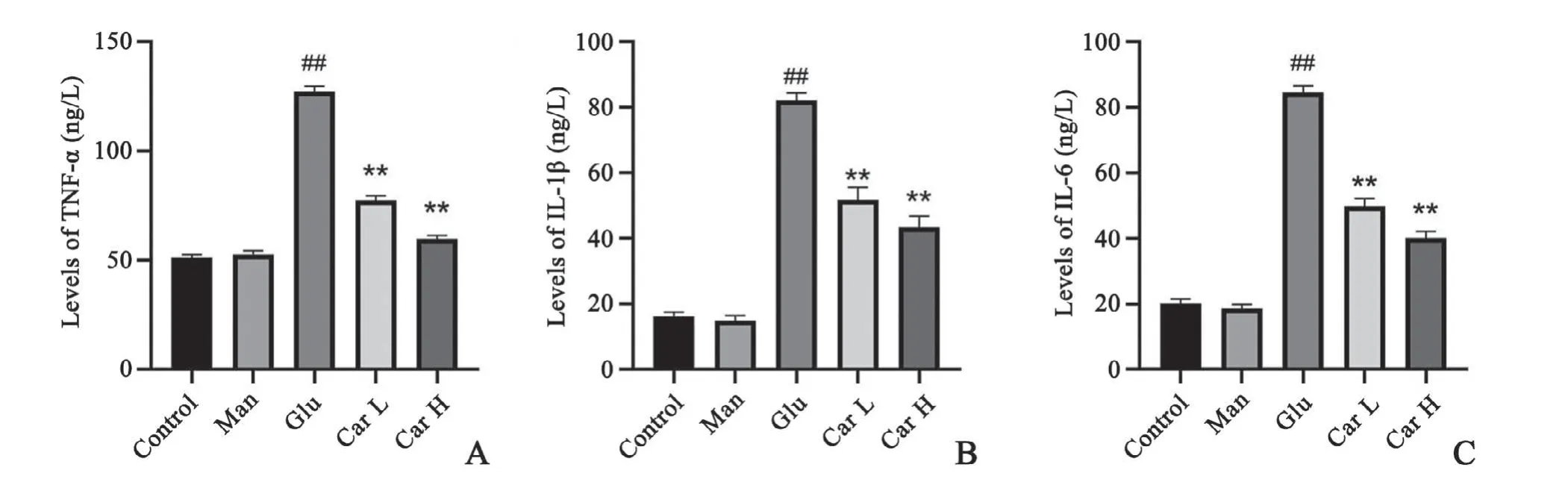
图4 H9C2心肌细胞TNF-α(A)、IL-1β(B)和IL-6(C)含量统计图n=8##P<0.01与对照组比较,*P<0.05,**P<0.01与高糖组比较Fig.4 Diagram of TNF-α(A),IL-1β(B)and IL-6(C)content in H9C2 cardiac myocytesn=8,##P<0.01 vs.control group;*P<0.05,**P<0.01 vs.high glucose group
2.5 肌肽对H9C2心肌细胞中ROS的含量影响
与对照组相比,甘露醇组细胞中ROS的含量变化不明显,高糖组细胞中ROS含量明显升高;与高糖组相比,肌肽(5、15 mmol/L)处理组ROS含量有所降低。表明肌肽通过减少H9C2心肌细胞中超氧阴离子的含量,能改善高糖诱导的细胞氧化应激水平(图5)。
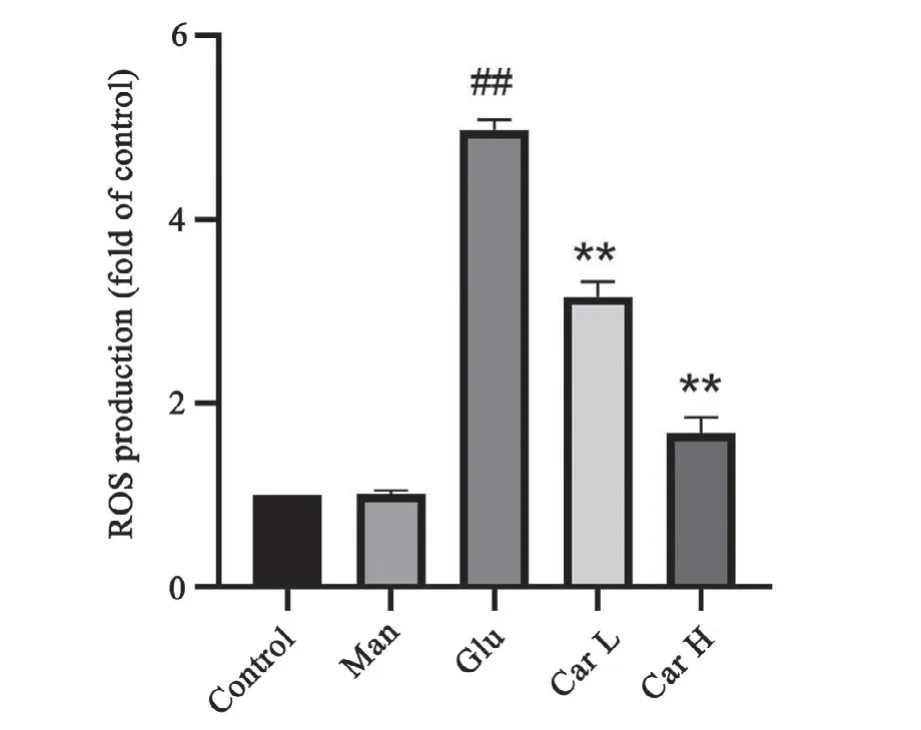
图5 H9C2心肌细胞活性氧含量统计图n=8##P<0.01与对照组比较 *P<0.05,**P<0.01与高糖组比较Fig.5 Diagram of on ROS content of H9C2 cardiac myocytesn=8,##P<0.01 vs.control group;*P<0.05,**P<0.01 vs.high glucose group
2.6 肌肽对H9C2细胞中MDA、SOD的含量影响
与对照组相比,甘露醇组细胞中MDA、SOD的含量变化不明显,高糖组细胞中MDA含量升高,SOD活性减低;与高糖组相比,肌肽(5、15 mmol/L)处理组MDA含量有所降低,SOD活性增强。表明肌肽可能通过减少H9C2心肌细胞中MDA的含量,提升SOD活性,提升细胞的抗氧化能力(图6)。
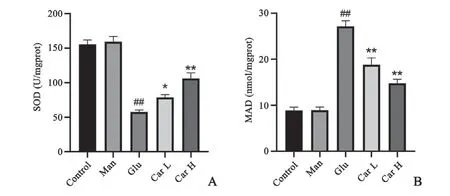
图6 H9C2心肌细胞SOD(A)和MDA(B)含量统计图n=8##P<0.01与对照组比较*P<0.05,**P<0.01与高糖组比较Fig.6 Diagram of SOD(A)and MDA(B)activity in H9C2 cardiac myocytesn=8,##P<0.01 vs.control group;*P<0.05,**P<0.01 vs.glucose group
2.7 肌肽对H9C2细胞p65和IκB-α蛋白表达水平的影响
与正常组相比,甘露醇组H9C2心肌细胞核中的p65蛋白表达水平,胞浆中的IκB-α的表达水平无明显变化;高糖组H9C2心肌细胞核中p65蛋白表达水平明显增高,胞浆中IκB-α表达明显下降;与高糖组比较,肌肽(5、15 mmol/L)处理组H9C2心肌细胞核中p65蛋白含量明显降低,同时细胞浆中IκB-α蛋白含量表达升高,表明肌肽能抑制p65从胞浆转位至细胞核,进而抑制p65的激活并调控下游相关炎症因子释放(图7)。
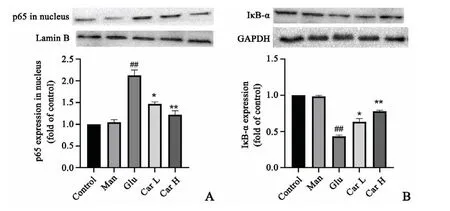
图7 Western blot检测H9C2心肌细胞核中p65(A)和胞浆中IκB-α(B)蛋白表达n=4##P<0.01与对照组比较*P<0.05,**P<0.01与高糖组比较Fig.7 The proteins expression of p65(A)in nucleus and IκB-α(B)in H9C2 cardiac myocytes detected by Western blotn=4,##P<0.01 vs.control group;*P<0.05,**P<0.01 vs.high glucose group
2.8 H9C2心肌细胞中肌肽的含量
与对照组相比,甘露醇组细胞中肌肽的含量变化不明显,高糖组细胞中肌肽含量明显减少;与高糖组相比,肌肽(5、15 mmol/L)处理组细胞中肌肽含量有所升高。表明高糖刺激可以引起心肌组织中肌肽减少,而补充肌肽可以增加细胞中肌肽含量(图8)。
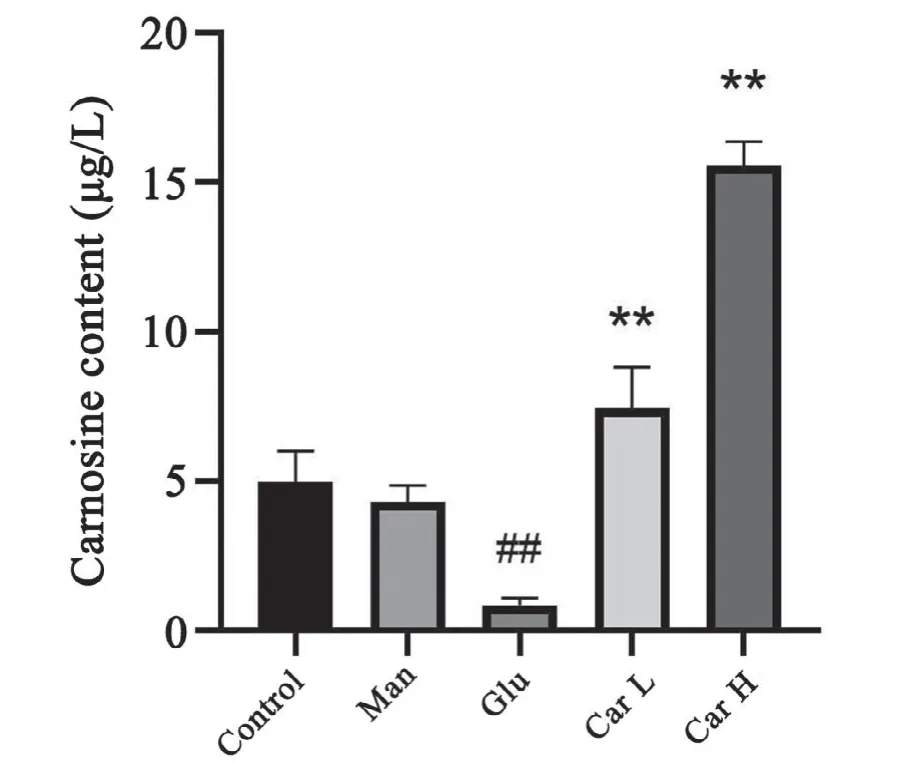
图8 肌肽对H9C2心肌细胞肌肽含量的影响n=4##P<0.01与对照组比较*P<0.05,**P<0.01与高糖组比较Fig.8 Effects of carnosine on carnosine content of H9C2 cardiac myocytesn=4,##P<0.01 vs.control group;*P<0.05,**P<0.01 vs.high glucose group
3 讨论
DM作为一种以慢性高脂血症和高血糖状态为特征的疾病,影响全身的脏器功能,包括眼、肾、心、血管和外周神经[10]。糖尿病的主要原因包括胰岛功能受损引起的胰岛素缺乏和细胞对胰岛素敏感性降低引起的高血糖症[11]。高血糖还可以通过改变线粒体功能来增加心肌细胞程序性死亡[12]。
本实验采用葡萄糖(50 mmol/L)作用于大鼠H9C2心肌细胞,模拟机体高糖环境下的心肌,MTT方法检测H9C2心肌细胞活力,结果显示,高糖可以诱导H9C2心肌细胞损伤;以甘露醇作为对照,结果显示,高渗条件并不能造成H9C2心肌细胞损伤。进一步检测H9C2心肌细胞的酶学指标,说明在高糖环境下H9C2心肌细胞的细胞膜受损,造成细胞损害。肌肽能有效提高H9C2心肌细胞的存活能力,减弱高糖引发的细胞损害;肌肽能减轻高糖诱导的细胞毒性,改善细胞状态。采用免疫印迹法检测凋亡蛋白bax、bcl-2的蛋白水平以及bax/bcl-2比值,结果表明在高糖环境下H9C2心肌细胞凋亡增加,肌肽处理过的细胞凋亡蛋白水平降低,说明肌肽可以改善H9C2心肌细胞的凋亡。检测高糖环境下H9C2心肌细胞氧化应激水平,发现H9C2心肌细胞氧化还原系统失衡,细胞内氧化应激水平升高;肌肽能够清除细胞内过剩的ROS,减少细胞损害,肌肽预处理可以改善由于高糖诱导产生的氧化抗氧化系统不平衡,减弱氧化应激。有研究显示,各种糖尿病小鼠模型中细胞炎症因子浓度增加,表明炎症对糖尿病性心肌病的发展有重要作用。本研究采用ELISA法检测细胞上清液中IL-1β、IL-6与TNF-α的含量,结果显示高糖环境下H9C2心肌细胞中炎症分子上调,表明肌肽能显著抑制高糖诱发的炎症反应,提升细胞的活力。
有研究表明,肌肽会抑制ROS的增加[13],ROS会抑制IκB-α的磷酸化从而影响NF-κB的活化[14]。NFκB通路是调节细胞炎症反应的关键信号通路,ROS的产生促进NF-κB的p65核易位,激活NF-κB信号传导途径[15]。通过蛋白质印迹法检测H9C2心肌细胞p65、IκB-α在细胞中的蛋白表达水平表明,与对照组相比,高糖实验组H9C2心肌细胞p65的表达水平在细胞核中明显升高,而IκB-α表达下降,与高糖实验组相比,肌肽(5、15 mmol/L)预处理能降低p65在细胞核内的表达,同时提高IκB-α的表达。这可能因肌肽清除了细胞内过多的ROS,减少氧化应激,从而抑制了NF-κB的活化转位。
综上所述,肌肽作为体内存在的二肽,是继维生素C和维生素E后发现的新型抗氧化剂,目前的研究中,肌肽可以减弱其他的糖尿病并发症,但是在心肌的研究甚少。本实验从细胞水平上探讨了肌肽对细胞的保护作用,并研究其机制是否与减弱氧化应激,抑制NF-κB活性,削弱炎症反应有关。对肌肽的抗氧化作用有进一步的了解。肌肽可以削弱高糖引起的炎症,提高H9C2心肌细胞的存活能力,可能与ROS/NF-κB信号通路相关,为肌肽的心肌保护作用提出了新的机制,也为DCM的抗氧化治疗提供了理论基础。