颞叶外侧癫痫患者脑组织NHE1及凋亡相关蛋白的表达
吴旭玲,董楝,彭爽,叶兰,徐祖才,冯占辉
1.贵州医科大学附属医院神经内科,贵阳 550004;2.贵州医科大学基础医学院,贵阳 550004;3.遵义医科大学附属医院神经内科,贵州 遵义 563099
癫痫是大脑皮层神经元异常放电所导致的以痫性发作为特点的临床综合征[1]。反复痫性发作导致大脑皮质神经元凋亡、坏死及丢失,然而机制尚不明确[2~4]。钠氢交换体-1(Na+/H+exchanger-1,NHE1)属于NHE家族成员[5]。Kang等[6]在癫痫易感性沙鼠痫性发作后取海马进行研究,结果显示海马中NHE1蛋白在癫痫发作3 h明显升高,6 h恢复正常,提示NHE1蛋白增高可能与癫痫发作密切相关。本课题组前期研究证实颞叶外侧癫痫患者脑组织m-calpain和μcalpain蛋白表达增高[7,8],既往研究证实calpian蛋白表达增高与神经元凋亡、坏死等病理变化密切相关[9]。calpain表达上调或者下调是通过钙信号通路调控的。NHE1可以通过对钙信号通路的调控直接或间接影响calpain蛋白表达,因此本组推测NHE1可能通过调控calpain的表达影响细胞凋亡及坏死的发生。目前尚未见NHE1在颞叶外侧癫痫患者手术切除大脑标本中表达特点相关研究。本课题组收集颞叶外侧癫痫患者手术切除大脑标本,探讨NHE1在颞叶外侧癫痫患者脑组织中的表达特点,并对脑组织进行凋亡的相关研究。
1 材料与方法
1.1 研究对象及分组
贵州医科大学附属医院伦理委员会已审批本实验,伦理批件号No.146。实验严格遵守伦理委员会要求。选取贵州医科大学附属医院和遵义医科大学附属医院神经外科16例颞叶外侧癫痫患者作为癫痫组,10例颞叶肿瘤和脑出血患者作为对照组。
癫痫组包括男10例,女6例;年龄11~48岁,平均(40.34±7.45)岁;简单部分性发作患者2例,复杂部分性发作患者7例,部分性发作继发全面性发作患者7例。入组条件[10]:①具有典型临床表现,脑电图提示单侧颞区放电;②用3种及以上的临床常用抗癫痫药(左乙拉西坦、奥卡西平、丙戊酸、拉莫三嗪等药物),癫痫门诊治疗2年及以上,但仍有发作,每月2次以上;③病人及其家属知情同意且签署相关协议书。排除标准:①颅内与癫痫发作相关的感染性疾病可能;②合并有严重精神病病史;③家属或者患者本人不同意。16例患者均接受单侧部分颞叶手术切除,切除的颞叶组织作为实验标本。
对照组中男7例,女3例;年龄14~55岁,平均(38.45±5.75)岁。标本来源于颞叶肿瘤或者颞叶脑出血手术患者,并以病灶周边相对正常脑组织作为对照。该组所有患者符合下列条件:①脑组织HE染色基本正常;②病人及其家属知情同意并签署相关协议书。
两组患者基线资料详见表1~2。统计学分析显示年龄无显著差别(P>0.05)。

表1 16例颞叶外侧癫痫患者临床特点Tab.1 Clinical characteristics of 16 patients with lateral temporal lobe epilepsy
1.2 实验方法
1.2.1 人脑组织处理 切除的脑组织分成小块,部分脑组织块用灭菌锡箔纸包裹于-80℃冰冻储存,应用于RT-PCR和Western blot检测;部分脑组织用生理盐水冲洗后以多聚甲醛固定,然后梯度葡萄糖脱水,液氮冷冻然后进行组织切片,切片厚度10μm,切片贴于聚赖氨酸包被的载玻片上,-80℃保存,用于免疫荧光检测;部分脑组织采用石蜡包埋,包埋块切片厚5 μm,用于免疫组化分析。

表2 10例对照组临床特点Tab.2 Clinical characteristics of 10 cases in the control group
1.2.2 HE染色与免疫组化 石蜡切片在二甲苯中脱蜡,并于柠檬酸钠缓冲液(10 mmol/L,pH 6)中以微波炉加热10 min(98℃)进行抗原修复。在37℃恒温浴箱内,切片置0.3%H2O2中孵育10 min,然后用0.4%Triton X-100(Sigma)处理15 min,加入山羊血清针对非特异性抗原进行封闭(中杉金桥)。将切片与兔抗人NHE1的主要抗体(1:50;GeneTex)4℃孵育过夜。用PBS洗涤3次后,鼠抗兔二级抗体37℃孵育30 min,亲和素-生物素复合液(中山金桥)37℃孵育30 min,PBS洗涤。用二氨基苯并胺(中杉金桥)检测免疫反应性,苏木精复染。质膜呈棕色染色的细胞被认为是NHE1表达阳性的细胞。作为阴性对照,用PBS代替原发性或继发性抗体[10]。用PM 20自动显微镜(奥林巴斯,日本)采集图像。
1.2.3 免疫荧光染色 取出冰冻切片,室温晾干,然后用PBS缓冲液冲洗,5 min后将切片浸泡于枸橼酸钠缓冲液(0.01 mol/L,pH 6.0),放于微波炉中选择高火煮沸,5 min后再调至低火煮沸15 min,随后取出在室温下冷却。0.4%Triton X-100(Sigma)37℃孵育,15 min后加入山羊血清(中杉金桥)37℃封闭非特异性抗原,甩掉多余血清,将配好的混合一抗滴入后4℃过夜。兔抗人NHE1(1:100,GeneTex),与Neun(神经元标志物)的混合,小鼠抗人Neun抗体(1:50,Abcam)。次日,在37℃水浴箱复温,1 h后冲洗一抗,滴加FITC标记的山羊抗兔二抗(1:100,中杉金桥)和TRITC标记的猴抗小鼠二抗(1:100,中杉金桥),将混合抗体在37℃避光孵育1 h,然后冲洗二抗,最后用50%甘油封片[8]。
1.2.4 蛋白印迹(Western blot)取出冰冻脑组织,磨碎脑组织,按试剂盒说明书提取脑组织中的蛋白(总蛋白提取试剂盒,凯基),用BCA试剂测定所提取的蛋白浓度(碧云天)。从样品中提取50μg蛋白于8%SDS-PAGE上跑电泳,并电转到PVDF膜上。室温下用5%BSA孵育PVDF纤维膜1.5 h,然后用兔抗人一抗NHE1(1:4000,GeneTex),和β-actin(1:1000,Santa Cruz)孵育PVDF膜4℃过夜;次日,室温下孵育NHE1膜,然后加入山羊抗兔二抗(1:5000,中杉金桥)中2 h。同样方法应用兔多克隆一抗Bcl-2(1:4000,GeneTex)和Bax(1:4000,GeneTex)。在暗室中加入ECL显色试剂(Pierce公司)对蛋白条带进行显影。用Quantity One 4.6.2软件分析NHE1的相对含量,βactin作为内参[10]。
1.3 统计学分析
收集数据,采用SPSS 24.0软件对数据进行处理,计量资料表达采用均数±标准差(),如数据为正态分布资料,两组间的比较应用独立样本t检验,如数据不符合正态分布,两组间比较应用秩和检验,以α=0.05为检验水准,P<0.05为有统计学差异。多组间比较应用单因素方差分析,组间比较采用LSD法。
2 结果
2.1 HE染色结果
癫痫组脑组织有神经元丢失,小胶质细胞明显增高,星型胶质细胞增高(图1B~D);对照组显示颞叶组织神经元、星型胶质细胞、小胶质细胞未见明显异常(图1A)。
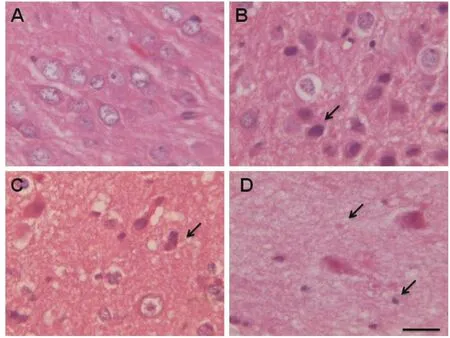
图1 脑组织切片HE染色结果(标尺100μm)A:对照组左侧颞叶脑组织神经元形态基本正常 B:痫患者1,左侧颞叶脑组织大量神经元浓缩坏死(箭头)C:癫痫患者2,小胶质细胞增生以及小胶质细胞进入坏死神经元 D:痫患者3,箭头示小胶质细胞增生,神经元丢失明显Fig.1 The HE staining results of brain tissuesectionA:The morphology of neurons in the left temporal lobe was basically normal in the control group;B:Case 1,the left temporal lobe brain tissue,the black arrow indicated that a number of neurons were condensed and necrotic;C:Case 2,microglia proliferated and microglia entered into necrotic neurons;D:Case 3,the arrows indicated that microglia proliferated and neurons lost significantly.Scalebar 100μm
2.2 免疫组化和免疫荧光结果
癫痫组和对照组的神经元细胞内均可见棕黄色的阳性颗粒,集中于细胞膜和细胞浆,癫痫组平均OD值为(0.475±0.074),对照组平均OD值(0.215±0.052),二者比较有统计学差异(P<0.05),见图2。免疫荧光结果显示脑组织中NHE1(红色信号)和Neun(绿色信号)共定位,见图3。
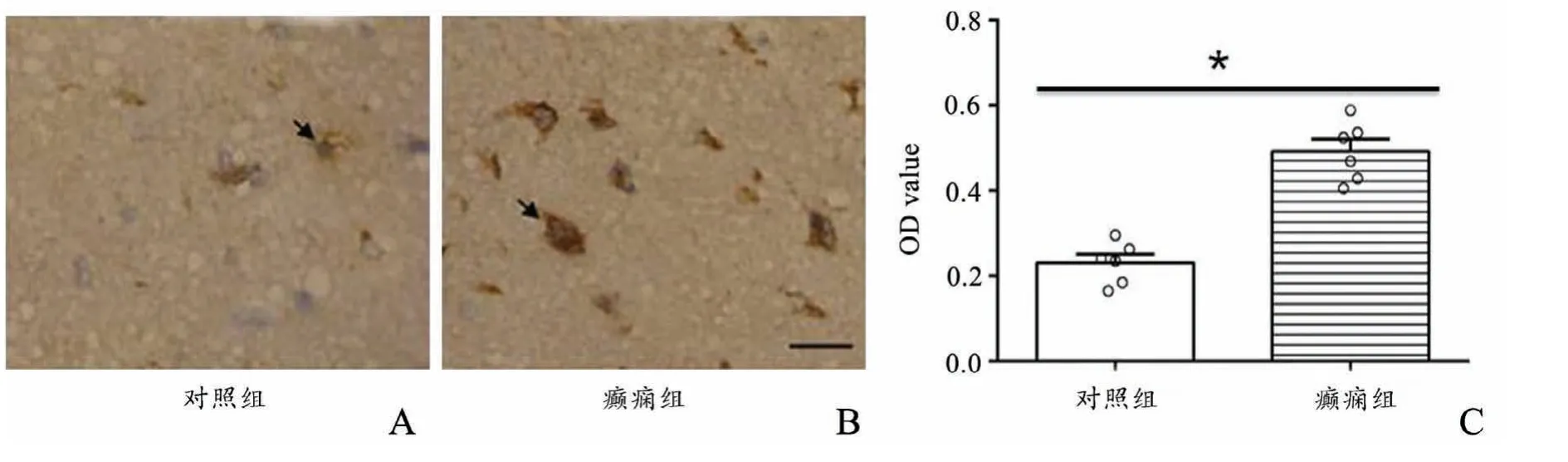
图2 免疫组化结果(标尺50μm)癫痫组(A)和对照组(B)神经元细胞内均可见棕黄色阳性颗粒,集中于细胞膜和细胞浆 C:计图*P<0.05Fig.2 The results of immunohistochemistryThe neurons in the epileptic group(A)and the control group (B) had brownish yellow positive granules,which were mainly concentrated in the cell membrane and cytoplasm.C:Statistical diagram Scalebar 50μm
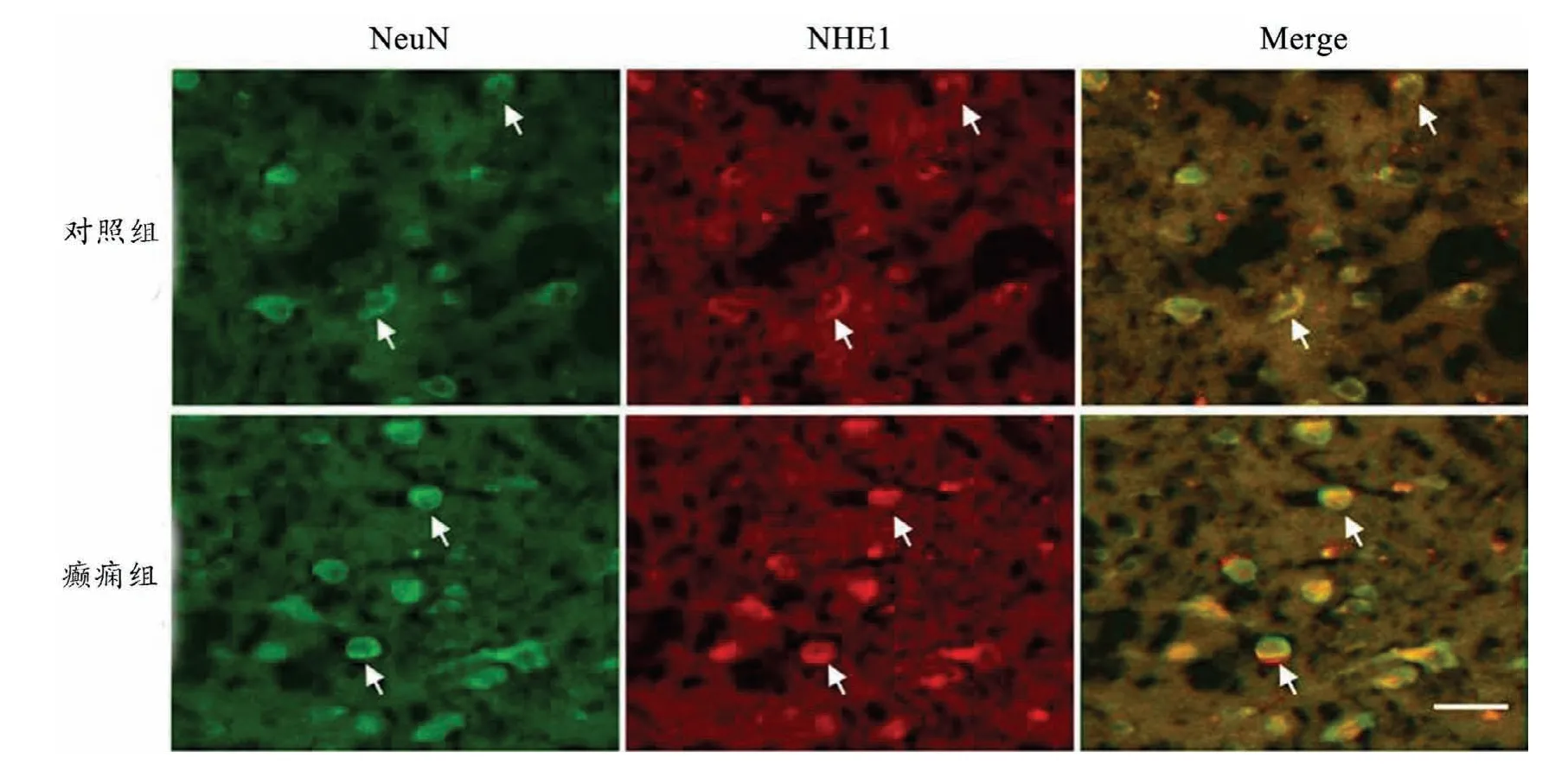
图3 免疫荧光结果(标尺50μm)癫痫患者切除的脑组织中NHE1在神经元表达明确,箭头示神经元中NeuN和NHE1共表达(NeuN为神经元标志物)Fig.3 The results of immunofluorescenceThe expression of NHE1 in neurons wasclear(NeuN was the marker of neurons),and the white arrows showed the coexpression of NeuN and NHE1 in neurons,Scalebar 50μm
2.3 Western blot结果
Western blot结果提示癫痫组NHE1蛋白表达较对照组NHE1蛋白表达增高(P<0.05)。癫痫组Bcl-2蛋白表达较对照组Bcl-2蛋白表达下降(P<0.05);癫痫组Bax蛋白表达较对照组Bax蛋白表达增高(P<0.05),见图4。
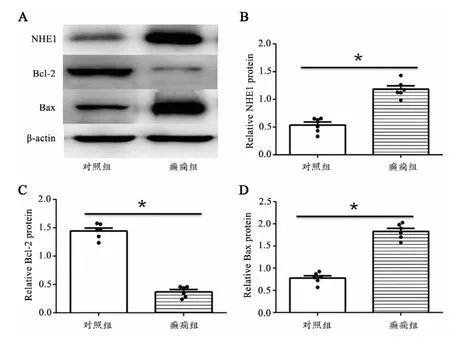
图4 Western blot结果A:蛋白条带B:NHE1蛋白定量C:Bcl-2蛋白定量D:Bax蛋白定量*P<0.05Fig.4 The results of Western blotA:Protein bands;B:Statistical diagram of the protein expression of NHE1;C:Statistical diagram of the protein expression of Bcl-2;D:Statistical diagram of the protein expression of Bax;*P<0.05
3 讨论
NHE1是1989被克隆出来的蛋白,属于NHE家族成员,表达在细胞膜上,在脑组织表达较广泛[11]。NHE1作为细胞膜蛋白可以结合多种信号分子,结合后形成转导复合物,可以对胞内外信号做出快速而准确的反应[12,13,14]。最主要功能是防止细胞酸中毒,维持酸碱平衡。
本研究HE染色可见癫痫患者颞叶脑组织神经元丢失,小胶质细胞增多,卫星现象明显,星型胶质细胞增生。免疫组化结果提示癫痫组NHE1表达较对照组增高,Western blot结果提示NHE1蛋白表达增高,且凋亡相关蛋白Bax表达增高,Bcl-2表达下降。提示NHE1参与癫痫的发生或者发展,可能与凋亡密切相关。既往神经病理学专家研究显示癫痫非肿瘤性病变是导致癫痫常见的原因,包括海马硬化、皮质发育畸形、Sturge-Weber综合征和Rasmussen脑炎等,且HE染色可见神经元丢失,胶质细胞增生,海马硬化等等表现[4,15]。本研究与之一致。Li等学者[16]研究发现癫痫模型鼠大脑皮质神经元凋亡及自噬明显,且自噬发生在凋亡之后。本研究也发现在癫痫患者脑标本中凋亡现象明确。
本研究采用不同方法学手段,从组织学、分子生物学层面均证实NHE1表达在癫痫患者脑组织中表达是明显增高的。NHE1结构分为跨膜区域和细胞内调节区域。其功能为将胞内的H+和胞外的Na+进行进行1:1交换,调控细胞内的酸碱度[17]。NHE1表达增高,调控细胞酸碱平衡的功能增强。该结果提示NHE1表达增高可能改善神经元在痫性放电后所致的酸中毒,把H+排出去,把Na+交换进来。当过度的Na+进入神经细胞后,细胞内Na+超载也会刺激Na+/Ca2+交换体(NCX)活性增强,从而增加细胞内Ca2+浓度[13]。结合本课题组前期研究已经发现与神经元凋亡、坏死等病理变化密切相关的m-calpain和μ-calpain蛋白表达增高[7,8]。神经元内Ca2+离子浓度变动较大时,可以激活m-calpain和μ-calpain蛋白,进而促发水解酶对细胞骨架和相关蛋白质产生降解作用,从而破坏结构蛋白以及酶的功能,导致神经元凋亡或坏死。
综合上述分析,本课题组认为NHE1可能机制如下:由于神经元反复放电后缺血缺氧,神经元内呈现酸化状态,NHE1被激活,NCX活性增强,导致胞内Ca2+浓度超载。Ca2+进一步激活mμ-calpain最终导致Bax蛋白表达增高,以及Bcl-2蛋白表达下降,凋亡发生。
本研究有不足之处。该研究是基于临床标本推测发病机制,无法开展机制相关研究,也无法进行相关干预研究。在进一步的动物及细胞学实验中将深入探讨发病机制。
总之,NHE1表达增高可能是癫痫发生和发展的促发因素,在癫痫反复发作过程中,为维持酸碱平衡,过度激活导致钙离子激活,促进凋亡发生可能性较大。本研究为进一步深入探讨癫痫机制提供了研究基础,同时有助于NHE1相关药物的研发。