基于高分辨T2WI的影像组学中不同分割方法对直肠癌术前T分期的影响
周 振 沈 浮 陆海迪 王敏杰 陆建平
直肠癌是消化系统最常见的恶性肿瘤之一。术前对直肠癌T分期的准确评估,是影响治疗方案的选择及预后评价的关键因素[1]。传统MRI检查仅在形态学上对肿瘤进行术前分期评估,但无法满足目前精准医疗的要求[2]。影像组学(radiomics)应用高通量自动化数据特征化算法,将目标感兴趣区(region of interest,ROI)的图像信息转化为可发掘的特征数据,具有数据维度高、可定量分析等优点,在肿瘤的术前分期、疗效评估及预后预测方面具有一定临床应用价值。其中图像采集与分割作为影像组学流程的第一步至关重要[3-5]。在肿瘤分割方法研究中,对直肠癌勾画方法的探讨较少。目前主流采用手动勾画ROI作为常规分割方法,但主观性强,稳定性及可重复性稍差[6-7]。尤其是直肠癌如果突破固有肌层侵及周围脂肪后病灶边界模糊欠清,常对ROI的准确勾画产生影响。本研究通过对2种手动勾画方式进行比较,探讨不同勾画方法对直肠癌影像组学分析结果稳定性的影响,以及对于评估直肠癌术前T分期的应用价值。
方 法
1.临床资料
回顾性分析2017年1月至2018年12月在海军军医大学第一附属医院行术前直肠高分辨率T2加权成像(WI)检查且经手术病理证实的直肠癌患者(共317例)的临床资料,其中2017年1月至2017年12月的152例纳入训练集,2018年1月至2018年12月的165例纳入测试集。获取原始DICOM数据并详细记录术后病理报告结果。排除标准:①图像质量差,如存在明显伪影导致病灶无法准确勾画ROI;②患者术前接受过任何化疗或盆腔放疗;③盆腔既往其他肿瘤或手术史。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版的分类标准进行病理诊断,记录患者术后病理T分期,将T1-2期归为未突破肌层组,T3-4期归为突破肌层组。
2.MRI扫描方法
扫描采用Siemens MAGNETOM Skyra 3.0 T磁共振仪。所有患者检查前4 h禁食,使用1支开塞露(20 ml甘油)清洁肠道。采用腹部相控阵线圈。常规直肠MRI扫描序列,包括矢状面T2WI脂肪抑制序列、横断面T1WI及增强扫描、弥散加权成像(DWI)。高分辨T2WI为斜横断面,扫描平面垂直于病灶所在肠管的长轴。扫描参数:重复时间(TR)4 000 ms,回波时间(TE)108 ms,视野(FOV)18 cm×18 cm,矩阵320×320,层厚3 mm,层间距0,层数28,反转角度150°,带宽108 Hz/像素。无脂肪抑制,GRAPPA并行采集模式,加速因子为3,平均累加次数为2,回波链长度为16,扫描时长为250 s。
3.影像组学分割方法及一致性分析
将获取的原始DICOM图像导入后处理平台(大数据智能分析云平台;慧影医疗科技有限公司,北京)。在高分辨T2WI图像上采用2种方法手动逐层勾画病灶ROI,计算机自动生成感兴趣容积(volume of interest,VOI)。方法1(Model 1):最小轮廓法,沿病灶边缘最明确的实性边界勾画,不含边缘的模糊区域;方法2(Model 2):最大轮廓法,沿病灶的最大范围勾画,包括肠壁外围的模糊软组织影,如图1所示。训练集及测试集各随机提取20例进行特征的一致性检验,由2名有5年以上工作经验的放射科医师分别采用2种方法勾画VOI后提取影像组学特征,计算全部特征的组内相关系数(intra-class correlation coefficient,ICC),比较2种勾画方法间的差异。其余病例均由一人勾画完成并提取影像组学特征。

图1 2种勾画方法示例
4.特征降维及模型构建
将获取到的全部特征去除ICC小于0.8的特征类别后,采用最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)算法进行降维,选择对直肠癌术后T分期诊断有价值的特征。将降维所获得的特征在训练集中与术后T分期构建多层感知机(multilayer perceptron,MLP)分类器模型,在测试集中进行模型验证。分别在训练集及测试集中绘制受试者操作特征(ROC)曲线,计算曲线下面积(AUC)、灵敏度、特异度、95%置信区间(CI)、准确度、阳性似然比、阴性似然比、阳性预测值、阴性预测值。采用DeLong检验比较组间差异。
5.统计学分析
采用SPSS 19.0及MedCalc 15.2.2软件进行数据处理。呈正态分布的定量资料以xˉ±s表示,2组间比较采用独立样本t检验;计数资料以例数和百分数表示,2组间比较采用χ2检验。服从偏态分布的定量资料以M(P25,P75)表示,Wilcoxon检验比较2组间差异。P<0.05为差异有统计学意义。
结 果
1.临床资料
最终共纳入317例患者,训练集152例,测试集165例。训练集及测试集一般资料比较结果(表1)显示,2组间各临床病理特征的差异均无统计学意义(P>0.05)。
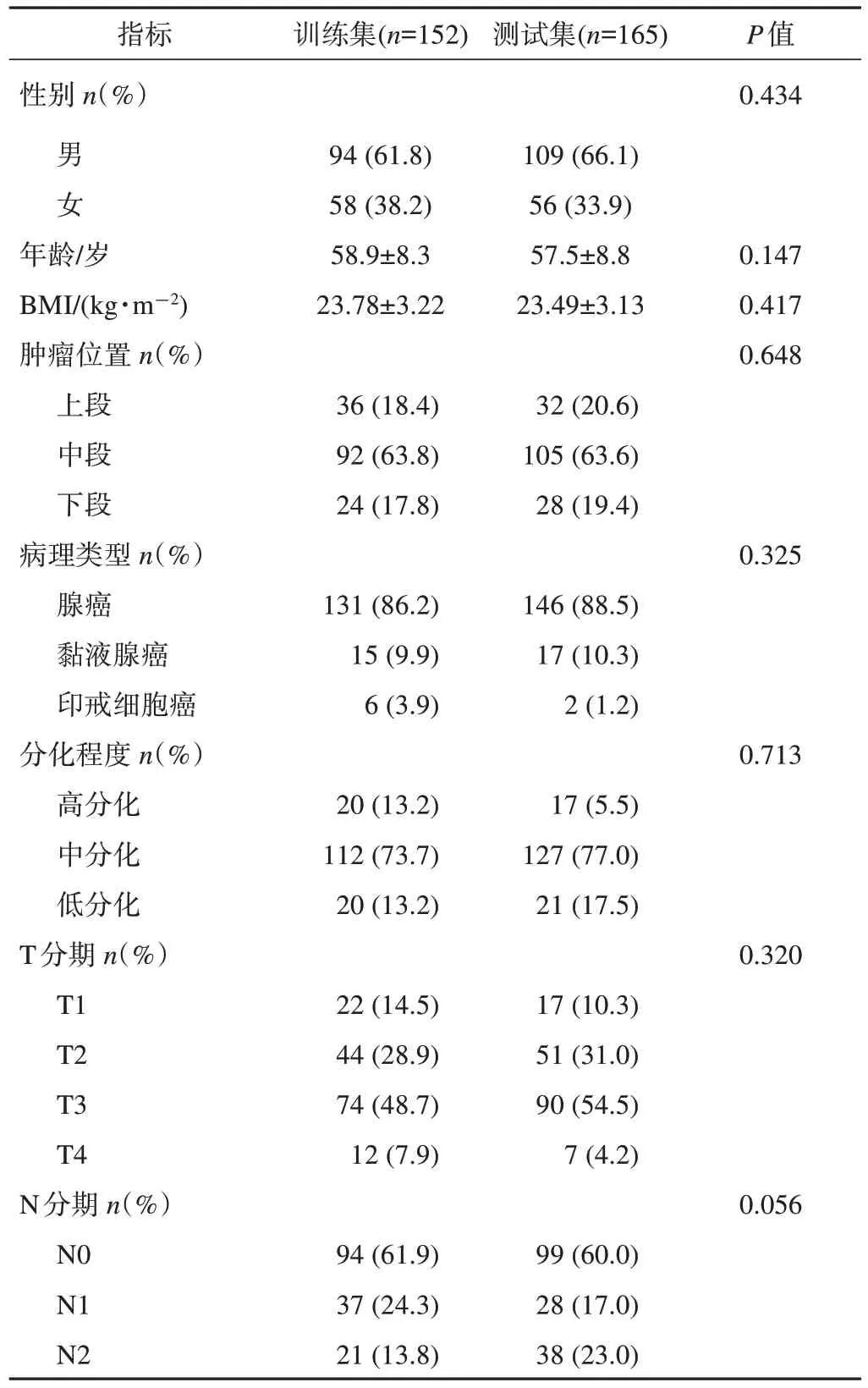
表1 训练集与测试集直肠癌患者一般资料比较
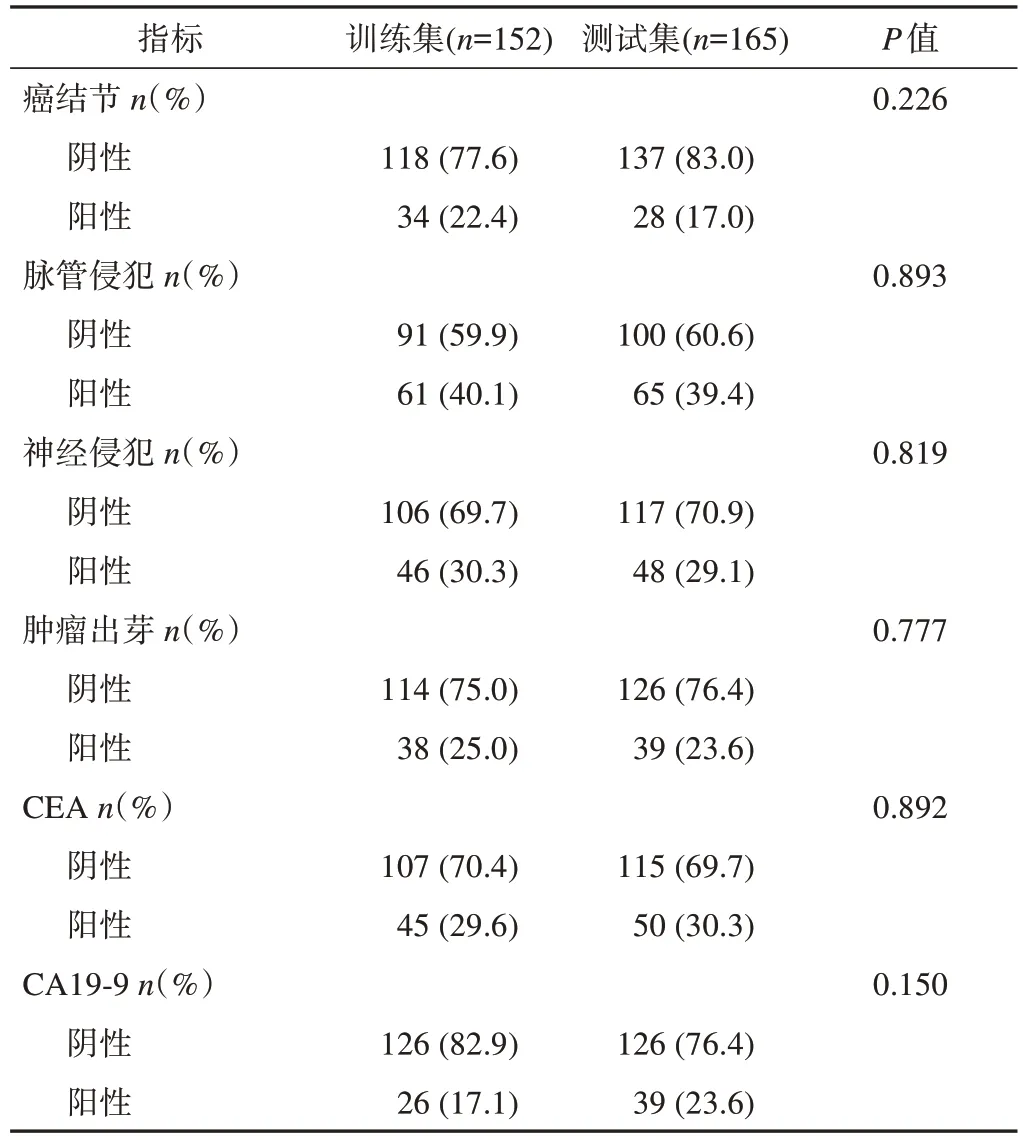
续表
2.影像组学特征
2种方法所勾画的VOI体积的M(P25,P75)分别为5.981(2.490,13.907)cm3和11.617(5.594,31.117)cm3,差异有统计学意义 (Z=3.29,P=0.001)。2种方法各提取到1 409组影像组学特征,包含以下两类。(1)基于特征类:①一阶统计量特征;②形状特征;③纹理特征,包括灰度级共生矩阵(GLCM)、灰度级长度矩阵(GLRLM)、灰度级形状矩阵(GLSZM)和邻域灰度差分矩阵(NGTDM)。(2)基于过滤器类:如小波变换、拉普拉斯转换、对数、指数等方式处理后的高阶特征。
2种方法的ICC分布见图2。Model 1和Model 2的ICC范围均为0.005~1.000,M(P25,P75)分别为0.994(0.972,0.998)和0.977(0.940,0.979),ICC<0.8的个数分别为121(8.59%)和136(9.65%),2种方法间差异有统计学意义(Wilcoxon检验,Z=18.574,P<0.001)。Model 1和Model 2经降维得到与T分期相关的特征分别为16个和14个(图3)。

图2 2种勾画方法的ICC分布
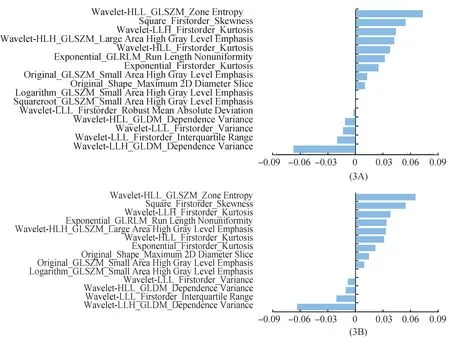
图3 筛选出的T分期相关特征
3.分类器模型
针对Model 1和Model 2经降维处理后的影像组学特征与病理T分期分别建立MLP分类器模型,训练集及测试集的ROC曲线分析均表现出较好的诊断效能,测试集中Model 1和Model 2的AUC分别为0.838(95%CI 0.764~0.912)及0.928(95%CI 0.864~0.992),DeLong检验P=0.036。详见表2、图4。
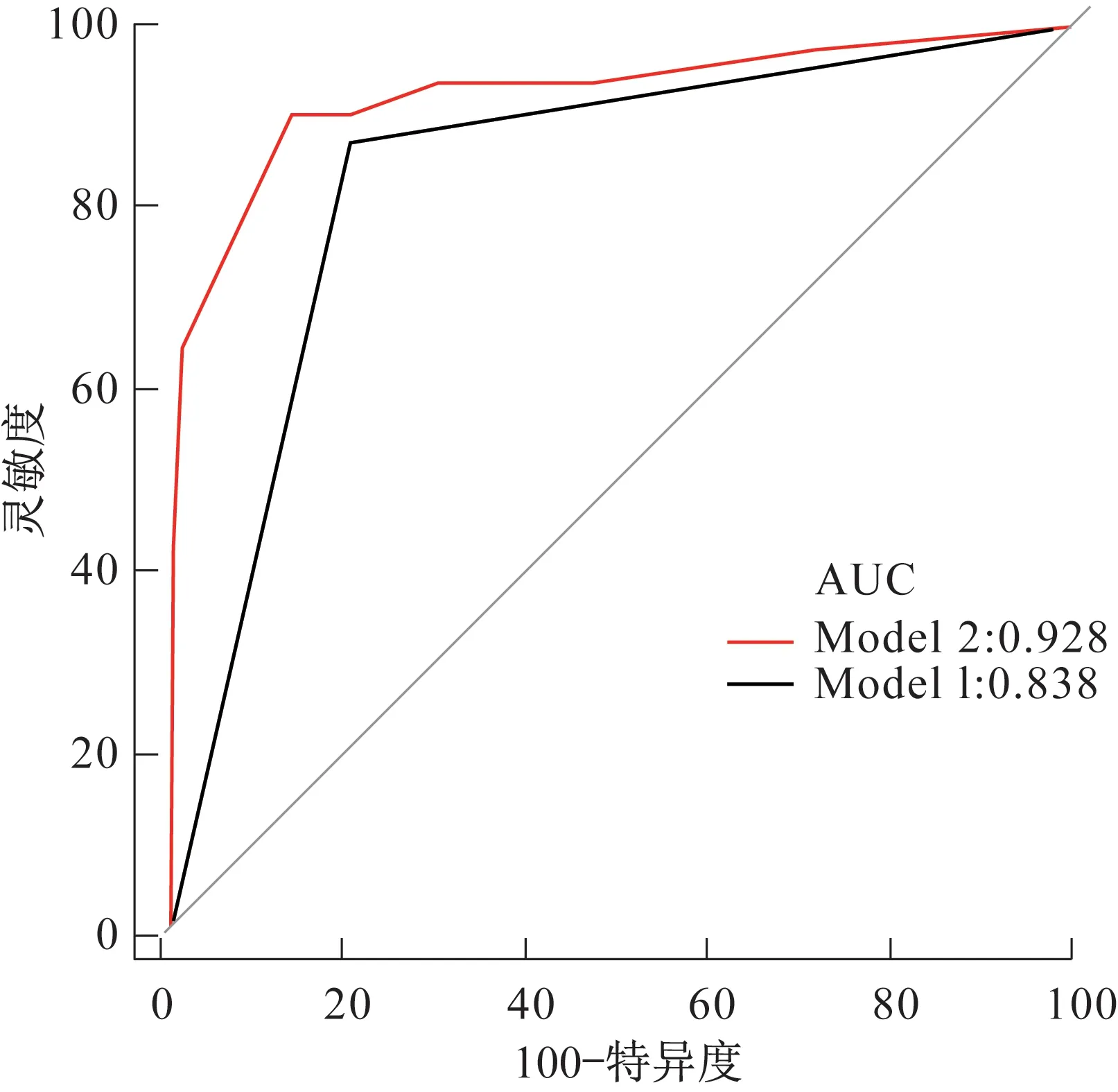
图4 2种勾画方法的测试集ROC曲线

表2 MLP模型的ROC曲线分析
讨 论
近年来我国直肠癌整体发病率趋于平稳,但死亡率仍在继续增长[8]。术前准确评估肿瘤的浸润深度,尤其是否突破直肠固有肌层,是影响治疗方案选择及预后评价的关键所在[1]。传统MRI检查仅在形态学上对肿瘤进行术前分期评估,有一定的主观性,缺乏定量评估,无法满足精准影像医学的要求,尤其当病灶周围存在纤维化及渗出改变,出现类似肠周线状/索条状信号表现时,往往难以与肿瘤肠壁外浸润相鉴别,导致T2期和早期T3的分期错误较为常见[2]。
影像组学(radiomics)作为新兴非侵入性方法对肿瘤的整体评估具有巨大潜能[3]。它通过高通量地抽取影像中的量化特征,将其转化为可挖掘的数据,最终将这些数据的分析结果用于临床诊断的决策支持,具有客观、可重复的特点,可实现对疾病的精准诊断及预后评估等[9]。其流程可简单归纳为图像采集与分割、特征提取并降维、建立模型等步骤,其中病灶的分割是流程第一步,是后续提取影像特征的前提[3-5]。
为了获得准确的影像学特征,稳定且精确的勾画非常重要,临床常采用手动勾画ROI作为常规分割方法,但其主观性强,稳定性及可重复性差[6-7]。很多研究强调T2期/T3期的鉴别诊断,两者在MRI上最重要的鉴别标准是病灶是否突破固有肌层,周围系膜脂肪是否受到侵犯,文献[1-2]认为有时很难区分真正的肿瘤浸润与结缔组织增生性反应,导致病灶边界的欠清晰对ROI的勾画产生影响。大多数研究关注了观察者间主观差异对ROI手动勾画差异的影响,但事实上病灶分割的方法性差异及量化评估在开展标准化研究中可能更为重要[6]。
Kocal等[10]确定了边缘收缩2 mm的分割方法对基于CT的放射组学分析肾透明细胞癌的影响。Zhang等[6]对鼻咽癌及乳腺癌开展影像组学研究,证实不同疾病对ROI勾画范围的不同具有不同的敏感性,同时也影响了影像组学模型的诊断效能。然而在肿瘤分割中对直肠癌勾画方法的探讨较少,本研究对最小轮廓法(Model 1)及最大轮廓法(Model 2)2种手动勾画方法进行比较,探讨不同的勾画方法对直肠癌影像组学分析结果的稳定性和诊断效能的影响。
本研究采用2种方法在同一组病例上勾画ROI,分别对提取的全部组学特征进行ICC分析,Model 1中ICC小于0.8的个数为121(8.59%),少于Model 2的个数为136(9.65%),Model 1的ICC中位数为0.994,大于Model 2的ICC中位数(0.977),差异有统计学意义(P<0.001),表明Model 1在提取影像组学特征时相对Model 2一致性更好。Model 1是沿病灶边缘最明确的实性部分边界勾画,不含边缘的模糊区域,具有较高的可重复性。该研究结果与目前大多数学者在影像组学研究所采用图像分割原则相一致,都是尽可能地勾画病灶最实性的部分,从而保证数据的稳定性及可重复性[11-13]。本研究中Model 1按病灶的锐利边界勾画肿瘤组织,从而尽可能使提取的特征完全来自肿瘤组织的影像学信号,排除了因肿瘤刺激造成周围炎性反应及纤维化造成的不确定性影响,因此在稳定性及可重复性的表现方面优于Model 2。
MLP的机器学习算法能够处理非线性可分离问题,应用范围广,扩展性强,可用于图像识别、机器翻译等多个领域[14]。我们前期研究[15]表明基于MRI的MLP模型在直肠癌T分期的判断中具有良好的诊断效能,故本次研究直接采用MLP模型,分别绘制ROC曲线。结果显示测试集Model 2机器学习模型的AUC为0.928,高于Model 1的0.838,体现了Model 2的良好诊断效能,表明在判断直肠癌浸润是否突破肌层方面最大轮廓法建立的机器学习模型较最小轮廓画法更具优势。有学者[6]在原始分割区域的基础上,对VOI进行缩小、扩大和平滑,从而研究新产生的不同VOI对组学模型预测性能的影响。与该研究勾画范围扩大方式不同,我们的最大轮廓法是沿病变存在的最大范围勾画,而不是简单按比例扩大,虽然也可能包含一些病灶周围的非肿瘤区域,但更多的是按病灶周围实际存在的组织信号来勾画。同时与最小轮廓法不同,最大轮廓法尽可能多地包含病灶周围可能存在的肠壁外肿瘤浸润、神经及脉管侵犯,最大程度体现了肿瘤组织的异质性,因此可发挥良好的诊断效能。
本研究还存在以下局限性:①属于单中心回顾性研究,可能存在选择偏倚,未来有必要进行外部验证以提高模型泛化性;②采用手动勾画ROI,耗时久且工作量大,易受病灶形态影响,这可能导致提取影像组学特征的稳定性欠佳,不适用于大规模的数据处理[16],所以基于深度学习的ROI半自动/自动分割方法将是我们未来进一步研究的主要方向;③仅基于磁共振T2WI高分辨率图像,未加入弥散加权、动态增强等其他序列构建多模态影像组学模型。
综上,在基于高分辨T2WI的影像组学模型中,直肠癌病灶的2种不同勾画方法对直肠癌术前T分期均具有良好诊断价值,其中最小轮廓法提取影像组学特征的稳定性较好,而最大轮廓法的诊断效能更佳。

