参芪扶正注射液辅助GP方案对晚期非小细胞肺癌的影响
贺卫星
(河南省驻马店市正阳县人民医院肿瘤科 正阳463600)
晚期非小细胞肺癌(Non-Small Cell Lung Carcinoma,NSCLC)为常见呼吸系统恶性肿瘤,早期临床症状不明显,有30%~40%患者因确诊于晚期而错失手术机会[1]。近年来肺癌的发病率、病死率不断上升,数据显示,全世界每年新增肺癌约130万,新增死亡高达100万,其中NSCLC占比80%~90%,严重威胁患者生命健康[2]。晚期NSCLC通常给予综合治疗,以化疗为主,但化疗导致的耐受情况及并发症易影响治疗效果,故降低化疗毒副反应的同时保障疗效对晚期NSCLC治疗具有重要意义。近年来在临床治疗晚期NSCLC过程中,中医药的地位越来越重要。本研究旨在研究参芪扶正注射液辅助GP方案对晚期NSCLC患者免疫功能及生活质量评分的影响。现报道如下:
1 资料与方法
1.1 一般资料 选取2018年6月~2020年4月我院收治的96例晚期NSCLC患者,按照随机数字表法分为观察组和对照组各48例。对照组男28例,女20例;年龄56~76岁,平均年龄(65.94±4.85)岁;临床分期:Ⅲ期29例,Ⅳ期19例;病理类型:腺癌21例,鳞癌27例。观察组男30例,女18例;年龄57~78岁,平均年龄(67.03±4.64)岁;临床分期:Ⅲ期30例,Ⅳ期18例;病理类型:腺癌23例,鳞癌25例。两组基线资料对比无显著差异(P>0.05)。本研究经医院医学伦理委员会审批通过。
1.2 纳入及排除标准(1)纳入标准:经病理学及影像学检查确诊为晚期NSCLC;未接受抗肿瘤相关治疗;预期生存时间>3个月;首次化疗且存在可测量病灶;患者及家属均知情了解本研究并当面签署知情同意书。(2)排除标准:存在除NSCLC外其他恶性肿瘤;伴随肾、肝等严重器质性病变;对本研究药物过敏。
1.3 治疗方法
1.3.1 对照组 给予GP方案化疗,第1、8天注射用盐酸吉西他滨(注册证号H20160225)静脉滴注,1500 mg/m2;第1~5天顺铂注射液(注册证号H20140372)静脉滴注,70 mg/m2。21 d为一个疗程,持续用药4个疗程。
1.3.2 观察组 在对照组基础上给予参芪扶正注射液治疗。参芪扶正注射液(国药准字Z19990065)静脉滴注,250 ml/次,1次/d,化疗前1 d开始,与化疗治疗周期同步。
1.4 观察指标(1)两组疗效对比。(2)对比两组治疗前后免疫功能。分别收集两组3 ml晨起空腹静脉血,通过流式细胞仪检测CD4+/CD8+、CD4+、CD3+。(3)对比两组治疗前后血清肿瘤标志物水平。分别收集两组3 ml晨起空腹静脉血,通过化学发光分析仪(美国雅培I2000)检测糖类抗原199(CA199)、神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)。(4)对比两组治疗前后中国癌症患者化学生物治疗生活质量量表(QLQ-CCC)评分,分值越高说明生活质量越高。(5)对比两组并发症(胃肠道反应、血小板计数降低、白细胞计数降低)发生情况。
1.5 疗效判定标准 按照WHO制定的肿瘤化疗疗效标准对疗效进行分级:影像学结果表明病灶完全消除,至少保持4周为完全缓解(CR);影像学结果表明病灶减小≥25%,无新病灶发现,至少保持4周为部分缓解(PR);影像学结果表明病灶减小<25%,或扩大<25%,无新病灶发现,至少保持4周为稳定(SD);影像学结果表明病灶扩大≥25%,有新病灶发现为进展(PD)。将CR、PR计入总有效。
1.6 统计学分析 采用SPSS22.0统计学软件对数据进行分析,计量资料以(±s)表示,采用t检验,计数资料以%表示,采用χ2检验,等级资料采用秩和检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组疗效对比 与对照组总有效率43.75%相比,观察组总有效率66.67%更高(P<0.05)。见表1。
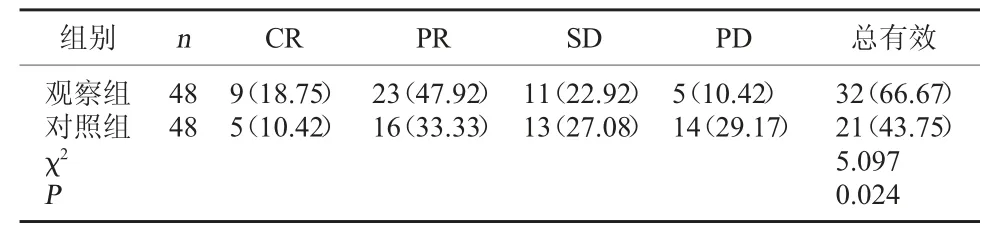
表1 两组疗效对比[例(%)]
2.2 两组免疫功能对比 治疗前,两组CD4+/CD8+、CD4+、CD3+水平比较无明显差异(P>0.05);治疗后,两组CD4+/CD8+、CD4+、CD3+水平均较治疗前降低,但观察组CD4+/CD8+、CD4+、CD3+水平均高于对照组(P<0.05)。见表2。
表2 两组免疫功能对比(±s)
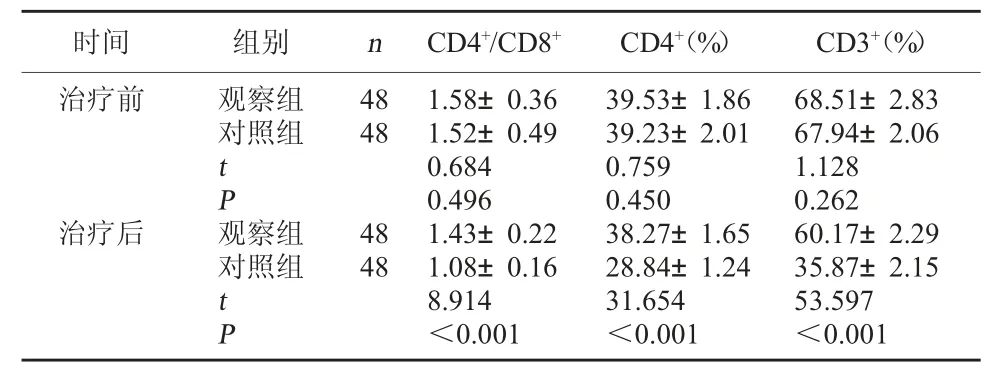
表2 两组免疫功能对比(±s)
时间 组别 n CD4+/CD8+ CD4+(%) CD3+(%)治疗前观察组对照组4848 t P治疗后观察组对照组4848 t P 1.58±0.361.52±0.490.6840.4961.43±0.221.08±0.168.914<0.00139.53±1.8639.23±2.010.7590.45038.27±1.6528.84±1.2431.654<0.00168.51±2.8367.94±2.061.1280.26260.17±2.2935.87±2.1553.597<0.001
2.3 两组血清肿瘤标志物水平对比 治疗前,两组CA199、NSE、CEA、CYFRA21-1水平比较无明显差异(P>0.05);治疗后,两组CA199、NSE、CEA、CYFRA21-1水平均较治疗前降低,且观察组低于对照组(P<0.05)。见表3。
表3 两组血清肿瘤标志物水平对比(±s)
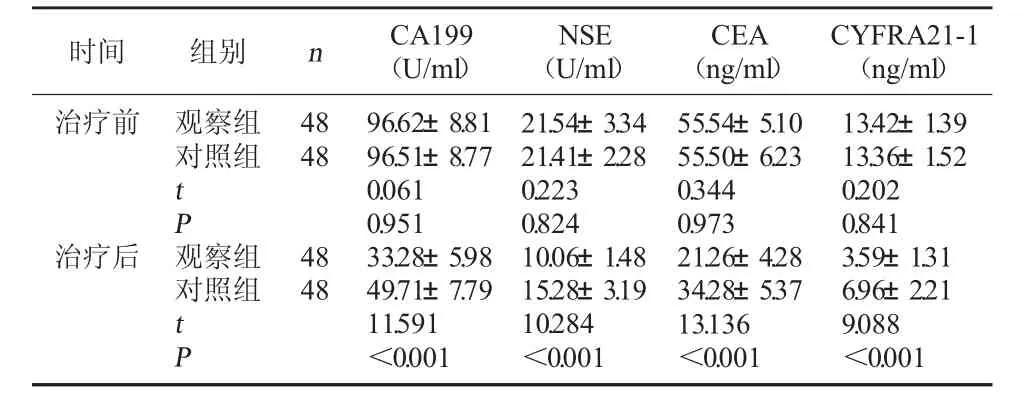
表3 两组血清肿瘤标志物水平对比(±s)
CYFRA21-1(ng/ml)治疗前时间 组别 n CA199(U/ml)NSE(U/ml)CEA(ng/ml)观察组对照组4848 t P治疗后观察组对照组4848 t P 96.62±8.8196.51±8.770.0610.95133.28±5.9849.71±7.7911.591<0.00121.54±3.3421.41±2.280.2230.82410.06±1.4815.28±3.1910.284<0.00155.54±5.1055.50±6.230.3440.97321.26±4.2834.28±5.3713.136<0.00113.42±1.3913.36±1.520.2020.8413.59±1.316.96±2.219.088<0.001
2.4 两组QLQ-CCC评分对比 治疗前,两组QLQ-CCC评分比较无明显差异(P>0.05);治疗后,两组QLQ-CCC评分较治疗前升高,且观察组高于对照组(P<0.05)。见表4。
表4 两组QLQ-CCC评分对比(分,±s)
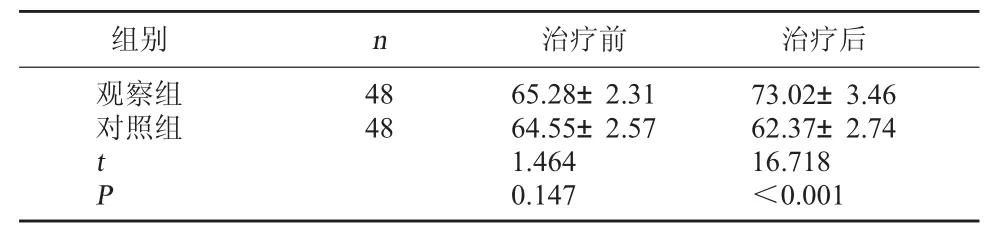
表4 两组QLQ-CCC评分对比(分,±s)
组别 n 治疗前 治疗后观察组对照组4848 t P 65.28±2.3164.55±2.571.4640.14773.02±3.4662.37±2.7416.718<0.001
2.5 两组并发症发生情况对比 治疗后,观察组胃肠道反应、血小板计数降低及白细胞计数降低发生率均明显低于对照组,差异有统计学意义(P<0.05)。见表5。

表5 两组并发症发生情况对比[例(%)]
3 讨论
GP方案为临床常用化疗方案,顺铂的广谱抗肿瘤活性可激发DNA链内及链间的联系,促进修复细胞及触发细胞凋亡;吉西他滨不仅可有效抑制机体脱氧核苷酸产生及核苷酸酶还原,预防干扰细胞DNA合成,还能促使DNA链合成障碍,起到抗癌效果[3]。但化疗药物易造成消化道、血液系统等毒副反应,可能导致机体不耐受情况发生,严重者需终止化疗[4]。参芪扶正注射液由党参、黄芪组成,党参中的糖类、酚类等成分,有助于提高机体免疫力,缓解化疗造成的白细胞降低,改善机体微循环;黄芪中的皂苷、多糖等成分,有利于补气固表,提高机体免疫力[5]。相关研究表明,参芪扶正注射液辅助化疗有利于改善机体造血功能、保护机体骨髓功能、增强机体免疫力及抗肿瘤能力[6]。本研究结果显示,观察组总有效率66.67%显著高于对照组43.75%,治疗后观察组QLQ-CCC评分高于对照组,且并发症发生率明显低于对照组(P<0.05)。可见,参芪扶正注射液辅助GP方案治疗晚期NSCLC患者可有效提高抗肿瘤能力,增强疗效,改善生活质量,减少并发症发生。
机体免疫功能的重要指标为T细胞亚群,肿瘤细胞通过抑制细胞免疫反应,降低CD4+/CD8+、CD4+、CD3+,导致机体免疫功能下降,造成NSCLC肿瘤细胞进一步发展[7]。本研究结果显示,治疗后观察组免疫功能CD4+/CD8+、CD4+、CD3+指标水平均高于对照组,提示参芪扶正注射液辅助GP方案可有效改善机体免疫功能。综上所述,参芪扶正注射液辅助GP方案治疗晚期NSCLC患者可有效提高疗效,改善免疫功能及生活质量,减少并发症发生。

