二乙酰胺三氮脒对大鼠非酒精性脂肪肝病的作用初步分析
朱 斌 何 晟 付亚丽 谢娜娜 张源淑
(南京农业大学 农业农村部动物生理生化重点实验室, 南京 210095)
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是一种包含广泛肝功能障碍的临床病理综合征,也是引起慢性肝病的主要原因。肝脏脂肪变性是其最初的病理变化,随着病程发展,进一步引起肝脏纤维化,肝炎,甚至肝癌[1-2]。据统计,目前全球NAFLD的患病率已高达到25.24%,并且在肥胖和Ⅱ型糖尿病等人群中的发病率更高[3]。NAFLD对人们的生活产生了严重影响,其防治是急需解决的问题。经过多年的研究,对NAFLD的防治可以使用抗氧化剂或胰岛素增敏剂、服用降血脂药或肝移植等方法进行治疗,尽管有较好的效果,但临床上接受度不高。例如噻唑烷二酮类药物(胰岛素增敏剂)等研究中显示,尽管效果明显,却引起了体重增加等副作用[4]。目前通过改善饮食习惯,运动减肥等方式预防NAFLD人们唯一认可的。随着人们对NAFLD发病机制的深入认识,涌现出越来越多的药物研究,但仍然没有公认的特效药物[5-6]。因此寻找新的思路,开发出针对性强、副作用小并且疗效明显的抗NAFLD特效药物意义重大。
肾素-血管紧张素系统(RAS)是由一系列肽类激素及相应酶和受体组成的参与机体代谢过程的重要调节系统,包括经典通路-血管紧张素转化酶(ACE)/血管紧张素Ⅱ(AngⅡ)/1型血管紧张素受体(AT1R)和代偿通路-血管紧张素转化酶2(ACE2)/血管紧张素Ang1-7(Ang1-7)/Mas受体(MasR)。该系统主要参与维持机体血压和电解质等的平衡,保持机体内环境稳定,同时其作为一种重要的糖脂代谢调节系统,在维持机体糖类和脂质的稳态中发挥重要作用[7-8]。其中ACE2是RAS系统代偿通路的关键酶,可降解AngII可以产生Ang1-7,调节AngII和Ang1-7的水平。AngII通过激活AT1R发挥促炎、促氧化和促纤维化等作用,而Ang1-7主要通过其Mas受体拮抗AngII引起的大部分有害作用。最近的研究表明,RAS的经典通路和代偿通路的局部平衡在抑制肝脏代谢性疾病中具有重要意义,通过抑制经典通路可减轻肝脏炎症和改善肝纤维化,而激活代偿通路对肝脏产生保护作用[8]。经典通路抑制剂联合代偿通路激活剂用以防治NAFLD具有十分广阔的前景。目前,ACE/AngⅡ/AT1R经典通路抑制剂的研究也有相关报道[9],而ACE2/Ang1-7/MasR代偿通路激活剂的研究报道尚不充分,是否可以通过激活代偿通路关键酶ACE2调节肝脏RAS系统的平衡是研究NAFLD的新思路。
二乙酰胺三氮脒(DIZE)开发至今已有60多年,是一种古老的抗寄生虫药,主要发挥抗锥虫和巴贝斯虫等作用[10]。2011年Kulemina等[11]通过软件预测筛选,并鉴定其为血管紧张素转化酶2(ACE2)的激活剂。DIZE作为ACE2的激活剂,可以激活RAS代偿通路,从而发挥舒张血管、抗炎、抗氧化应激等作用,对于DIZE的研究目前集中于肺动脉高压和心血管疾病等疾病[12-13],而在NAFLD等肝脏疾病中相关的研究报道较少。此外,Joviano-Santos等[14]通过体内和体外试验证明了DIZE激活ACE2可以调节心肌细胞收缩和兴奋性减少心律失常;Goru等[15]研究显示DIZE治疗缓解了大鼠糖尿病引起的肾纤维化和细胞凋亡;Ge等[16]研究发现DIZE治疗可能通过抑制炎症和凋亡,减轻LPS/D-Gal引起的肝损伤。这些研究表明DIZE可以在大鼠或小鼠疾病模型中发挥积极的作用,而DIZE对大鼠NAFLD模型的研究尚未见报道。因此,本研究拟以高脂饲料饲喂SD大鼠建立NAFLD模型,灌胃DIZE和阳性药物(洛伐他汀,一种抗脂肪肝药物)后,记录试验期间各组大鼠体重等生长变化,并测定血液生化指标以及观察肝脏病理组织学变化,初步探讨DIZE对大鼠NAFLD的治疗作用,为DIZE在NAFLD疾病模型中的研究奠定基础。
1 材料与方法
1.1 主要试剂及仪器
二乙酰胺三氮脒(Diminazene aceturate,DIZE)(美国,SIGMA),购自南京良纬生物科技有限公司;洛伐他汀(Lovastatin,LOV),购自北京索莱宝科技有限公司;羧甲基纤维素钠(Sodium carboxymethyl cellulose,CMC-Na),购自南京寿德生物科技有限公司;甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、游离脂肪酸(NEFA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)和总胆汁酸(TBA)试剂盒,均购自南京建成生物工程研究所。
Tecan Spark多功能酶标仪(瑞士,Tecan);ISO9001电子天平(北京赛多利斯仪器系统有限公司);DY04-13-42-00(BL-50A)立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司);Servicebio高速组织研磨仪(武汉赛维尔生物科技有限公司);Centrifuge 5804R离心机(德国,Eppendorf)等。
1.2 试验动物
6周龄SPF级雄性SD大鼠34只,体重190~210 g,购自斯贝福(北京)生物技术有限公司,动物许可证号:SCXK(京)2019-0010。饲养于南京农业大学实验动物中心,饲养环境为温度(22±2)℃,相对湿度50%~60%,12 h光/暗周期性光照,自由饮水和采食,所用饲料分为高脂饲料(45%的卡路里为脂肪)和普通饲料(12%的卡路里为脂肪)由南京市江宁区龙泉饲料经营部加工。动物饲养和处理均符合医学伦理标准。
1.3 方法
1.3.1动物分组与处理
造模方法和所用饲料参照Wu等[17]。34只大鼠适应性饲喂1周,称重后随机分笼,空白组(n=8)饲喂基础饲料,其余(n=26)为高脂组饲喂高脂饲料。4周后,各组大鼠中随机挑选1只,迅速处死后取肝脏观察肝脏形态并做病理切片,发现明显的脂肪沉积和脂肪变性,证实造模成功。将高脂饮食的24只大鼠重新分组,具体分组如表1。试验期间每天观察大鼠的精神状态、毛发光泽和排便情况。每天下午2:00定时给各组大鼠按顺序灌胃。每周称重1次,统计采食量3次。每两周1次眼眶采血,测定大鼠血浆的甘油三酯(TG)和总胆固醇(TC)的含量。
表1 大鼠分组表Table 1 Different groups of rats
1.3.2葡萄糖耐量试验
葡萄糖耐量试验评估大鼠血糖调节能力,参考魏康等[18]的方法,具体如下:大鼠禁食12 h并过夜后,每只大鼠灌胃2 g/kg的葡萄糖溶液,分别在灌胃后0、30、60 和 120 min后,尾静脉取血,用血糖仪按顺序测量每只大鼠的血糖浓度,并绘制血糖浓度与时间的变化曲线,并统计曲线下面积。
1.3.3样品采集
血液样品采集:饲养第10周,所有大鼠禁食12 h 后称重,无水乙醚麻醉,腹主动脉采集抗凝血液,3 000 r/min 离心10 min, 收集血浆,-20 ℃保存用于后续测定。
肝脏样品采集:剖检大鼠,取肝脏称重、拍照并记录。取相同部位肝脏于组织细胞固定液中固定,剩余肝脏迅速装管投入液氮中,后转移到-80 ℃冰箱保存备用。
1.3.4血液生化指标的测定
测定血浆中甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、游离脂肪酸(NEFA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)和总胆汁酸(TBA)的含量或酶活性,具体按试剂盒说明书进行操作。
1.3.5肝脏指数的测定
取出肝脏称量并记录大鼠肝脏湿重,按以下公式计算大鼠肝指数:
Y=m/M×100
式中:Y为肝脏指数,%;m为肝脏湿重,g;M为大鼠体重,g。
1.3.6大鼠肝脏病理组织学观察
苏木精-伊红(HE)染色:将固定好的肝脏组织进行脱水、透明后石蜡包埋,常规法制作组织切片。光学显微镜下观察肝脏组织的病理变化(病理组织切片由武汉塞维尔生物科技有限公司制作)。
1.3.7数据处理
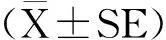
2 结 果
2.1 大鼠生长性能
2.1.1大鼠非酒精性脂肪性肝病模型建立
试验期间,空白组大鼠饮食正常,被毛乳白色有光泽,体态匀称,精神状态良好,对外界刺激反应迅速。粪便呈浅褐色,表面干燥,质地硬。高脂饮食大鼠在试验前期采食和饮水量均较空白组稍多,被毛黄白色无光泽,体脂增加明显,体重特大的大鼠表现出反应明显迟钝。粪便呈黑色或黑褐色,长条或成串状,表面有油性光泽,质地软(图1)。DIZE组和LOV组大鼠在饮食、被毛、精神状态和排泄物等方面接近于空白组大鼠,相较于模型组有所改善。

图1 空白组和模型组大鼠饲养情况Fig.1 Feeding of rats in control and model groups
4周后,各组大鼠中随机挑选1只,迅速处死后取肝脏做病理切片如图2,与空白组相比模型组肝脏出现明显的脂肪沉积和脂肪变性,证实造模成功。

图2 饲喂4周后大鼠肝脏病理变化(HE,100×)Fig.2 Pathological changes of rat liver after 4 weeks of feeding
2.1.2DIZE对NAFLD大鼠体重的影响
试验起始阶段各组大鼠体重相近,饲喂高脂饲料第4周开始,模型组大鼠体重均显著高于空白组(433.67±6.35 vs 406.67±6.62,P<0.05)。从第5周开始灌胃给药后,各组大鼠体重增加速率为:模型组>DIZE组>LOV组>空白组。灌胃DIZE和LOV均能减缓饲喂高脂饲料大鼠的增重趋势(图3)。

* P<0.05表示与空白组相比有显著性差异。* P<0.05 indicates significant difference compared with the control group.图3 DIZE对NAFLD大鼠体重的影响(n=8)Fig.3 Effect of DIZE on weight of NAFLD rats (n=8)
2.1.3DIZE对NAFLD大鼠葡萄糖耐量的影响
灌胃葡萄糖溶液30 min后,各组血糖浓度均迅速上升,模型组升高幅度明显大于其他组。60 min后,模型组血糖浓度维持较高水平,空白组血糖水平显著下降,DIZE组和LOV组也出现较大幅度下降,但仍高于空白组。120 min后,各组血糖水平均出现大幅下降(图4(a))。统计曲线下面积,与空白组相比,模型组曲线下面积极显著增加(2 321±48.85 vs 1 464±41.08,P<0.01);与模型组相比,DIZE组(1 703±65.59 vs 2 321±48.85,P<0.01)和LOV组(1 681±50.79 vs 2 321±48.85,P<0.01)的曲线下面积均极显著减少(图4(b))。
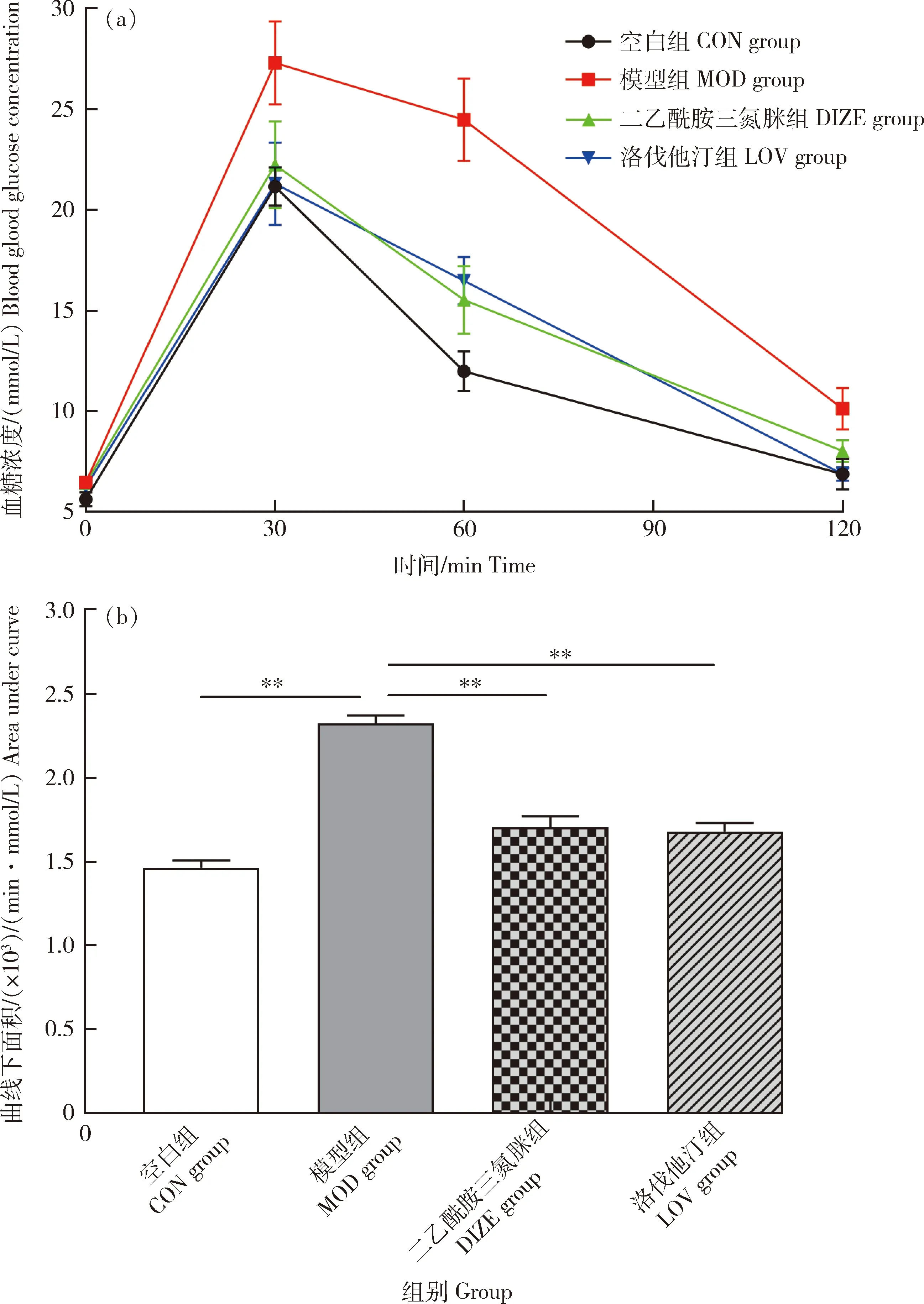
(a)血糖-时间变化曲线 Blood glucose-time curve;(b)血糖-时间变化曲线下面积 Area under curve of blood glucose-time* P<0.05表示差异显著,** P<0.01表示差异极显著。下同。* P<0.05 indicates significant difference; ** P<0.01 indicates extremely significant difference. The same below.图4 DIZE对NAFLD大鼠葡萄糖耐量的影响Fig.4 Effect of DIZE on glucose tolerance in NAFLD rats
2.2 DIZE对NAFLD大鼠血液生化指标的影响
2.2.1TG和TC含量变化
与空白组相比,模型组大鼠血浆中TG含量在第2周即显著升高(0.678±0.112 vs 1.069±0.114,P<0.05),第4周极显著升高(0.662±0.209 vs 1.275±0.091,P<0.01),并一直保持在较高水平。药物处理后,DIZE组大鼠血浆中TG含量在第6周显著下降(1.395±0.149 vs 0.966±0.076,P<0.05),LOV组极显著下降(1.395±0.149 vs 0.820±0.054,P<0.01),在第10周时两组与空白组无显著性差异(图5(a))。
模型组大鼠血浆中TC含量在第2周即表现出极显著高于空白组(1.640±0.256 vs 2.839±0.377,P<0.01)。药物处理后相比于模型组,DIZE组大鼠血浆中TC含量在第6周显著下降(2.942±0.098 vs 2.366±0.269,P<0.05),LOV组极显著下降(2.942±0.098 vs 1.946±0.436,P<0.01),在第10周与空白组无显著性差异(图5(b))。
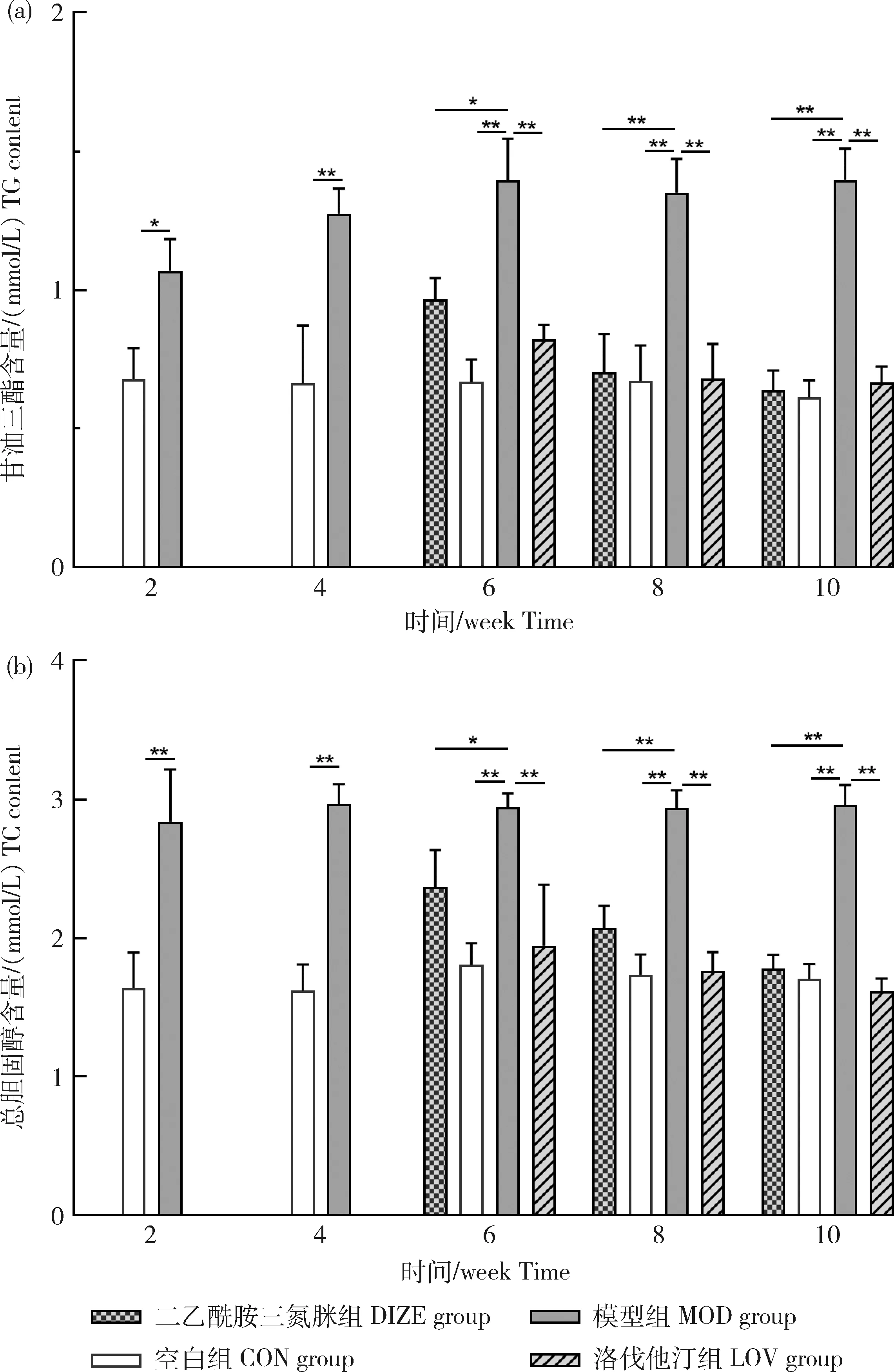
图5 DIZE对NAFLD大鼠血浆TG和TC的影响Fig.5 Effect of DIZE on TG and TC of plasma in NAFLD rats
综上,模型组TC、TG随时间变化持续保持较高水平,而DIZE组和LOV组用药后均出现了明显的下降趋势,作用效果显著,其中阳性药物的作用下降趋势更为剧烈,但随着时间推移DIZE也能达到几乎相同程度的作用。
2.2.2LDL-C、HDL-C和NEFA含量变化
由表2可知,相比于空白组,模型组大鼠血浆中HDL-C含量极显著降低(P<0.01),LDL-C含量升高,但差异不显著。NEFA含量显著升高(P<0.05)。在灌胃后,相比于模型组,DIZE组HDL-C含量显著升高(P<0.05),LDL-C和NEFA含量降低,但均无显著性差异。LOV组HDL-C含量升高但无显著性差异,LDL-C含量显著降低(P<0.05),NEFA含量降低但无显著性差异。灌胃药物后使得血液中检测到HDL-C含量增加而LDL-C含量减少,表明药物缓解了胆固醇在肝脏的堆积。NEFA含量的降低也表明药物一定程度上缓解了机体内脂质代谢紊乱。

表2 DIZE对NAFLD大鼠血浆HDL-C,LDL-C和NEFA的影响Table 2 Effect of DIZE on HDL-C, LDL-C and NEFA of plasma in NAFLD rats
2.2.3ALT、AST、TBA、AKP和LDH的变化
由表3可知,相比于空白组,模型组大鼠血浆中ALT和AST活性均极显著升高(P<0.01)。相比于模型组,DIZE组和LOV组的ALT和AST活性均显著降低(P<0.05),且两种药物的作用效果相近。相比于空白组,模型组大鼠血浆中AKP、LDH和TBA的活性和含量均极显著升高(P<0.01)。相比于模型组,DIZE组和LOV组的AKP、LDH和TBA的活性和含量均极显著降低(P<0.01)。用药后肝脏损伤的重要指标均有不同程度的下降,表明肝脏损伤得到了一定的修复。

表3 DIZE对NAFLD大鼠血浆ALT、AST、AKP、LDH和TBA的影响Table 3 Effect of DIZE on ALT, AST, AKP, LDH and TBA of plasma in NAFLD rats
2.3 DIZE对NAFLD大鼠肝脏及肝指数的影响
2.3.1肝指数
肝指数能够反映肝脏受损与脂质积累的情况,当肝脏内脂肪累积过多,肝脏变得肿大,肝指数上升。相比于空白组,模型组大鼠肝指数极显著上升(3.716±0.303 vs 2.544±0.100,P<0.01),提示肝脏有肿大。与模型组相比,DIZE组和LOV组大鼠肝指数下降但无显著性差异,结果与体重变化趋势一致(图6)。结果表明用药后阻断了肝脏受损肿大的趋势,缓解肝脏损伤。
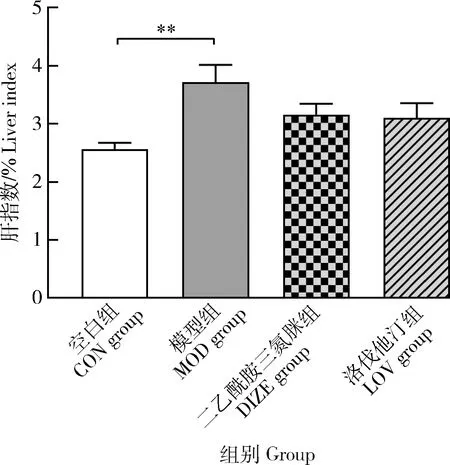
图6 DIZE对NAFLD大鼠肝指数的影响Fig.6 Effect of DIZE on liver index of NAFLD rats
2.3.2肝脏组织HE染色结果观察
空白组大鼠肝组织结构正常,肝索排列规则,肝细胞结构完整,形态匀称,胞内无脂滴,细胞核较大且呈圆形,居于细胞中央(图7(a))。模型组大鼠肝细胞体积明显增大,胞浆内出现大量边界清晰且质地饱满的空泡,细胞核缩小被挤向一边(图7(b))。相比于模型组,DIZE组和LOV组肝脏脂滴量大幅减少,细胞形态有恢复,灌胃DIZE和LOV均能显著减轻NAFLD大鼠肝脏组织中的脂肪沉积(图7(c)和(d))。染色结果直观的展示了肝脏损伤程度,DIZE用药后明显缓解了肝脏脂质沉积与阳性药物效果相当。

(a)空白组 CON group; (b)模型组 MOD group; (c)二乙酰胺三氮脒组 DIZE group; (d)洛伐他汀组 LOV group图7 DIZE对NAFLD大鼠肝脏组织病理变化的影响(HE,×400)Fig.7 Effect of DIZE on pathological changes of liver tissue in NAFLD rats (HE,×400)
3 讨 论
3.1 大鼠NAFLD的模型建立
NAFLD大鼠造模方法很多,其中通过高脂饮食诱导大鼠建立NAFLD模型最稳定可靠且重复性较好[19]。临床检测的各种生化指标中,AST和ALT是机体内反映肝脏功能的2种酶,是诊断肝脏疾病的重要指标。当肝细胞发生炎症等情况时,肝细胞受损,转氨酶便会释放到血液里,使血液中的转氨酶浓度升高。AKP主要来自于骨骼,由成骨细胞产生,经血液到肝脏,从胆道系统排出[20]。出现肝脏疾病时,AKP无法及时排出,因此血液中的AKP活力增加。LDH是糖无氧酵解及糖异生的重要酶系之一,任何原因引起的肝细胞损伤均可因LDH释放,引起血清LDH活力增加。HDL-C主要合成部位在肝脏,可将胆固醇从肝外组织转运到肝脏进行代谢,扮演“入肝”作用。LDL-C是主要合成部位在血管内由极低密度脂蛋白胆固醇(VLDL-C)转变而来,是运输胆固醇到肝外组织的主要运载工具,扮演“出肝”的作用。因此当肝脏受到损伤时,HDL-C合成减少,导致胆固醇堆积,需要合成更多的LDL-C,使得血液中检测到HDL-C含量减少而LDL-C含量增加。TBA作为胆固醇在肝脏分解代谢中的终产物,与胆固醇的代谢和吸收密切相关。当肝细胞发生病变时,胆汁酸反流释放到血液中,导致血液总胆汁酸浓度升高。NEFA作为中性脂肪分解后的产物,作为能源物质为机体供能,而游离脂肪酸的水平可以反应机体脂类代谢的功能状况,高脂饮食或糖尿病等因素会导致游离脂肪酸水平上升。肝指数是肝湿重与大鼠体重的比值,能够反映大鼠肝脏受损与脂质积累的情况,当肝脏内脂肪累积过多时,肝脏肿大[21-22]。本研究高脂饮食饲喂大鼠,通过检测以上指标表明造模效果显著,成功构建大鼠NAFLD动物模型。
3.2 DIZE对大鼠NAFLD肝脏损伤的保护作用机制
Wu等[17]在研究菊苣多糖对NAFLD大鼠的缓减作用时,通过饲喂高脂饲料获得了NAFLD大鼠模型,并通过血液生化指标和肝脏病理变化评估建模的病程。本研究发现大鼠饲喂4周的高脂饲料后,模型组大鼠相比空白组体重显著增加,血浆中TG和TC含量极显著升高(P<0.01),发生胰岛素抵抗,肝脏脂肪沉积明显,肝细胞发生脂肪变性,模型组大鼠发生NAFLD,结果与其一致。10周后采集大鼠血浆和肝脏,血液生化指标的测定发现模型组血浆中TG、TC和TBA含量和ALT、AST、AKP和LDH活性极显著上升(P<0.01);肝指数极显著高于空白组(P<0.01),且肝脏病理组织学切片观察脂肪沉积进一步加剧,因此发现长期饲喂高脂饮食诱导大鼠NAFLD作用明显。
研究中从第5周开始给造模成功的大鼠进行灌胃给药DIZE,同时以抗脂肪肝药物LOV做为阳性对照[23],结果发现DIZE和LOV均可以有效减缓NAFLD大鼠增重,甚至在第8周体重与空白组相近。至第10周结束时DIZE组大鼠的体重和肝指数较大程度降低,血浆中HDL-C水平显著升高(P<0.05),同时血浆中TG、TC等含量极显著下降(P<0.01)以及ALT、AST等酶活水平显著降低(P<0.05),DIZE组肝脏组织中HDL-C含量显著升高(P<0.05),LDL-C和NEFA水平降低但差异不显著。研究结果显示,相比于阳性用药组,DIZE组在多项指标中表现出较“温和”的作用,即用药后缓解效果没有LOV组强烈,但是在经过一定周期的使用后达到与LOV相同的效果。提示DIZE可能并没有直接降血脂,其作为ACE2的激活剂可能通过激活RAS代偿通路间接发挥作用,因此作用周期较长,而DIZE在NAFLD中如何发挥作用的具体机制尚需进一步研究。
综上,DIZE对高脂饮食诱导的NAFLD大鼠的肝脏损伤等具有较好的保护作用,可以显著的降低血脂水平,改善血糖调节能力及肝脏脂肪蓄积和脂肪变性。本研究发现DIZE具有与抗脂肪肝药物类似的作用,因此其可能具有治疗NAFLD的潜力,为DIZE在治疗NAFLD的药物研发中提供了理论依据。

